Какие физические свойства металлов определяются их кристаллическим строением
Физические свойства металлов отличают их от неметаллов. Все металлы, кроме ртути, – твёрдые кристаллические вещества, являющиеся восстановителями в окислительно-восстановительных реакциях.

Положение в таблице Менделеева
Металлы занимают I-II группы и побочные подгруппы III-VIII групп. Металлические свойства, т.е. способность отдавать валентные электроны или окисляться, увеличиваются сверху вниз по мере увеличения количества энергетических уровней. Слева направо металлические свойства ослабевают, поэтому наиболее активные металлы находятся в I-II группах, главных подгруппах. Это щелочные и щелочноземельные металлы.
Определить степень активности металлов можно по электрохимическому ряду напряжений. Металлы, стоящие до водорода, наиболее активны. После водорода стоят слабоактивные металлы, не вступающие в реакцию с большинством веществ.

Рис. 1. Электрохимический ряд напряжений металлов.
Строение
Вне зависимости от активности все металлы имеют общее строение. Атомы в простом металле расположены не хаотично, как в аморфных веществах, а упорядоченно – в виде кристаллической решётки. Удерживает атомы в одном положении металлическая связь.
Такой вид связи осуществляется за счёт положительно заряженных ионов, находящихся в узлах кристаллической ячейки (единицы решётки), и отрицательно заряженных свободных электронов, которые образуют так называемый электронный газ. Электроны отделились от атомов, превратив их в ионы, и стали перемещаться в решётке хаотично, скрепляя ионы вместе. Без электронов решётка бы распалась за счёт отторжения одинаково заряженных ионов.
Различают три типа кристаллической решётки. Кубическая объемно-центрированная состоит из 9 ионов и характерна хрому, железу, вольфраму. Кубическая гранецентрированная включает 14 ионов и свойственная свинцу, алюминию, серебру. Из 17 ионов состоит гексагональная плотноупакованная решётка цинка, титана, магния.
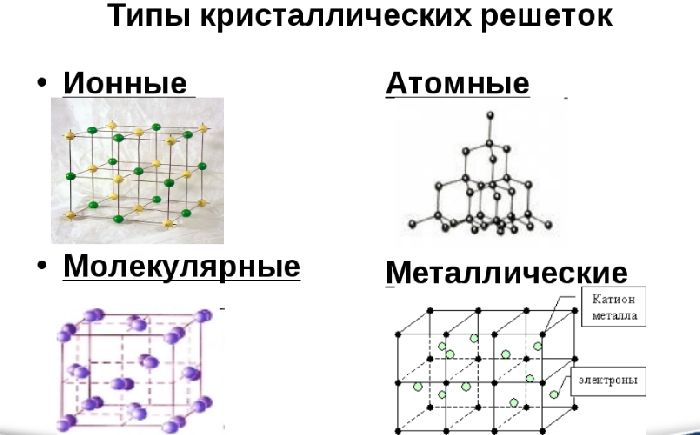
Рис. 2. Виды кристаллических решёток.
Свойства
Строение кристаллической решётки определяет основные физические и химические свойства металлов. Металлы блестят, плавятся, проводят тепло и электричество. Промышленность и металлургия нашли применение физическим свойствам металлов в изготовлении деталей, фольги, корпусов машин, зеркал, бытовой и промышленной химии. Особенности металлов и их использование представлены в таблице физических свойств металлов.
Свойства | Особенности | Примеры | Применение |
Металлический блеск | Способность отражать солнечный свет | Наиболее блестящими металлами являются Hg, Ag, Pd | Изготовление зеркал |
Плотность | Лёгкие – имеют плотность меньше 5 г/см3 | Na, K, Ba, Mg, Al. Самый лёгкий металл – литий с плотностью 0,533 г/см3 | Изготовление облицовки, деталей самолётов |
Тяжёлые – имеют плотность больше 5 г/см3 | Sn, Fe, Zn, Au, Pb, Hg. Самый тяжёлый – осмий с плотностью 22,5 г/см3 | Использование в сплавах | |
Пластичность | Способность изменять форму без разрушений (можно раскатать в тонкую фольгу) | Наиболее пластичные – Au, Cu, Ag. Хрупкие – Zn, Sn, Bi, Mn | Формовка, сгибание труб, изготовление проволоки |
Твёрдость | Мягкие – режутся ножом | Na, K, In | Изготовление мыла, стекла, удобрений |
Твёрдые – сравнимы по твёрдости с алмазом | Самый твёрдый – хром, режет стекло | Изготовление несущих конструкций | |
Температура плавления | Легкоплавкие – температура плавления ниже 1000°С | Hg (38,9°С), Ga (29,78°С), Cs (28,5°С), Zn (419,5°C) | Производство радиотехники, жести |
Тугоплавкие – температура плавления выше 1000°С | Cr (1890°С), Mo (2620°С), V (1900°С). Наиболее тугоплавкий – вольфрам (3420°С) | Изготовление ламп накаливания | |
Теплопроводность | Способность передавать тепло другим телам | Лучше всего проводят ток и тепло Ag, Cu, Au, Al | Приготовление пищи в металлической посуде |
Электропроводность | Способность проводить электрический ток за счёт свободных электронов | Передача электричества по проводам |

Рис. 3. Примеры применения металлов.
Что мы узнали?
Из урока 9 класса узнали о физических свойствах металлов. Кратко рассмотрели положение металлов в периодической таблице и особенности строения кристаллической решётки. Благодаря строению металлы обладают пластичностью, твёрдостью, способностью плавиться, проводить электрический ток и тепло. Свойства металлов неоднородны. Различают лёгкие и тяжёлые металлы, лёгкоплавкие и тугоплавкие, мягкие и твёрдые. Физические свойства используются для изготовления сплавов, электрических проводов, посуды, мыла, стекла, конструкций различной формы.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
-
Лидия Маслова
10/10
Оценка доклада
Средняя оценка: 4.2. Всего получено оценок: 155.
Источник
Металлы — один из самых распространенных веществ в материальной культуре человека. Тысячелетиями медь, железо, серебро и золото были основным материалом для производства оружия, инструментов, ответственных частей транспорта и механизмов, деталей домашней утвари и украшений. В XIX веке, с освоением технологии получения чугуна, металлы пришли в строительство и станкостроение. XX век был веком металлов.
Металлы
В нашу жизнь вошли алюминий, титан, бор и многие более редкие металлы. Используя их, человечество шагнуло в небо, космос и глубины океана. Металлы сделали возможным массовое производство домашней бытовой техники. В конце XX века пластмассы и композитные вещества ощутимо потеснили металлы с лидирующих позиций. Основные характеристики металлов — прочность, упругость и пластичность определяются их физико-химическими свойствами и атомным строением.
Основные группы металлов в промышленности
Индустрия делит металлы на большие группы:
- Черные.
- Цветные легкие.
- Цветные тяжелые.
- Благородные.
- Редкоземельные и щелочные.
Черные металлы
В эту группу входят железо, марганец, хром и их сплавы. Группа также включает в себя стали, чугуны и ферросплавы. Эти вещества обладают хорошей электропроводностью и уникальными магнитными характеристиками.
Черные металлы
Черные металлы покрывают до 90% мировой потребности в металлоизделиях.
Легкие цветные металлы
Отличаются низкой плотностью. Группа включает в себя алюминий, титан, магний. Эти реже встречаются, чем железо, и обходятся дороже в добыче руды и в производстве. Они используются там, где малый вес изделия или детали окупает ее большую стоимость – в самолетостроении, производстве электроники, в коммуникационной индустрии.
Легкие цветные металлы
Титан не вызывает отторжения со стороны иммунной системы и применяется в протезировании костной ткани.
Тяжелые цветные металлы
Это элементы с большим удельным весом, такие, как медь, олово, свинец, цинк и никель. Обладают хорошей электропроводностью.
Они широко используются как катализаторы реакций, в изготовлении электроматериалов, в электронике, на транспорте – везде, где требуются достаточно прочные, упругие и коррозионностойкие материалы.
Благородные металлы
В эту группу входят золото, серебро, платина, а также редко встречающееся рутений, родий, палладий, осмий, иридий. Они обладают наибольшим удельным весом, высокой коррозионной устойчивостью и высокой электрической и тепловой проводимостью.
На заре человечества золото, серебро и платина применялись как универсальный платежный инструмент и как средство накопления богатств. С развитием цифровой экономики и переходом платежей в виртуальность важнее стаи их уникальные физические свойства
Редкоземельные и щелочные
К редкоземельным относятся скандий, иттрий, лантан и еще 15 редких элементов. Эти элементы отличаются значительным удельным весом, высокой химической активностью и применяются в высокотехнологичных отраслях.
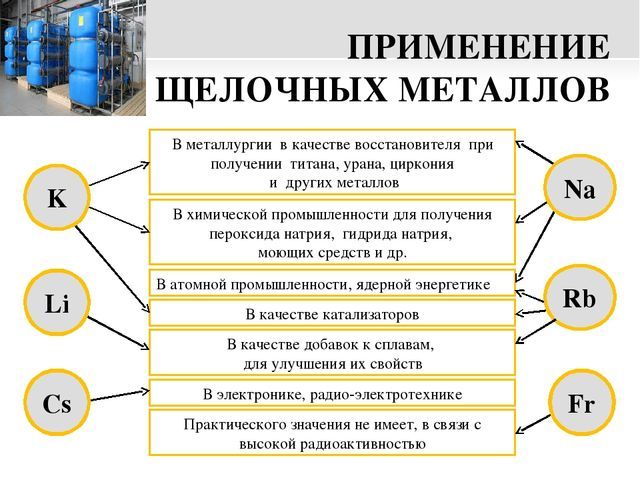
К щелочным относятся литий, калий, натрий и другие. Все они отличаются малым удельным весом и исключительной химической активностью и при реакции с водой образуют щелочи, широко применяемы в быту и промышленности в составе мыла и других моющих средств.
Щелочные металлы
Классификация металлов по химическому составу
Химические свойства чистых элементов определяются строением атомов реальных металлов и прежде всего их атомным числом, характеризующим их способность реагировать с водородом, кислородом и другими элементами. Химические характеристики реально применяемых металлов могут сильно отличаться от параметров чистого вещества как в лучшую, так и в худшую сторону.
Нежелательные добавки называют примесями, а те, что вносятся преднамеренно для изменения параметров в нужную сторону — легирующими присадками.
Общепризнанной является классификация, основанная на указании главного компонента сплава.
Атомно — кристаллическое строение металлов
Внутреннее строение металлов и их характеристики определяют их физико-химические свойства. Электроны на внешних орбитах атомов слабо связаны с ядром и имеют отрицательный заряд. При наличии разницы потенциалов электроны мигрируют к положительному полюсу, создавая электрический ток. Это физическое явление обуславливает электропроводность.
Кристаллическое строение свойственно металлам и их сплавам в твердом фазовом состоянии. Атомы выстраиваются в определенную объемную структуру, называемую кристаллической решеткой.
Число атомов в вершинах и на гранях этой структуры, а также дистанция между ними определяют такие физические свойства металла, как электро- и теплопроводность, вязкость, текучесть и т.д.
Кристаллическое строение металлов и сплавов может быть двух типов:
- Межатомная дистанция одинакова по всем направлениям. Это так называемое изотропное строение. При этом физические свойства кристалла также одинаковы по всем направлениям.
- Межатомное расстояние по горизонтали и по вертикали разное. Такой кристалл называют анизотропным, и его физические параметры меняются в зависимости от направления.
Атомно-кристаллическое строение металлов
В реальном куске металлов, составленному из множества изолированных кристаллических фрагментов, атомно кристаллическое строение принадлежит к третьему типу — квазиизотропному. В среднем свойства такого куска близки к изотропным.
При выстраивании кристаллической решетки некоторые атомы не попадают на свое место, смещаются или теряются. В этом случае говорят о дефектах кристаллического строения металлов. Дефекты структуры отрицательно влияют на свойства изделия, особенно если оно должно быть монокристаллом, как, например, в электронике, лазерной технике и других отраслях высоких технологий.
Физические свойства металлов
Физические свойства определяются внутренним строением металлов.
Главное отличие металлов от других элементов — это их электропроводность и магнитные свойства.
И хотя ученые создали неметаллические материалы, обладающие другим строением, но такими же свойствами, как у металлов и сплавов, они еще слишком дороги для массового применения. Многие химически чистые металлы обладают недостаточной прочностью для практических применений, чтобы исправить ситуацию, в технике и строительстве используют их сплавы.
Физические свойства металлов
Добавление тех или иных присадок приводит к росту прочность получаемого вещества в десятки раз по отношению к исходному элементу.
Электронное строение металлов и их особенности
Внутреннее строение реальных металлов определяет их физико-химические параметры.
Кристаллическая решетка металлов
Все металлы в твердом фазовом состоянии имеют кристаллическое строение. Это пространственное образование из многократно повторяющихся первичных структур называют кристаллической решеткой.
схема кристаллической решетки.
Кристаллическое строение металлов
Кристаллическое строение металлов и сплавов может быть двух типов:
- Межатомная дистанция равна по всем направлениям. Это так называемое изотропное строение. При этом физические свойства кристалла также одинаковы по всем направлениям.
- Межатомное расстояние по горизонтали и по вертикали разное. Такой кристалл называют анизотропным, его параметры зависят от направления.
В реальном куске металлов, который состоит из множества кристаллических фрагментов, атомно кристаллическое строение принадлежит к третьему типу — квазиизотропному. Усредненные параметры такого куска близки к изотропным.
Типы кристаллических решеток
Дистанцию соседними атомами называют параметром решетки, у разных металлов он составляет 2 — 6 ангстрем. Существуют три основных типа кристаллических решеток:
- Кубическая: объемно-центрированная — включает в себя девять атомов. Свойственна железу, хрому, молибдену, и ванадию.
- Кубическая гранецентрированная: включает в себя уже 14 атомов. Присуща меди, золоту, свинцу, алюминию.
- Гексагональная: атомов уже 17 и размещены они наиболее плотно. Так кристаллизуются магний, цинк кадмий и другие.
Уникальная возможность железа заключается в том, что до 910°С оно имеет кубическую объемно-центрированную структуру, а при нагреве свыше этой температуры переходит к гранецентрированной.
Кристаллическое строение сплавов
Сплав это материал, состоящий из двух и более химических элементов. В его состав могут входить как металлы, так и неметаллы. Например, бронза — это сплав меди и олова, а чугун — сплав железа и углерода. Кроме основных, в состав могут входить и другие вещества, содержащиеся в небольших количествах. Если их добавляют специально и улучшают свойства материала, их называют легирующими присадками, если ухудшают — вредными примесями.
Кристаллическое строение сплавов сложнее, чем металлов.
Строение сплавов
Оно определяется взаимовлиянием компонентов при образовании кристалла, и принадлежит к трем подвидам:
- Твердые растворы. Один элемент растворяется в другом. Ведущий элемент строит кристаллическую структуру, а атомы второстепенного элемента размещаются в объеме этой решетки.
- Химическое соединение. Элементы химически реагируют друг с другом, образуя новое соединение. Из его молекул и составляется кристаллическая решетка.
- Механическая смесь. Элементы сплава не реагируют друг с другом. Каждый строит свои кристаллические структуры, срастающиеся в независимые кристаллы. Сплав будет представлять собой затвердевшую смесь из множества кристалликов двух разных типов. Такое вещество будет иметь собственную температуру перехода в жидкую фазу.
Физические свойства сплавов могут заметно меняться при изменении процентного соотношения составляющих.
Кристаллизация сплавов
Первичная кристаллизация — это затвердевание расплава с образованием кристаллических решеток. Пространственные атомные и молекулярные структуры, возникающие в ходе такого процесса, оказывают решающее влияние на свойства получаемого сплава.
Сначала в остывающем расплаве возникают центры кристаллизации, вокруг них в ходе процесса и нарастают кристаллы, многократно повторяя структуру центра. В качестве центров кристаллизации могут выступать:
- Первые образовавшиеся кристаллы в зонах локального охлаждения, чаще всего у стенок литейной формы.
- Частички неметаллических примесей.
- Тугоплавкие примеси, уже находящиеся в твердой форме.
Процесс кристаллизации металлов и сплавов
Кристаллы обычно растут в направлении роста градиента температуры. Если рост решеток не встречает физических препятствий, образуются ветвящиеся кристаллические структуры, напоминающие кораллы — дендриты. Если они растут из разных центров и встречаются в расплаве, то препятствуют росту друг друга и искажают свою форму. Такие искаженные кристаллы – это кристаллиты, или зерна. Совокупность отдельных зерен срастается в поликристаллическое тело.
Отдельные кристаллиты достигают размеров от одного до 10 000 микрон и по-разному развернуты в пространстве. На стыках отдельных кристаллитов образуется граничный слой, в котором кристаллические решетки разорваны. Такие слои обладают измененными химическими и физическими свойствами.
Решетки кристаллитов могут обладать разными дефектами структуры:
- точечные;
- линейные;
- поверхностные;
Дефекты кристаллического строения металлов
Дефекты определяются отсутствием атома или группы атомов в вершинах или гранях кристаллической решетки, смещением этих атомов со своих мест или замещением атома или их группы атомами или молекулами примесей.
Источник
Цель: Опираясь на ранее полученные знания, подвести обучающихся к
пониманию представлений о металлах как химических элементах и простых веществах.
Образовательные задачи:
1) Познакомить обучающихся со строением и общими свойствами металлов, исходя
из их положения в периодической системе и строения атомов.
2) Дать понятие о металлической связи и металлической кристаллической решетке.
Добавить, обобщить и углубить знания о физических
свойствах металлов.
Воспитательные задачи:
1) Расширить и углубить знания учащихся о роли металлов в организме, значении
в жизнедеятельности человека, показать разнообразие их свойств.
2) Продолжить формирование мировоззренческих взглядов (умения устанавливать
причинно-следственные связи между строением и
свойствами металлов, доказывать переход количественных изменений в
качественные).
3) Акцентировать внимание обучающихся на возможности интеграции курсов химии,
литературы и истории, развивать представления о познаваемости мира.
4) Прививать навыки самостоятельной работы, учить четко и грамотно выражать свои
мысли. Уметь слушать своего товарища.
Развивающие задачи:
1) Научить работать с дополнительной литературой и другими источниками
информации, готовить доклады,
2) Выступать перед аудиторией,
3) Формировать критическое мышление, умение анализировать, выделять главное,
обобщать и делать выводы.
Тип урока: Урок усвоения новых знаний с мультимедийным сопровождением.
Оборудование. Компьютер, проектор, экран; учебная презентация по данной
теме, выполненная на компьютере в программе Power Point, созданная учителем,
коллекции “Металлы и сплавы”; шаростержневые модели кристаллической решетки
металлов железа, магния, меди; таблицы: “Изменение атомного радиуса в периоде,
группе”, “Строение металлической кристаллической решетки”, учебник химии 9 класс
автор О.С. Габриелян 2010 год.
Ход урока
I. Ориентировочно-мотивационный этап.
Учитель: – Здравствуйте, ребята. Я рада вас видеть на своем уроке здоровыми и
бодрыми. Я думаю, что и у вас прекрасное настроение как у ромашки на
слайде презентации. Слайд 1.
А сейчас обратите внимание на лотки, что стоят на ваших столах. В них образцы
веществ. Причем, предложенные вашему вниманию вещества, против обыкновения, не
подписаны. Ваша задача состоит в том, чтобы распределить эти вещества по
каким-то признакам, то есть как-то их проклассифицировать. Признаки выберите
сами.
Учитель: – Какие признаки? (Твердость, металлический блеск.)
Учитель: – На какие группы распределились вещества? (Металлы и
неметаллы.)
Учитель: – Каких веществ больше?
В настоящее время известно более 80 металлов, точно сосчитаете дома. Чем они
отличаются друг от друга?
Учитель: – Они отличаются друг от друга свойствами: цветом, блеском,
твердостью.
Учитель: Как вы думаете, что мы сегодня будем изучать? Металлы. Да, мы
начинаем изучение большой темы “Металлы” (на экране проецируем тему урока)
Слайд 2.
Презентацию можно получить у автора статьи.
Записываем дату и тему урока в тетради.
Эпиграф нашего урока. “Мощь и сила науки – во множестве фактов, цель – в
обобщении этого множества”. Д.И.Менделеев. Слайд 3
“Внимательно осмотритесь вокруг. Где бы вы ни были: дома или в школе, на
улице или в транспорте – вы увидите, какое множество металлов трудится вокруг
нас и для нас.Слайд 4.
Учитель: Основываясь на собственный опыт, знания из курса физики, биологии,
литературы давайте вспомним, что мы знаем о металлах?Поделитесь своими
знаниями. (Беседа с классом.)
Учитель: Что мы должны узнать?
Цели:(Слайд 5.)
Учитель: Чтобы ответить на эти вопросы мы должны с вами выполнить
большую работу по изучению нового материала и приобретению знаний.
“Свойства веществ зависят от строения”. Сегодня эту зависимость мы
рассматриваем применительно к металлам. Давайте проследим
причинно-следственную связь между строением атома, химической связью и
физическими свойствами.
Строение атома – металлическая связь – металлическая кристаллическая решетка
– физические свойства – практическое применение
Учитель: – Ответьте на следующие вопросы:
1) Где расположены элементы– металлы? Слайд 6.
2) Какое место занимают металлы в периодической системе химических элементов
Д.И.Менделеева?
В периодической системе химических элементов каждый период, кроме первого,
начинается с активного металла. Эти элементы образуют главную подгруппу I группы
и называются щелочными металлами. Свое название они получили от названия
соответствующих им гидроксидов, хорошо растворимых в воде, – щелочей.
Следующие за щелочными металлами элементы, составляющие главную подгруппу II
группы, также являются металлами. Из этих металлов кальций, стронций, барий и
радий называют щелочноземельными металлами. Такое название они получили потому,
что их оксиды, которые алхимики называли “землями”, при растворении в воде
образуют щелочи.
Далее к металлам относят элементы главных подгрупп: III группы, исключая бор;
IV группы – германий, олово, свинец; V группы – сурьму и висмут; VI группы –
полоний.
Что касается элементов побочных подгрупп, то все они – металлы. Таким
образом, если в периодической системе провести диагональ от В к Астату через
элементы главных подгрупп, то по диагонали и над ней будут располагаться
неметаллы, а под ней – металлы. В периодах: в малых – металлы расположены в
начале, в больших – в четных рядах и начале нечетных. Слайд 7.
Из положения металлов в периодической системе можно определить и особенности
строения их атомов. Слайд 8.
1) На внешнем энергетическом уровне – 1–3 электрона.
2) У металлов сравнительно большой радиус атома
3) В периоде восстановительные свойства уменьшаются, т.к. увеличивается заряд
ядра, число электронов на внешнем слое.
4) В группе в главной подгруппе восстановительные свойства увеличиваются, т.к.
возрастает радиус атома.
Учитель: Давайте распишем электронное строение атомов металлов Na,
Ca, Al (3 обучающихся возле доски.) Вместе проверяем даем оценку.
Загадочная пауза Слайд 9. (Загадки про металлы.)
Учитель: Атомы – металлы образуют простые вещества, соединяясь
посредством химической связи. Какой? Слайд 10.
Учитель: Что такое металлическая связь? Связь в металлах и сплавах
между атом – ионами посредством обобществленных электронов называется
металлической. Веществам с металлической связью присущи металлические
кристаллические решетки. Свойства металлов обусловлены строением их кристаллов.
В узлах металлических кристаллических решеток располагаются атомы и ионы
металлов, связанные посредством обобществленных электронов, электронов, которые
оторвались от конкретных атомов и стали принадлежать всему кристаллу. Эти
электроны компенсируют силы электростатического отталкивания между
положительными ионами, связывают их, обеспечивают устойчивость металлической
решетки. Такой тип связи называется металлической. Она обусловливает все
важнейшие физические свойства металлов. Слайд 11.
Учитель: У меня на столе представлены кристаллические решетки металлов
магния, меди и железа дайте вместе рассмотрим строение кристаллических решеток
этих металлов. (Три обучающихся возле доски рассказывают о строении предложенных
решеток металлов.)
Физкультминутка.
Учитель: Какими физическими свойствами обладают металлы? Слайд 11
Учитель подчеркивает, что физические свойства металлов определяются их
строением.
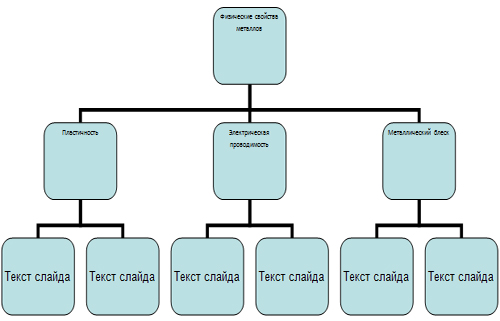
Индивидуальные задания обучающимся. По материалу параграфа 6 заполнить
таблицу
| Физическое свойство металлов | Чем оно обусловлено | Примеры |
| Пластичность | ||
| Электрическая проводимость | ||
| Металлический блеск |
Остальные обучающиеся, для изучения физических свойств металлов по материалу
параграфа 6 (страница 30–32)делятся на 3 группы по свойствам, готовятся,
пишут свою часть схемы, выходят к доске приклеивают свои листочки и отвечают.
Класс может задавать вопросы. Обучающиеся 4 группы готовят и задают вопросы
остальным обучающимся групп.
Заполнение схемы по ходу изучения нового материала (по выступлениям
обучающихся от каждой группы).
После заполнения схемы возвращаемся к образцам металлов в лотках на столах
обучающихся и выполняем Лабораторный опыт “Ознакомление с образцами металлов”
на карточках подписаны названия металлов (железо, цинк, олово, алюминий,
свинец, серебро).
Физические свойства металлов.
Пластичность. Слайд 13. Металлы обладают пластичностью, ковкостью
и прочностью. Благодаря свободному перемещению электронов по всему кристаллу
разрыв связей не происходит, т. к. отдельные слои в кристалле могут смещаться
относительно друг друга. Это придает металлам пластичность-
способность изменять свою форму без разрыва химических связей. Металлы,
обладающие высокой пластичностью- золото, серебро,
медь, олово, железо, алюминий.
Просмотр фрагмента “Кузнечное дело” с диска “Неорганическая химия”.
Электропроводность.Лучшие проводники электричества – серебро и
медь, худшие – марганец, свинец и ртуть. Металлы обладают электрической
проводимостью благодаря наличию свободных электронов или электронного “газа”.
Хаотически движущиеся в металле электроны под воздействием приложенного
электрического напряжения приобретают направленное движение, в результате чего
возникает электрический ток.
Теплопроводность.
Теплопроводность металлов, как правило, соответствует электропроводности.
Она обусловлена большой подвижностью свободных электронов, которые, сталкиваясь
с колеблющими ионами и атомами, обмениваются с ними энергией. Поэтому происходит
быстрое выравнивание температуры по всему куску металла. Лучшая проводимость у
серебра, меди, худшая – у висмута, ртути.
Металлический блеск.
Для всех металлов характерен металлический блеск: серый цвет или
непрозразрачность. Свободные электроны, заполняющие межатомное пространство в
решетке, отражают световые лучи, поэтому металлы имеют металлический блеск
(серебристо-белый и серый). Только золото и медь в большей степени поглощают
короткие волны (близкие к фиолетовому цвету) и отражают длинные волны светового
спектра, поэтому имеют желтый и оранжевый цвет. Самые блестящие металлы-
ртуть, серебро.
Плотность.Слайд 14.Все металлы делятся на легкие
(с плотностью до 5г/см3) и тяжелые (с плотностью больше 5г/см3).
Легкие: Li, Na, K, Mg, Al Тяжелые: Zn, Cu, Sn, Ag, Au
Температура плавления. Слайд 15, 16.
Металлы делятся на легкоплавкие и тугоплавкие.
Твердость. Все металлы, кроме ртути, твердые. Но это свойство различно у
каждого металла. Слайд 17.
Самые мягкие металлы- натрий, калий, индий, их
можно резать ножом самый твердый металл – хром,
царапает стекло. Рассмотреть образцы щелочных и щелочноземельных металлов.
С представителями некоторых металлов мы сейчас познакомимся
Вступление к сообщениям обучающихся “Заморочки из бочки”
– Алхимики старались его получить используя философский камень для того,
чтобы править миром и вечно жить;
– Из-за этого металла пролилось много крови;
– Его используют в ювелирной промышленности) Это – Золото. (Сообщение про
золото. Слайд 18–27.)
Вступление к сообщению обучающегося о меди “МАСКА, Я ТЕБЯ ЗНАЮ!” Звон
колокольчика под тканью.
Следующий металл, о котором мы поговорим, – медь. Медь называют
музыкальным металлом. Почему, сейчас мы узнаем. Слайд 28.Когда на
Русь нападали полчища врагов, когда нужно было собрать народ на важные собрания,
ударяли в колокола. Давайте послушаем запись звонов ростовских колоколов. В
народе говорят, что колокольный звон делает человека добрее, справедливее. Все
злое, нехорошее от него уходит. Искусство колокольных дел мастеров осталось
составной частью национальной культуры. И поныне остается загадкой, как удалось
нашим предкам без измерительных приборов и точного анализа сплавов создать
“стозвонные” колокола – каждый со своим звоном (прослушивание звона
колоколов). После Слайда 31.
Сегодня медь широко используется в электротехнике и приборостроении. Но
давайте рассмотрим, как и где применяли раньше медь и ее значение сегодня.
Слайд 32–36.
Вступление к сообщению про железо (загадка – стихотворение).
Важнейший, древний элемент.
В тяжелой индустрии главный,
Знаком с ним школьник и студент.
Родился в огненной стихии,
Расплав его течет рекой.
Важнее нет в металлургии –
Он нужен всей стране родной.
Сообщение про железо. Слайд 37–42
А теперь, внимание! Знакомимся с самыми, самыми металлами. Слайд
43.
Проверка знаний по результатам изучения нового материала (тест на компьютере)
обмениваемся работами и проверяем с выставлением оценок по ключу
Подведение итогов. “Свойства веществ зависят от строения”. Сегодня эту
зависимость мы рассмотрели применительно к металлам. Проследили
причинно-следственную связь между строением атома, химической связью и
физическими свойствами.
Выставление оценок за урок.
Проведение рефлексии по результатам урока. Слайд 44.
Рефлексия. Чтобы осмыслить все увиденное, услышанное и выполненное на нашем
уроке мы предлагаем вам рефлексивный тест, направленный на оценку своих
собственных действий. Рефлексивный тест. Я узнал (а) много нового. Мне это
пригодится в жизни. На уроке было над чем, подумать. На все возникшие у меня в
ходе урока вопросы я получил (а) ответы. На уроке я поработал (а) добросовестно
и цели урока достиг(ла).
Учитель:
Сейчас прозвенит долгожданный звонок,
Увы, но к концу подошел наш урок.
Прошу, уберите рабочее место.
Давайте без слов, и, пожалуй, без жестов.
А я благодарность вам всем объявляю,
Проверив работы,
В журнал выставляю
Отметки все ваши, надеюсь привычно,
Что будут они хорошо и отлично.
Большое спасибо я вам говорю,
Мы цели достигли, благодарю.
Домашнее задание: параграф 5, 6 составить ребусы или загадки про
металлы, подготовить сообщения про сплавы меди и сплавы железа, составить
презентацию по теме “Сплавы”
Источник
