Какие физические свойства меди и алюминия

 Тяжело представить современный мир без такого металла, как алюминий. Благодаря таким своим качествам, как лёгкость, стойкость к коррозии, прочность и возможности входить в соединения с другими металлами алюминий стал важнейшим конструкционным материалом XX и XXI века.
Тяжело представить современный мир без такого металла, как алюминий. Благодаря таким своим качествам, как лёгкость, стойкость к коррозии, прочность и возможности входить в соединения с другими металлами алюминий стал важнейшим конструкционным материалом XX и XXI века.
Этот серебристый металл применяется во многих отраслях промышленности: в автомобилестроении, самолётостроении, в строительстве и безусловно, в электроэнергетике. Алюминий является 13 элементом в периодической таблице Дмитрия Ивановича Менделеева. На данный момент подсчитано, что на него приходится примерно 8% от всей массы твёрдой земной коры и он является 3 химическим элементом по распространённости на планете Земля, уступая место только кислороду и кремнию.
История открытия
 Но так как алюминий обладает высокой химической активностью, то в чистом виде он практически не встречается в природе, поэтому в отличие от многих других металлов о нём стало известно только в начале XIX века, когда алюминий был формально получен.
Но так как алюминий обладает высокой химической активностью, то в чистом виде он практически не встречается в природе, поэтому в отличие от многих других металлов о нём стало известно только в начале XIX века, когда алюминий был формально получен.
В 1824 году датский физик в процессе электролиза впервые получил алюминий. Хотя металл и содержал примеси ртути и калия, этот случай является первым доказанным случаем получения алюминия в лабораторных условиях.
Имя учёного, привёдшего к революционному методу, было Ханс Кристиан Эрстед. Но понадобилось ещё почти полвека, чтобы разработать технологии для получения его в промышленном производстве. Больше всего природный алюминий встречается в составе минералов квасцов. Именно благодаря этому минералу алюминий и получил своё название, которое на латыни звучит Alumen.
Алюминиевая руда
В современном мире при производстве алюминия применяют широко распространённую в природе алюминиевую руду — бокситы. Бокситы являются глинистой горной породой, в состав которой входят разнообразные модификации гидроксида с такими примесями, как хром, кремний, титан, сера, ванадий, карбонатные соли магния, кальций, железо.
В бокситах можно встретить почти половину таблицы химических элементов Менделеева. Ценность этой руды состоит в том, что помимо одной тонны алюминия, добытой из четырёх тонн бокситов, ценность для промышленности имеют и примеси. Из бокситов в процессе переработки получают белый порошок — оксид алюминия (Al2O3), который ещё имеет название «глинозём». Именно из глинозёма путём электролиза на современных предприятиях производят металл.
Роль электроэнергетики в производстве
 При производстве алюминия затрачивается колоссальное количество электроэнергии. Для того чтобы получить одну тонну металла, энергии тратится столько, что её хватило бы на нужды 100-квартирного дома на протяжении целого месяца. А именно 15 МВт*ч. Поэтому большинство алюминиевых заводов располагаются недалеко от гидроэлектростанций, атомных электростанций или имеют собственные тепловые электростанции, а также развитую структуру электроэнергетических систем и сетей.
При производстве алюминия затрачивается колоссальное количество электроэнергии. Для того чтобы получить одну тонну металла, энергии тратится столько, что её хватило бы на нужды 100-квартирного дома на протяжении целого месяца. А именно 15 МВт*ч. Поэтому большинство алюминиевых заводов располагаются недалеко от гидроэлектростанций, атомных электростанций или имеют собственные тепловые электростанции, а также развитую структуру электроэнергетических систем и сетей.
Свойства алюминия
В алюминии заложено редкое сочетание таких свойств, как:
- небольшой вес;
- пластика, электропроводность;
- возможность образовывать сплавы с другими металлами.
Поверхность алюминия всегда покрыта тончайшей оксидной плёнкой, которая является очень прочной и не позволяет алюминию подвергаться коррозии. Этот материал и в горячем, и в холодном состоянии легко поддаётся обработке давлением. Такие методы обработки, как прокатка, штамповка, волочение часто производятся на предприятии при производстве тех или иных деталей.
 Ещё одна ценность алюминия заключается в том, что он не токсичен, не подвержен горению и не нуждается в дополнительной окраске: это делает его применение в авто- и авиастроении незаменимым элементом. Ковкость алюминия удивляет: из него удалось изготовить лист и очень тонкую проволоку толщиной всего в 4 микрона, а толщины фольги — добиться в три раза тоньше волоса человека.
Ещё одна ценность алюминия заключается в том, что он не токсичен, не подвержен горению и не нуждается в дополнительной окраске: это делает его применение в авто- и авиастроении незаменимым элементом. Ковкость алюминия удивляет: из него удалось изготовить лист и очень тонкую проволоку толщиной всего в 4 микрона, а толщины фольги — добиться в три раза тоньше волоса человека.
Благодаря возможности алюминия образовывать соединения с большой группой химических элементов появилась большая группа сплавов. Например, сочетание алюминия и цинка используется в создании корпусов различных видов планшетов и телефонов, алюминий в сочетании магния и кремния используется при производстве различных типов двигателей, в составе элементов шасси и всевозможных двигателей. Различные сплавы применяются и в электроэнергетике.
Современная наука продолжает изучать и изобретать новейшие типы алюминиевых сплавов. Сегодня не существует ни одной отрасли промышленности, где бы не использовался алюминий. Можно с уверенностью сказать, что такие виды промышленности, как авиационная, космическая, энергетическая, автомобильная, пищевая, электронная получили своё современное развитие благодаря алюминию и его сплавам.
Нельзя не упомянуть о таком важном свойстве, как теплопроводность. Ведь именно это свойство металла требуется при производстве систем отопления, электропродукции, в авто- и авиастроении, при изготовлении тормозных систем и тому подобных. Теплоёмкость — это процесс переноса тепловой энергии в физических телах или их частицах от горячих объектов к холодным на основе закона Фурье. Конкурентом алюминия в данной области является медь.
 Так какой же металл имеет большую теплопроводность? Это не совсем однозначный вопрос. Известно, что алюминий по теплопроводности уступает меди при средних температурах, но когда заходит речь о низких температурах, а именно при 50 К, тогда теплопроводность алюминия значительно возрастает, в то время как у меди теплопроводность становится ниже. Температура плавления алюминия составляет 933,61 К, это примерно 660 °C, в этот момент свойства Al, такие как теплопроводность и плотность, уменьшаются.
Так какой же металл имеет большую теплопроводность? Это не совсем однозначный вопрос. Известно, что алюминий по теплопроводности уступает меди при средних температурах, но когда заходит речь о низких температурах, а именно при 50 К, тогда теплопроводность алюминия значительно возрастает, в то время как у меди теплопроводность становится ниже. Температура плавления алюминия составляет 933,61 К, это примерно 660 °C, в этот момент свойства Al, такие как теплопроводность и плотность, уменьшаются.
Плотность серебристого металла определяется его температурой и зависит от его состояния. Так, при температуре в 27 °C, плотность алюминия соответственно равна 2697 кг/м3, а при температуре плавления, равной 660 °C, его плотность равняется 2368 кг/м3. Снижение плотности метала в зависимости от температуры обуславливается его расширением при непосредственном нагревании.
Таблицы свойств алюминия и меди
Далее, рассмотрим таблицы физических свойств и теплопроводности алюминия и меди при соответствии разных температур.
- плотность Cu и Al, кг/м3;
- удельная теплоёмкость Cu и Al, Дж/(кг·K);
- температуропроводность Cu и Al, м2/с;
- теплопроводность Cu и Al, Вт/(м·K);
- удельное электрическое сопротивление Cu и Al, Ом·м;
- функция Лоренца Cu и Al;
Таблица физических свойств алюминия
| T, K | кг/м3 | Дж/(кг·K) | м2 /с | Вт/(м·K) | Ом·м | L/L0 |
| 50 | – | – | 358 | 1350 | 0.0478/0.0476 | – |
| 100 | 2.725 | 483.6 | 228 | 300.4/302 | 0.442/0.440 | – |
| 200 | 2.715 | 800.2 | 109 | 236.8/237 | 1.587/1.584 | 0.78 |
| 300 | 2.697 | 903.7 | 93.8 | 235.9/237 | 2.733/2.733 | 0.88 |
| 400 | 2.675 | 951.3 | 93.6 | 238.8/240 | 3.866/3.875 | 0.94 |
| 500 | 2.665 | 991.8 | 88.8 | 234.7/236 | 4.995/5.020 | 0.96 |
| 600 | 2.652 | 1036.7 | 83.7 | 230.1/230 | 6.130/6.122 | 0.95 |
| 700 | 2.626 | 1090.2 | 78.4 | 224.4/225 | 7.350/7.322 | 0.96 |
| 800 | 2.595 | 1153.8 | 73.6 | 220.4/218 | 8.700/8.614 | 0.97 |
| 900 | 2.560 | 1228.2 | 69.2 | 217.6/210 | 10.18/10.005 | 0.99 |
| 933.61s | 2.550 | 1255.8 | 68.0 | 217.7/208 | 10.74/10.565 | 1 |
| 933.61l | 2.368 | 1176.7 | 35.2 | 98.1 | — 24.77 | 1.06 |
| 1000 | 2.350 | 1176.7 | 36.4 | 100.6 | — 25.88 | 1.06 |
| 1200 | 2.290 | 1176.7 | 39.5 | 106.4 | — 28.95 | 1.04 |
| 1400 | – | 1176.7 | 42.4 | – | — 31.77 | – |
| 1600 | – | 1176.7 | 44.8 | – | — 34.40 | – |
| 1800 | – | 1176.7 | 46.8 | – | — 36.93 | – |
Таблица физических свойств меди
| T, K | кг/м3 | Дж/(кг·K) | м2 /с | Вт/(м·K) | Ом·м | L/L0 |
| 50 | – | – | – | 1250 | 0.0518 | – |
| 100 | – | – | – | 482 | 0.348 | – |
| 200 | – | – | 130 | 413 | 1.048 | – |
| 300 | 8.933 | 385.0 | 117 | 401.9/401 | 1.725 | 0.945 |
| 400 | 8.870 | 3.97.7 | 111 | 391.5/393 | 2.402 | 0.961 |
| 500 | 8.628 | 408.0 | 107 | 385.4/386 | 3.090 | 0.976 |
| 600 | 8.779 | 416.9 | 103 | 376.9/379 | 3.792 | 0.976 |
| 700 | 8.726 | 425.1 | 99.7 | 369.7/373 | 4.514 | 0.976 |
| 800 | 8.656 | 432.9 | 96.3 | 360.8/366 | 5.262 | 0.973 |
| 900 | 8.622 | 441.7 | 93.3 | 355.3/359 | 6.041 | 0.979 |
| 1000 | 8.567 | 451.4 | 90.3 | 349.2/352 | 6.868 | 0.979 |
| 1100 | 8.509 | 464.3 | 85.5 | 337.6/346 | 7.717 | 0.972 |
| 1200 | 8.451 | 480.8 | 80.6 | 327.5/339 | 8.626 | 0.970 |
| 1300 | 8.394 | 506.5 | 75.8 | 322.1/332 | 9.592 | 0.972 |
| 1357.6s | 8.361 | 525.2 | 72.3 | 317 | 10.171 | 0.972 |
| 1357.6l | 8.00 | 513.9 | 41.2 | 175 | 21.01 | 1.08 |
| 1400 | 7.98 | 513.9 | 42.7 | 175 | 21.43 | 1.08 |
Из всего вышеперечисленного ясно видно, что алюминий является одним из приоритетных металлов в промышленности, но у него есть ещё одно свойство: этот металл и его сплавы можно переплавлять, причём неоднократно, без потерь его характеристик. Помимо прочего, это экономически выгоднее, чем добыча из руды. Так, на одной электроэнергии экономия превышает 14 кВт/ч. По подсчётам, 75% добытого за всё время алюминия и его сплавов используются по настоящее время.
Источник
 Медь – это пластичный золотисто-розовый металл с характерным металлическим блеском. В периодической системе Д. И. Менделеева этот химический элемент обозначается, как Сu (Cuprum) и находится под порядковым номером 29 в I группе (побочной подгруппе), в 4 периоде.
Медь – это пластичный золотисто-розовый металл с характерным металлическим блеском. В периодической системе Д. И. Менделеева этот химический элемент обозначается, как Сu (Cuprum) и находится под порядковым номером 29 в I группе (побочной подгруппе), в 4 периоде.
Латинское название Cuprum произошло от имени острова Кипр. Известны факты, что на Кипре ещё в III веке до нашей эры находились медные рудники и местные умельцы выплавляли медь. Купить медь можно в комании «КУПРУМ».
По данным историков, знакомству общества с медью около девяти тысячелетий. Самые древние медные изделия найдены во время археологических раскопок на местности современной Турции. Археологи обнаружили маленькие медные бусинки и пластинки для украшения одежды. Находки датируются рубежом VIII-VII тыс. до нашей эры. Из меди в древности изготавливали украшения, дорогую посуду и различные инструменты с тонким лезвием.
Великим достижением древних металлургов можно назвать получение сплава с медной основой – бронзы.
Основные свойства меди
1. Физические свойства.
На воздухе медь приобретает яркий желтовато-красный оттенок за счёт образования оксидной плёнки. Тонкие же пластинки при просвечивании зеленовато-голубого цвета. В чистом виде медь достаточно мягкая, тягучая и легко прокатывается и вытягивается. Примеси способны повысить её твёрдость.
Высокую электропроводность меди можно назвать главным свойством, определяющим её преимущественное использование. Также медь обладает очень высокой теплопроводностью. Такие примеси как железо, фосфор, олово, сурьма и мышьяк влияют на базовые свойства и уменьшают электропроводность и теплопроводность. По данным показателям медь уступает лишь серебру.
Медь обладает высокими значениями плотности, температуры плавления и температуры кипения. Важным свойством также является хорошая стойкость по отношению к коррозии. К примеру, при высокой влажности железо окисляется значительно быстрее.
Медь хорошо поддаётся обработке: прокатывается в медный лист и медный пруток, протягивается в медную проволоку с толщиной, доведённой до тысячных долей миллиметра. Этот металл является диамагнетиком, то есть намагничивается против направления внешнего магнитного поля.

2. Химические свойства.
Медь является сравнительно малоактивным металлом. В нормальных условиях на сухом воздухе её окисления не происходит. Она легко реагирует с галогенами, селеном и серой. Кислоты без окислительных свойств не оказывают воздействия на медь. С водородом, углеродом и азотом химических реакций нет. На влажном воздухе происходит окисление с образованием карбоната меди (II) – верхнего слоя платины.
Медь обладает амфотерностью, то есть в земной коре образует катионы и анионы. В зависимости от условий, соединения меди проявляют кислотные или основные свойства.

Способы получения меди
В природе медь существует в соединениях и в виде самородков. Соединения представлены оксидами, гидрокарбонатами, сернистыми и углекислыми комплексами, а также сульфидными рудами. Самые распространённые руды – это медный колчедан и медный блеск. Содержание меди в них составляет 1-2%. 90% первичной меди добывают пирометаллургическим способом и 10% гидрометаллургическим.
1. Пирометаллургический способ включает в себя такие процессы: обогащение и обжиг, плавка на штейн, продувка в конвертере, электролитическое рафинирование.
Обогащают медные руды методом флотации и окислительного обжига. Сущность метода флотации заключается в следующем: частицы меди, взвешенные в водной среде, прилипают к поверхности пузырьков воздуха и поднимаются на поверхность. Метод позволяет получить медный порошкообразный концентрат, который содержит 10-35% меди.
Окислительному обжигу подлежат медные руды и концентраты со значительным содержанием серы. При нагреве в присутствии кислорода происходит окисление сульфидов, и количество серы снижается почти в два раза. Обжигу подвергаются бедные концентраты, в которых содержится 8-25% меди. Богатые концентраты, содержащие 25-35% меди, плавят, не прибегая к обжигу.
Следующий этап пирометаллургического способа получения меди – это плавка на штейн. Если в качестве сырья используется кусковая медная руда с большим количеством серы, то плавку проводят в шахтных печах. А для порошкообразного флотационного концентрата применяют отражательные печи. Плавка происходит при температуре 1450 °С.
В горизонтальных конвертерах с боковым дутьём медный штейн продувается сжатым воздухом для того, чтобы произошли процессы окисления сульфидов и феррума. Далее образовавшиеся окислы переводят в шлак, а серу в оксид. В конвертере образуется черновая медь, которая содержит 98,4-99,4% меди, железо, серу, а также незначительное количество никеля, олова, серебра и золота.
Черновая медь подлежит огневому, а далее электролитическому рафинированию. Примеси удаляют с газами и переводят в шлак. В результате огневого рафинирования образуется медь с чистотой до 99,5%. А после электролитического рафинирования чистота составляет 99,95%.
2. Гидрометаллургический способ заключается в выщелачивании меди слабым раствором серной кислоты, а затем выделении металлической меди непосредственно из раствора. Такой способ применяется для переработки бедных руд и не допускает попутного извлечения драгоценных металлов вместе с медью.

Применение меди
Благодаря ценным качествам медь и медные сплавы используются в электротехнической и электромашиностроительной отрасли, в радиоэлектронике и приборостроении. Существуют сплавы меди с такими металлами, как цинк, олово, алюминий, никель, титан, серебро, золото. Реже применяются сплавы с неметаллами: фосфором, серой, кислородом. Выделяют две группы медных сплавов: латуни (сплавы с цинком) и бронзы (сплавы с другими элементами).
Медь обладает высокой экологичностью, что допускает её использование в строительстве жилых домов. К примеру, медная кровля за счёт антикоррозионных свойств, может прослужить больше ста лет без специального ухода и покраски.
Медь в сплавах с золотом используется в ювелирном деле. Такой сплав увеличивает прочность изделия, повышает стойкость к деформированию и истиранию.
Для соединений меди характерна высокая биологическая активность. В растениях медь принимает участие в синтезе хлорофилла. Поэтому её можно увидеть в составе минеральных удобрений. Недостаток меди в организме человека может вызвать ухудшение состава крови. Она есть в составе многих продуктов питания. К примеру, этот металл содержится в молоке. Однако важно помнить, что избыток соединений меди может вызвать отравление. Именно поэтому нельзя готовить пищу в медной посуде. Во время кипячения в пищу может попасть большое количество меди. Если же посуда внутри покрыта слоем олова, то опасности отравления нет.
В медицине медь используют, как антисептическое и вяжущее средство. Она является компонентом глазных капель от конъюнктивита и растворов от ожогов.
Источник
 Алюминий – это пластичный и лёгкий металл белого цвета, покрытый серебристой матовой оксидной плёнкой. В периодической системе Д. И. Менделеева этот химический элемент обозначается, как Al (Aluminium) и находится в главной подгруппе III группы, третьего периода, под атомным номером 13. Купить алюминий вы можете на нашем сайте.
Алюминий – это пластичный и лёгкий металл белого цвета, покрытый серебристой матовой оксидной плёнкой. В периодической системе Д. И. Менделеева этот химический элемент обозначается, как Al (Aluminium) и находится в главной подгруппе III группы, третьего периода, под атомным номером 13. Купить алюминий вы можете на нашем сайте.
История открытия
В 16 веке знаменитый Парацельс сделал первый шаг к добыче алюминия. Из квасцов он выделил «квасцовую землю», которая содержала оксид неизвестного тогда металла. В 18 веке к этому эксперименту вернулся немецкий химик Андреас Маргграф. Оксид алюминия он назвал «alumina», что на латинском языке означает «вяжущий». На тот момент металл не пользовался популярностью, так как не был найден в чистом виде.
Долгие годы выделить чистый алюминий пытались английские, датские и немецкие учёные. В 1855 году в Париже на Всемирной выставке металл алюминий произвёл фурор. Из него делали только предметы роскоши и ювелирные украшения, так как металл был достаточно дорогим. В конце 19 века появился более современный и дешёвый метод получения алюминия. В 1911 году в Дюрене выпустили первую партию дюралюминия, названного в честь города. В 1919 из этого материала был создан первый самолёт.
Физические свойства
Металл алюминий характеризуется высокой электропроводностью, теплопроводностью, стойкостью к коррозии и морозу, пластичностью. Он хорошо поддаётся штамповке, ковке, волочению, прокатке. Алюминий хорошо сваривается различными видами сварки. Важным свойством является малая плотность около 2,7 г/см³. Температура плавления составляет около 660°С.
Механические, физико-химические и технологические свойства алюминия зависят от наличия и количества примесей, которые ухудшают свойства чистого металла. Основные естественные примеси – это кремний, железо, цинк, титан и медь.
По степени очистки различают алюминий высокой и технической чистоты. Практическое различие заключается в отличии коррозионной устойчивости к некоторым средам. Чем чище металл, тем он дороже. Технический алюминий используется для изготовления сплавов, проката и кабельно-проводниковой продукции. Металл высокой чистоты применяют в специальных целях.
По показателю электропроводности алюминий уступает только золоту, серебру и меди. А сочетание малой плотности и высокой электропроводности позволяет конкурировать в сфере кабельно-проводниковой продукции с медью. Длительный отжиг улучшает электропроводность, а нагартовка ухудшает.
Теплопроводность алюминия повышается с увеличением чистоты металла. Примеси марганца, магния и меди снижают это свойство. По показателю теплопроводности алюминий проигрывает только меди и серебру. Благодаря этому свойству металл применяется в теплообменниках и радиаторах охлаждения.
Алюминий обладает высокой удельной теплоёмкостью и теплотой плавления. Эти показатели значительно больше, чем у большинства металлов. Чем выше степень чистоты алюминия, тем больше он способен отражать свет от поверхности. Металл хорошо полируется и анодируется.
Алюминий имеет большое сродство к кислороду и покрывается на воздухе тонкой прочной плёнкой оксида алюминия. Эта плёнка защищает металл от последующего окисления и обеспечивает его хорошие антикоррозионные свойства. Алюминий обладает стойкостью к атмосферной коррозии, морской и пресной воде, практически не вступает во взаимодействия с органическими кислотами, концентрированной или разбавленной азотной кислотой.
Химические свойства
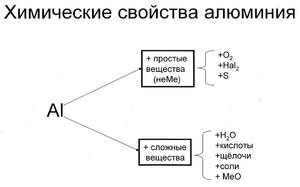
Алюминий – это достаточно активный амфотерный металл. При обычных условиях прочная оксидная плёнка определяет его стойкость. Если разрушить оксидную плёнку, алюминий выступает как активный металл-восстановитель. В мелкораздробленном состоянии и при высокой температуре металл взаимодействует с кислородом. При нагревании происходят реакции с серой, фосфором, азотом, углеродом, йодом. При обычных условиях металл взаимодействует с хлором и бромом. С водородом реакции не происходит. С металлами алюминий образует сплавы, содержащие интерметаллические соединения – алюминиды.
При условии очищения от оксидной пленки, происходит энергичное взаимодействие с водой. Легко протекают реакции с разбавленными кислотами. Реакции с концентрированной азотной и серной кислотой происходят при нагревании. Алюминий легко реагирует со щелочами. Практическое применение в металлургии нашло свойство восстанавливать металлы из оксидов и солей – реакции алюминотермии.
Получение
Алюминий находится на первом месте среди металлов и на третьем среди всех элементов по распространённости в земной коре. Приблизительно 8% массы земной коры составляет именно этот металл. Алюминий содержится в тканях животных и растений в качестве микроэлемента. В природе он встречается в связанном виде в форме горных пород, минералов. Каменная оболочка земли, находящаяся в основе континентов, формируется именно алюмосиликатами и силикатами.
Алюмосиликаты – это минералы, образовавшиеся в результате вулканических процессов в соответствующих условиях высоких температур. При разрушении алюмосиликатов первичного происхождения (полевые шпаты) сформировались разнообразные вторичные породы с более высоким содержанием алюминия (алуниты, каолины, бокситы, нефелины). В состав вторичных пород алюминий входит в виде гидроокисей или гидросиликатов. Однако не каждая алюминийсодержащая порода может быть сырьём для глинозёма – продукта, из которого при помощи метода электролиза получают алюминий.
Наиболее часто алюминий получают из бокситов. Залежи этого минерала распространены в странах тропического и субтропического пояса. В России также применяются нефелиновые руды, месторождения которых располагаются в Кемеровской области и на Кольском полуострове. При добыче алюминия из нефелинов попутно также получают поташ, кальцинированную соду, цемент и удобрения.
В бокситах содержится 40-60% глинозёма. Также в составе имеются оксид железа, диоксид титана, кремнезём. Для выделения чистого глинозёма используют процесс Байера. В автоклаве руду нагревают с едким натром, охлаждают, отделяют от жидкости «красный шлам» (твёрдый осадок). После осаждают гидроокись алюминия из полученного раствора и прокаливают её для получения чистого глинозёма. Глинозём должен соответствовать высоким стандартам по чистоте и размеру частиц.
Из добытой и обогащённой руды извлекают глинозём (оксид алюминия). Затем методом электролиза глинозём превращают в алюминий. Заключительным этапом является восстановление процессом Холла-Эру. Процесс заключается в следующем: при электролизе раствора глинозёма в расплавленном криолите происходит выделение алюминия. Катодом служит дно электролизной ванны, а анодом – угольные бруски, находящиеся в криолите. Расплавленный алюминий осаждается под раствором криолита с 3-5% глинозёма. Температура процесса поднимается до 950°С, что намного превышает температуру плавления самого алюминия (660°С). Глубокую очистку алюминия проводят зонной плавкой или дистилляцией его через субфторид.
Применение
Алюминий применяется в металлургии в качестве основы для сплавов (дуралюмин, силумин) и легирующего элемента (сплавы на основе меди, железа, магния, никеля). Сплавы алюминия используются в быту, в архитектуре и строительстве, в судостроении и автомобилестроении, а также в космической и авиационной технике. Алюминий применяется при производстве взрывчатых веществ. Анодированный алюминий (покрытый окрашенными плёнками из оксида алюминия) применяют для изготовления бижутерии. Также металл используется в электротехнике.
Рассмотрим, как используют различные изделия из алюминия.
Алюминиевая лента представляет собой тонкую алюминиевую полосу толщиной 0,3-2 мм, шириной 50-1250 мм, которая поставляется в рулонах. Используется лента в пищевой, лёгкой, холодильной промышленности для изготовления охлаждающих элементов и радиаторов.
Круглая алюминиевая проволока применяется для изготовления кабелей и проводов для электротехнических целей, а прямоугольная для обмоточных проводов.
Алюминиевые трубы отличаются долговечностью и стойкостью в условиях сельских и городских промышленных районов. Применяются они в отделочных работах, дорожном строительстве, конструкции автомобилей, самолётов и судов, производстве радиаторов, трубопроводов и бензобаков, монтаже систем отопления, магистральных трубопроводов, газопроводов, водопроводов.
Алюминиевые втулки характеризуются простотой в обработке, монтаже и эксплуатации. Используются они для концевого соединения металлических тросов.
Алюминиевый круг – это сплошной профиль круглого сечения. Используется это изделие для изготовления различных конструкций.
Алюминиевый пруток применяется для изготовления гаек, болтов, валов, крепежных элементов и шпинделей.
Около 3 мг алюминия каждый день поступает в организм человека с продуктами питания. Больше всего металла в овсянке, горохе, пшенице, рисе. Учёными установлено, что он способствует процессам регенерации, стимулирует развитие и рост тканей, оказывает влияние на активность пищеварительных желёз и ферментов.
Алюминиевый лист
Алюминиевая плита
Алюминиевые чушки
Алюминиевые уголки
Алюминиевая проволока
При использовании алюминиевой посуды в быту необходимо помнить, что хранить и нагревать в ней можно исключительно нейтральные жидкости. Если же в такой посуде готовить, к примеру, кислые щи, то алюминий поступит в еду, и она будет иметь неприятный «металлический» привкус.
Алюминий входит в состав лекарственных препаратов, используемых при заболеваниях почек и желудочно-кишечного тракта.
Источник
