Какие физические свойства имеют алканы

Àëêàíû – íàñûùåííûå (ïðåäåëüíûå) óãëåâîäîðîäû. Ïðåäñòàâèòåëåì ýòîãî êëàññà ÿâëÿåòñÿ ìåòàí (ÑÍ4). Âñå ïîñëåäóþùèå ïðåäåëüíûå óãëåâîäîðîäû îòëè÷àþòñÿ íà ÑÍ2– ãðóïïó, êîòîðàÿ íàçûâàåòñÿ ãîìîëîãè÷åñêîé ãðóïïîé, à ñîåäèíåíèÿ – ãîìîëîãàìè.
Îáùàÿ ôîðìóëà – ÑnH2n+2.

Ñòðîåíèå àëêàíîâ.
Êàæäûé àòîì óãëåðîäà íàõîäèòñÿ â sp3 – ãèáðèäèçàöèè, îáðàçóåò 4 σ– ñâÿçè (1 Ñ-Ñ è 3 Ñ-Í). Ôîðìà ìîëåêóëû â âèäå òåòðàýäðà ñ óãëîì 109,5°.
Ñâÿçü îáðàçóåòñÿ ïîñðåäñòâîì ïåðåêðûâàíèÿ ãèáðèäíûõ îðáèòàëåé, ïðè÷åì ìàêñèìàëüíàÿ îáëàñòü ïåðåêðûâàíèÿ ëåæèò â ïðîñòðàíñòâå íà ïðÿìîé, ñîåäèíÿþùåé ÿäðà àòîìîâ. Ýòî íàèáîëåå ýôôåêòèâíîå ïåðåêðûâàíèå, ïîýòîìó σ-ñâÿçü ñ÷èòàåòñÿ íàèáîëåå ïðî÷íîé.
Èçîìåðèÿ àëêàíîâ.
Äëÿ àëêàíîâ ñâîéñòâåííà èçîìåðèÿ óãëåðîäíîãî ñêåëåòà. Ïðåäåëüíûå ñîåäèíåíèÿ ìîãóò ïðèíèìàòü ðàçëè÷íûå ãåîìåòðè÷åñêèå ôîðìû, ñîõðàíÿÿ ïðè ýòîì óãîë ìåæäó ñâÿçÿìè. Íàïðèìåð,

Ðàçëè÷íûå ïîëîæåíèÿ óãëåðîäíîé öåïè íàçûâàþòñÿ êîíôîðìàöèÿìè.  íîðìàëüíûõ óñëîâèÿõ êîíôîðìàöèè àëêàíîâ ñâîáîäíî ïåðåõîäÿò äðóã â äðóãà ñ ïîìîùüþ âðàùåíèÿ Ñ-Ñ ñâÿçåé, ïîýòîìó èõ ÷àñòî íàçûâàþò ïîâîðîòíûìè èçîìåðàìè. Ñóùåñòâóåò 2 îñíîâíûå êîíôîðìàöèè – «çàòîðìîæåííîå» è «çàñëîíåííîå»:

Èçîìåðèÿ óãëåðîäíîãî ñêåëåòà àëêàíîâ.
Êîëè÷åñòâî èçîìåðîâ âîçðàñòàåò ñ óâåëè÷åíèåì ðîñòà óãëåðîäíîé öåïè. Íàïðèìåð ó áóòàíà èçâåñòíî 2 èçîìåðà:

Äëÿ ïåíòàíà – 3, äëÿ ãåïòàíà – 9 è ò.ä.
Åñëè ó ìîëåêóëû àëêàíà îòíÿòü îäèí ïðîòîí (àòîì âîäîðîäà), òî ïîëó÷èòñÿ ðàäèêàë:

Ôèçè÷åñêèå ñâîéñòâà àëêàíîâ.
 íîðìàëüíûõ óñëîâèÿõ – Ñ1-Ñ4 – ãàçû, Ñ5-Ñ17 – æèäêîñòè, à óãëåâîäîðîäû ñ êîëè÷åñòâîì àòîìîâ óãëåðîäà áîëüøå 18 – òâåðäûå âåùåñòâà.
Ñ ðîñòîì öåïè ïîâûøàåòñÿ òåìïåðàòóðà êèïåíèÿ è ïëàâëåíèÿ. Ðàçâåòâëåííûå àëêàíû èìåþò áîëåå íèçêèå òåìïåðàòóðû êèïåíèÿ, ÷åì íîðìàëüíûå.
Àëêàíû íåðàñòâîðèìû â âîäå, íî õîðîøî ðàñòâîðÿþòñÿ â íåïîëÿðíûõ îðãàíè÷åñêèõ ðàñòâîðèòåëÿõ. Ëåãêî ñìåøèâàþòñÿ äðóã ñ äðóãîì.
Ïîëó÷åíèå àëêàíîâ.
Ñèíòåòè÷åñêèå ìåòîäû ïîëó÷åíèÿ àëêàíîâ:
1. Èç íåíàñûùåííûõ óãëåâîäîðîäîâ – ðåàêöèÿ «ãèäðèðîâàíèÿ» ïðîòåêàåò ïîä âîçäåéñòâèåì êàòàëèçàòîðà (íèêåëü, ïëàòèíà) è ïðè òåìïåðàòóðå:

2. Èç ãàëîãåíïðîèçâîäíûõ – ðåàêöèÿ Âþðöà: âçàèìîäåéñòâèå ìîíîãàëîãåíàêëêàíîâ ñ ìåòàëëè÷åñêèì íàòðèåì, â ðåçóëüòàòå ÷åãî ïîëó÷àþòñÿ àëêàíû ñ óäâîåííûì ÷èñëîì óãëåðîäíûõ àòîìîâ â öåïè:

3. Èç ñîëåé êàðáîíîâûõ êèñëîò. Ïðè âçàèìîäåéñòâèè ñîëè ñ ùåëî÷è, ïîëó÷àþòñÿ àëêàíû, êîòîðûå ñîäåðæàò íà 1 àòîì óãëåðîä ìåíüøå ïî ñðàâíåíèþ ñ èñõîäíîé êàðáîíîâîé êèñëîòîé:

4. Ïîëó÷åíèå ìåòàíà.  ýëåêòðè÷åñêîé äóãå â àòìîñôåðå âîäîðîäà:
Ñ + 2Í2 = ÑÍ4.
 ëàáîðàòîðèè ìåòàí ïîëó÷àþò òàê:
Al4C3 + 12H2O = 3CH4 + 4Al(OH)3.
Õèìè÷åñêèå ñâîéñòâà àëêàíîâ.
 íîðìàëüíûõ óñëîâèÿõ àëêàíû – õèìè÷åñêè èíåðòíûå ñîåäèíåíèÿ, îíè íå ðåàãèðóþò ñ êîíöåíòðèðîâàííîé ñåðíîé è àçîòíîé êèñëîòîé, ñ êîíöåíòðèðîâàííîé ùåëî÷üþ, ñ ïåðìàíãàíàòîì êàëèÿ.
Óñòîé÷èâîñòü îáúÿñíÿåòñÿ ïðî÷íîñòüþ ñâÿçåé è èõ íåïîëÿðíîñòüþ.
Ñîåäèíåíèÿ íå ñêëîííû ê ðåàêöèÿõ ðàçðûâà ñâÿçè (ðåàêöèÿ ïðèñîåäèíåíèÿ), äëÿ íèõ ñâîéñòâåííî çàìåùåíèå.
1. Ãàëîãåíèðîâàíèå àëêàíîâ. Ïîä âîçäåéñòâèåì êâàíòà ñâåòà íà÷èíàåòñÿ ðàäèêàëüíîå çàìåùåíèå (õëîðèðîâàíèå) àëêàíà. Îáùàÿ ñõåìà:

Ðåàêöèÿ èäåò ïî öåïíîìó ìåõàíèçìó, â êîòîðîé ðàçëè÷àþò:
À) Èíèöèèðîâàíèå öåïè:

Á) Ðîñò öåïè:

Â) Îáðûâ öåïè:

Ñóììàðíî ìîæíî ïðåäñòàâèòü â âèäå:

2. Íèòðîâàíèå (ðåàêöèÿ Êîíîâàëîâà) àëêàíîâ. Ðåàêöèÿ ïðîòåêàåò ïðè 140 °Ñ:

Ëåã÷å âñåãî ðåàêöèÿ ïðîòåêàåò ñ òðåòèòè÷íûì àòîìîì óãëåðîäà, ÷åì ñ ïåðâè÷íûì è âòîðè÷íûì.
3. Èçîìðèçàöèÿ àëêàíîâ. Ïðè êîíêðåòíûõ óñëîâèÿõ àëêàíû íîðìàëüíîãî ñòðîåíèÿ ìîãóò ïðåâðàùàòüñÿ â ðàçâåòâëåííûå:

4. Êðåêèíã àëêàíîâ. Ïðè äåéñâèè âûñîêèõ òåìïåðàòóð è êàòàëèçàòîðîâ âûñøèå àëêàíû ìîãóò ðâàòü ñâîè ñâÿçè, îáðàçóÿ àëêåíû è àëêàíû áîëåå íèçøèå:

5. Îêèñëåíèå àëêàíîâ.  ðàçëè÷íûõ óñëîâèÿõ è ïðè ðàçíûõ êàòàëèçàòîðàõ îêèñëåíèå àëêàíà ìîæåò ïðèâåñòè ê îáðàçîâàíèþ ñïèðòà, àëüäåãèäà (êåòîíà) è óêñóñíîé êèñëîòû.  óñëîâèÿõ ïîëíîãî îêèñëåíèÿ ðåàêöèÿ ïðîòåêàåò äî êîíöà – äî îáðàçîâàíèÿ âîäû è óãëåêèñëîãî ãàçà:


Ïðèìåíåíèå àëêàíîâ.
Àëêàíû íàøëè øèðîêîå ïðèìåíåíèå â ïðîìûøëåííîñòè, â ñèíòåçå íåôòè, òîïëèâà è ò.ä.
Источник
Алканы образуют гомологический ряд, каждое химическое соединение которого по составу отличается от последующего и предыдущего на одинаковое число атомов углерода и водорода – CH2, а вещества, входящие в гомологический ряд, называются гомологами. Гомологический ряд алканов представлен в таблице 1.
Таблица 1. Гомологический ряд алканов.
| Название вещества | Структурная формула | Метан | CH4 |
|---|---|
Этан | C2H6 |
Пропан | C3H8 |
Бутан | C4H10 |
Пентан | C5H12 |
Гексан | C6H14 |
Гептан | C7H16 |
Октан | C8H18 |
Нонан | C9H20 |
Декан | C10H22 |
В молекулах алканов выделяют первичные (т.е. связанные одной связью), вторичные (т.е. связанные двумя связями), третичные (т.е. связанные тремя связями) и четвертичные (т.е. связанные четырьмя связями) атомы углерода.
C1H3 – C2H2 – C1H3 (1 – первичные, 2- вторичные атомы углерода)
CH3 –C3H(CH3) – CH3 (3- третичный атом углерода)
CH3 – C4(CH3)3 – CH3 (4- четвертичный атом углерода)
Для алканов характерна структурная изомерия (изомерия углеродного скелета). Так, у пентана имеются следующие изомеры:
CH3-CH2-CH2-CH2-CH3 (пентан)
CH3 –CH(CH3)-CH2-CH3 (2-метилбутан)
CH3-C(CH3)2-CH3 (2,2 – диметилпропан)
Для алканов, начиная с гептана, характерна оптическая изомерия.
Атомы углерода в предельных углеводородах находятся в sp3 –гибридизации. Углы между связями в молекулах алканов 109,5![]() .
.
Химические свойства алканов
При обычных условиях алканы химически инертны — не реагируют ни с кислотами, ни со щелочами. Это объясняется высокой прочностью ![]() -связей С-С и С-Н. Неполярные связи С-С и С-Н способны расщепляться только гомолитически под действием активных свободных радикалов. Поэтому алканы вступают в реакции, протекающие по механизму радикального замещения. При радикальных реакция в первую очередь замещаются атомы водорода у третичных, затем у вторичных и первичных атомов углерода.
-связей С-С и С-Н. Неполярные связи С-С и С-Н способны расщепляться только гомолитически под действием активных свободных радикалов. Поэтому алканы вступают в реакции, протекающие по механизму радикального замещения. При радикальных реакция в первую очередь замещаются атомы водорода у третичных, затем у вторичных и первичных атомов углерода.
Реакции радикального замещения имеют цепной характер. Основные стадии: зарождение (инициирование) цепи (1) – происходит под действием УФ-излучения и приводит к образованию свободных радикалов, рост цепи (2) – происходит за счет отрыва атома водорода от молекулы алкана; обрыв цепи (3) – происходит при столкновении двух одинаковых или разных радикалов.
X:X → 2X. (1)
R:H + X. → HX + R. (2)
R. + X:X → R:X + X. (2)
R. + R. → R:R (3)
R. + X. → R:X (3)
X. + X. → X:X (3)
Галогенирование.
При взаимодействии алканов с хлором и бромом при действии УФ-излучения или высокой температуры образуется смесь продуктов от моно- до полигалогензамещенных алканов:
CH4 + Cl2 = CH3Cl + HCl (хлорметан)
CH3Cl +Cl2 = CH2Cl2 + HCl (дихлорметан)
CH2Cl2 +Cl2 = CHCl3 + HCl (трихлорметан)
CHCl3 +Cl2 = CCl4 + HCl (тетрахлорметан)
Нитрование (реакция Коновалова)
. При действии разбавленной азотной кислоты на алканы при 140![]() С и небольшом давлении протекает радикальная реакция:
С и небольшом давлении протекает радикальная реакция:
CH3-CH3 +HNO3 = CH3-CH2-NO2 (нитроэтан) + H2O
Сульфохлорирование и сульфоокисление.
Прямое сульфирование алканов протекает с трудом и чаще всего сопровождается окислением, в результате чего образуются алкансульфонилхлориды:
R-H + SO2 + Cl2 → R-SO3Cl + HCl
Реакция сульфоокисления протекает аналогично, только в этом случае образуются алкансульфоновые кислоты:
R-H + SO2 + ½ O2 → R-SO3H
Крекинг
– радикальный разрыв связей С-С. Протекает при нагревании и в присутствии катализаторов. При крекинге высших алканов образуются алкены, при крекинге метана и этана образуется ацетилен:
С8H18 = C4H10 (бутан)+ C3H8 (пропан)
2CH4 = C2H2 (ацетилен) + 3H2↑
Окисление. При мягком окислении метана кислородом воздуха могут быть получены метанол, муравьиный альдегид или муравьиная кислота. На воздухе алканы сгорают до углекислого газа и воды:
CnH2n+2 + (3n+1)/2 O2 = nCO2 + (n+1)H2O
Физические свойства алканов
При обычных условиях С1-С4 – газы, С5-С17 – жидкости, начиная с С18 – твердые вещества. Алканы практически нерастворимы в воде, но, хорошо растворимы в неполярных растворителях, например, в бензоле. Так, метан СН4 (болотный, рудничий газ)
– газ без цвета и запаха, хорошо растворимый в этаноле, эфире, углеводородах, но плохо растворимый в воде. Метан используют в качестве высококалорийного топлива в составе природного газа, в качестве сырья для производства водорода, ацетилена, хлороформа и других органических веществ в промышленных масштабах.
Пропан С3Н8 и бутан С4Н10 – газы, применяемые в быту, в качестве балонных газов, за счет легкой сжижаемости. Пропан используется в качестве автомобильного топлива, поскольку является более экологически чистым, чем бензин. Бутан – сырье для получения 1,3
–бутадиена, использующегося в производстве синтетического каучука.
Получение алканов
Алканы получают из природных источников – природного газа (80-90% — метан, 2-3% — этан и другие предельные углеводороды), угля, торфа, древесины, нефти и горного воска.
Выделяют лабораторные и промышленные способы получения алканов. В промышленности алканы получают из битумного угля (1) или по реакции Фишера-Тропша (2):
nC + (n+1)H2 = CnH2n+2 (1)
nCO + (2n+1)H2 = CnH2n+2 + H2O (2)
К лабораторным способам получения алканов относят: гидрирование непредельных углеводородов при нагревании и в присутствии катализаторов (Ni, Pt, Pd) (1), взаимодействием воды с металлоорганическими соединениями (2), электролизом карбоновых кислот (3), по реакциям декарбоксилирования (4) и Вюрца (5) и другими способами.
R1-C≡C-R2 (алкин) → R1-CH = CH-R2 (алкен) → R1-CH2 – CH2 -R2 (алкан)
(1)
R-Cl + Mg → R-Mg-Cl + H2O → R-H (алкан) + Mg(OH)Cl (2)
CH3COONa↔ CH3COO— + Na+
2CH3COO— → 2CO2↑ + C2H6 (этан) (3)
CH3COONa + NaOH → CH4 + Na2CO3 (4)
R1-Cl +2Na +Cl-R2 →2NaCl + R1-R2 (5)
Примеры решения задач
Источник
Количество атомов углерода в молекуле вещества определяет физические свойства алканов. Чем длиннее углеродная цепь, тем твёрже вещество. Подробнее о физических свойствах алканов читайте ниже.

Гомологи
Алканы имеют общую формулу CnH2n+2. Самое простое вещество, относящееся к алканам – метан. Его также называют болотным газом. Метан образует гомологический ряд, в котором каждое последующее вещество отличается на одну группу CH2. Всего насчитывается 390 алканов.
Гомологи имеют схожие названия, состоящие из суффикса -ан и приставки, указывающей на число атомов в веществе:
- ун- или ген- – один;
- до- – два;
- три- – три;
- тетра- – четыре;
- пент- – пять;
- гекс- – шесть;
- гепт- – семь;
- окт- – восемь;
- нон- – девять;
- дек- – десять.
Приставки отсутствуют у первых четырёх гомологов. Их нужно запомнить: метан, этан, пропан, бутан.

Рис. 1. Гомологический ряд.
Начиная с бутана, все алканы имеют изомеры. Их названия соответствуют основным названиям алканов с приставкой изо-. Для указания расположения метильной группы используются более точные длинные названия. Например, диметилпропан, 3-метилпентан, 2,2-диметилоктан. Цифры в названии соответствуют атомам, к которым примыкают метильные группы.

Рис. 2. Изомеры с названиями.
Алканы – предельные углеводороды, получаемые из природных ископаемых – нефти, каменного угля, газа. Также их могут выделять из солей карбоновых кислот, путём превращения алкенов и алкинов.
Физические свойства
От положения в гомологическом ряду зависят физические свойства алканов. В таблице указано физическое состояние первых 20 алканов.
Название | Формула | Агрегатное состояние |
Метан | CH4 | Бесцветные газы, без запаха и вкуса. Горят бледным или голубым пламенем (пламя газовой горелки) с большим выделением тепла |
Этан | C2H6 | |
Пропан | C3H8 | |
Бутан | C4H10 | |
Пентан | C5H12 | Бесцветные маслянистые жидкости с резким бензиновым запахом |
Гексан | C6H14 | |
Гептан | C7H16 | |
Октан | C8H18 | |
Нонан | C9H20 | |
Декан | C10H22 | |
Ундекан | C11H24 | |
Додекан | C12H26 | |
Тридекан | C13H28 | |
Тетрадекан | C14H30 | |
Пентадекан | C15H32 | |
Гексадекан | C16H34 | Воскоподобные и твёрдые легкоплавкие вещества |
Гептадекан | C17H36 | |
Октадекан | C18H38 | |
Нанадекан | C19H40 | |
Эйкозан | C20H42 |
Все вещества, содержащие больше 15 атомов углерода, являются твёрдыми соединениями. Чем больше содержится в молекуле атомов углерода, тем выше температуры плавления и кипения. Однако чем меньше разветвлён изомер, тем выше его температуры плавления и кипения, поэтому разветвлённые изомеры кипят при более низких температурах, чем линейные аналоги.
Плотность всех алканов находится в пределах единицы (у воды – 1 г/см3), поэтому алканы плохо растворимы в воде и плавают на её поверхности. Растворяются в органических растворителях.
Другое название алканов – парафины. Обычные парафиновые свечи – смесь гомологичных алканов от октадекана (C18H38) до пентатриоконтана (С35Н72).

Рис. 3. Парафин.
Что мы узнали?
Узнали кратко о получении и физических свойствах алканов. Это предельные углеводороды, выделяемые из нефти и газа. Гомологический ряд алканов образует метан. Каждое последующее вещество отличается от предыдущего на одну СН2-группу. Физические свойства гомологов зависят от количества атомов углерода в молекуле. Первые четыре гомолога – бесцветные газы, алканы с 5-15 атомами углерода – маслянистые жидкости с резким запахом, остальные вещества – воскообразные и твёрдые соединения.
Тест по теме
Оценка доклада
Средняя оценка: 3.9. Всего получено оценок: 66.
Источник
Содержание:
Что такое алканы
Алканами в химии называют предельные углеводороды, у которых углеродная цепь является незамкнутой и состоит из атомов углерода, связанных друг с другом при помощи одинарных связей. Также характерной особенностью алканов есть то, что они совсем не содержат двойных либо тройных связей. Порой алканы называют парафинами, дело в том, что парафины собственно и являются смесью предельных углеродов, то есть алканов.
Формула алканов
Формулу алкана можно записать как:
СnР2n+2
При этом n больше или равно 1.
Изомерия алканов
Алканам свойственна изомерия углеродного скелета. При этом соединения могут принимать разные геометрические формы, как например это показано на картинке ниже.
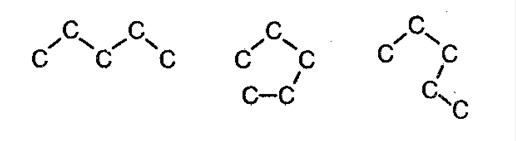
Изомерия углеродного скелета алканов
С увеличением роста углеродной цепи увеличивается и количество изомеров. Так, например, у бутана есть два изомера.
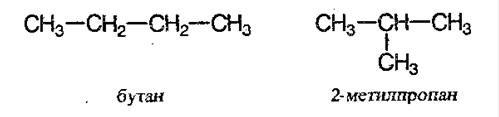
Получение алканов
Алкан как правило получают различными синтетическими методами. Скажем, один из способов получения алкана предполагает реакцию «гидрирования», когда алканы добываются из ненасыщенных углеводов под воздействием катализатора и при температуре.
Физические свойства алканов
Алканы от других веществ отличаются полным отсутствием цвета, также они не растворим в воде. Температура плавления алканов повышается с увеличением их молекулярной массы и длины углеводородной цепи. То есть чем более разветвленным является алкан, тем у него большая температура горения и плавления. Газообразные алканы и вовсе горят бледно-голубым или бесцветным пламенем, при этом выделяя много тепла.
Химические свойства алканов
Алканы в химическом плане малоактивные вещества, по причине прочности крепких сигма связей С-С и С-Н. При этом связи С-С неполярны, а С-Н малополярны. А так как все это малополяризируемые виды связей, которые относятся к сигма виду, то разрываться они будут по механизму гомолитическому, в результате чего образуются радикалы. И как следствия химические свойства алканов представляют собой в основном реакции радикального замещения.
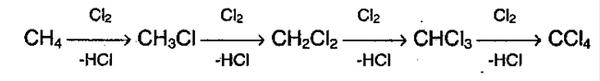
Так выглядит формула химической реакции радикального замещения алканов (галогенирование алканов).
Помимо этого также можно выделить такие химические реакции как нитрирование алканов (реакция Коновалова).
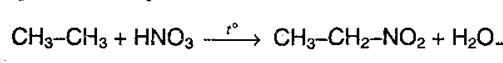
Реакция эта протекает при температуре 140 С, причем лучше всего именно с третичным атомом углерода.
Крекинг алканов – эта реакция протекает при действии высоких температур и катализаторов. Тогда создаются условия, когда высшие алканы могут рвать свои связи образуя алканы более низкого порядка.
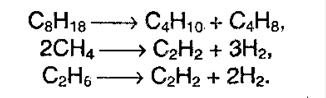
Окисление алканов – в различных условиях эта химическая реакция может привести к образованию спирта, альдегида и уксусной кислоты. При полном окислении реакция протекает вплоть до образования воды и углекислого газа.
Применение алканов
Алканы имеют широкое применение в таких промышленных сферах как синтез нефти, топлива и т. д.
Алканы, видео
И в завершение видео урок о сущности алканов.

Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Источник
Строение алканов
Алканы (парафины) – ациклические насыщенные углеводороды, состав которых выражается общей формулой CnH2n+2 (n – число атомов углерода). Рассмотрим химическое и пространственное строение алканов. Атомы углерода в алканах связаны посредством одинарных связей. Значения электроотрицательностей атомов углерода и водорода равны 2,5 и 2,1 соответственно, т.е. близки, поэтому С-С связи в алканах ковалентные неполярные, а С-Н связи – слабополярные.
В алканах одна s-орбиталь и три р-орбитали атомов углерода гибридизованы и находятся в состоянии sp3— гибридизации. Подробнее о гибридизации атомных орбиталей описано в разделе Химическая связь и строение молекул. Четыре sp3-гибридные орбитали атома углерода направлены к вершинам тетраэдра, с углом между ними около 109°28′, и длиной связи С–С равной 1,54 Å – именно в этом случае отталкивание между электронами и энергия системы минимальны. При перекрывании этих орбиталей друг с другом, и с s-орбиталями атомов водорода образуются σ-связи С–С и С–Н.

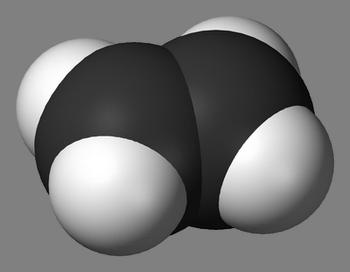
В молекуле метана гибридизованные орбитали атома углерода перекрываются со сферическими орбиталями атомов водорода.

Важно помнить, что в процессе гибридизации происходит только изменение формы орбиталей одного и того же атома, в то время как перекрывание орбиталей двух разных атомов приводит к возникновению химической связи между ними.
Образование С-С – связей в молекулах алканов происходит за счет перекрывания гибридных орбиталей двух атомов углерода:

Физические свойства
При комнатной температуре алканы от С1 до С4 являются газами, от С5 до С16-жидкостями, а более высокие алканы — твердые и воскоподобные.
Температура кипения нормальных алканов увеличиваются с ростом углеводородной цепи, однако по мере роста числа атомов углерода в цепи темп ее увеличения замедляется. Кривая температуры плавления не имеет такой же плавной зависимости. Между нечетными и четными алканами наблюдается только небольшое нелинейное повышение температуры плавления, что представлено на рисунке ниже.

Физические свойства разветвленных алканов отличны от свойств н-алканов с таким же числом атомов углерода в цепи. Так, чем больше разветвлений в цепи, тем ниже их температуры кипения и плавления.
Циклоалканы С2-С3 – газы, высшие – жидкости или твердые вещества. Теппературы кипения циклоалканов примерно на 20 К выше, чем температуры кипения соответствующих н-алканов.
Растворимость
Растворимость алканов в воде ничтожна, однако в органических растворителях они хорошо растворяются.
Существует 2 эмпирических правила, которые связывают температуры плавления (или кипения) вещества с его растворимостью.
- Для веществ одинаковой химической природы, лучшую растворимость имеют вещества с более низкой температурой плавления, по сравнению с веществами с более высокой температурой плавления. Это объясняется тем, что силы взаимодействия внутри кристаллической решетки, которые должны преодалеваться при растворении более слабые у веществ с низкой температурой плавления.
- Для веществ одинаковой химической природы, лучшую растворимость имеют вещества с более низкой температурой кипения, по сравнению с веществами с более высокой температурой плавления.
Все растворители можно разделить на:
- Растворители с сильными (например, вода) межмолекулярными. Здесь действуют такие межмолекулярные силы как силы Ван-дер-Ваальса, дипольное притяжение, водородные связи, связывающие отдельные молекулы воды.
- Растворители с слабыми (бензол, гексан) межмолекулярными взаимодействиями. Здесь действуют в основном силы Ван-дер-Ваальса.
Чтобы вещество растворилось в воде необходимо чтобы энергия, выделяющаяся при растворении была достаточной для преодаления как сил сцепления между молекулами растворяемого вещества, так и сильных сил сцепления между молекулами воды. Силы сцепления в бензоле или гексане могут быть легко преодалены, в независимости от энергии, необходимой для разделения самих частиц растворенного вещества.
Значимым параметром при растворении вещества является температура. В основном (хотя и не всегда) увеличение температуры ведет к увеличению растворимости.
Углеводороды и в частности алканы, в которых силы сцепления слабы, будут растворяться в растворителях, межмолекулярные силы сцепления в которых также слабы (неполярные растворители). В этом влучае, первоначально существующие силы заменяются на равноценные и значительных изменений энергии не происходит. В силу отсутствия сильно электроотрицательных атомов в молекулах углеводородов, они не способны к прочному сцеплению с молекулами воды. Разрыв межмолекулярных связей молекулы воды энергетически невыгоден и углеводороды в ней нерастворимы.
В растворителях меньшей полярности и с меньшей склонностью к образованию водородных связей углеводороды способны более или менее растворяться. Также следует помнить, что водородная связь в воде, чем в других ассоциированных растворителях, так что растворимость углеводородов в них будет выше по сравнению с растворимостью в воде. Кроме этого, с увеличением углеводородного остатка растворителя, его химическая природа приближается к природе растворенного вещества и тенденция к растворимости увеличивается. Например, при комнатной температуре гексан не растворяется в метаноле, но растворяется в этаноле.
Номенклатура и изомерия алканов описаны в разделе Номенклатура и изомерия органических соединений
Источник
