Какие физические свойства характерны для азота

Азот, свойства атома, химические и физические свойства.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
N 7 Азот
14,00643-14,00728* 1s2 2s2 2p3
Азот — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 7. Расположен в 15-й группе (по старой классификации — главной подгруппе пятой группы), втором периоде периодической системы.
Атом и молекула азота. Формула азота. Строение азота
Изотопы и модификации азота
Свойства азота (таблица): температура, плотность, давление и пр.
Физические свойства азота
Химические свойства азота. Взаимодействие азота. Реакции с азотом
Получение азота
Применение азота
Таблица химических элементов Д.И. Менделеева
Атом и молекула азота. Формула азота. Строение азота:
Азот (фр. azote, по наиболее распространённой версии, от др.-греч. ἄζωτος – «безжизненный») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением N и атомным номером 7. Расположен в 15-й группе (по старой классификации — главной подгруппе пятой группы), втором периоде периодической системы.
Азот самый лёгкий элемент периодической таблицы химических элементов Д. И. Менделеева из группы пниктогенов.
Азот – химически весьма инертный неметалл.
Как простое вещество азот (химическая формула N2) при нормальных условиях представляет собой двухатомный газ без цвета, вкуса и запаха. В жидком состоянии азот – бесцветная, подвижная, как вода, жидкость, а в твёрдом – представляет собой белоснежные кристаллы или снегоподобную массу.
Молекула азота двухатомна.
Химическая формула азота N2.
Электронная конфигурация атома азота 1s2 2s2 2p3. Потенциал ионизации атома азота равен 14,53 эВ (1401,5 кДж/моль).
Строение атома азота. Атом азота состоит из положительно заряженного ядра (+7), вокруг которого по атомным оболочкам движутся семь электронов. При этом 2 электрона находятся на внутреннем уровне, а 5 электронов – на внешнем. Поскольку азот расположен во втором периоде, оболочки всего две. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внешняя оболочка представлена s- и р-орбиталями. Два спаренных электрона находится на 1s-орбитали, вторая пара электронов – на 2s-орбитали. На 2р-орбитали находятся три неспаренных электрона. В свою очередь ядро атома азота состоит из семи протонов и семи нейтронов. Азот относится к элементам p-семейства.
Радиус атома азота составляет 92 пм.
Атомная масса атома азота составляет 14,00643-14,00728 а. е. м.
Азот – один из самых распространённых элементов на Земле. Азот – основной компонент воздуха. Он занимает 78, 084 % его объёма и 75,5 % по массе.
Молекула азота крайне прочна. Атомы азота связаны прочными тройными связями. Даже при высокой температуре молекула азота N2 слабо диссоциирует на атомарный азот. При 3000 °C на атомарный азот диссоциирует 0,1 % молекулярного азота, при 5000 °C – несколько процентов. Переход в атомарное состояние вызывается также полем высокочастотного электрического разряда при сильном разрежении газообразного азота или под действием солнечного излучения в высоких слоях атмосферы.
Атомарный азот намного активнее молекулярного.
Изотопы и модификации азота:
Свойства азота (таблица): температура, плотность, давление и пр.:
| Общие сведения | |
| Название | Азот |
| Прежнее название | |
| Латинское название | Nitrogenium |
| Символ | N |
| Номер в таблице | 7 |
| Тип | Неметалл |
| Подтип | |
| Открыт | Даниэль Резерфорд, Англия, 1772 г. |
| Внешний вид и пр. | Газ без цвета, запаха и вкуса |
| Содержание в атмосфере и воздухе (по массе) | 75,5 % |
| Содержание в земной коре (по массе) | 0,002 % |
| Содержание в морях и океанах (по массе) | 0,00005 % |
| Содержание во Вселенной и космосе (по массе) | 0,1 % |
| Содержание в Солнце (по массе) | 0,1 % |
| Содержание в организме человека (по массе) | 2,6 % |
| Свойства атома | |
| Атомная масса (молярная масса)* | 14,00643-14,00728 а. е. м. (г/моль) |
| Электронная конфигурация | 1s2 2s2 2p3 |
| Радиус атома (вычисленный)**** | 56 пм |
| Эмпирический радиус | 65 пм |
| Ковалентный радиус**** | 71 пм |
| Радиус иона | 13 (+5e) 171 (−3e) пм |
| Радиус Ван-дер-Ваальса | 155 пм |
| Химические свойства | |
| Степени окисления | -3 , -2, -1, 0, +1, +2, +3 , +4, +5 |
| Валентность | III, IV |
| Электроотрицательность | 3,04 (шкала Полинга) |
| Энергия ионизации (первый электрон) | 1402,33 кДж/моль (14,53413(4) эВ) |
| Электродный потенциал | |
| Физические свойства | |
| Плотность | 1,2506·10-3 г/см3 (при 0 °C и при нормальных условиях, состояние вещества – газ), 0,808 г/см3 (при -196 °C/-195,8 °C и нормальных условиях, состояние вещества – жидкость), 0,8792 г/см3 (при -210 °C и нормальных условиях, состояние вещества – кристаллы, твердое тело) |
| Температура плавления** | -210 °C (63,15 K, -346 °F) |
| Температура кипения** | -195,795 °C (77,355 K, -320,431 °F) |
| Температура сублимации | |
| Температура разложения | |
| Температура самовоспламенения смеси газа с воздухом | |
| Удельная теплота плавления (энтальпия плавления ΔHпл) | 0,72 кДж/моль |
| Удельная теплота испарения (энтальпия кипения ΔHкип) | 5,56 кДж/моль |
| Удельная теплоемкость при постоянном давлении | 1,040 Дж/г·K (при 25°C) |
| Молярная теплоёмкость | 29,124 Дж/(K·моль) |
| Молярный объём | 17,3 см³/моль |
| Теплопроводность (при нормальных условиях) | 0,02583 Вт/(м·К) |
| Теплопроводность (при 300 K) | 0,026 Вт/(м·К) |
| Критическая температура*** | -146,94 °C (126,21 К, -232,49°F) |
| Критическое давление*** | 3,39 МПа |
| Критическая плотность | 0,304 г/см3 |
| Тройная точка | -210 °C (63,151 К), 12,52 кПа |
| Давление паров | 1 мм.рт.ст. (при -226 °C), 10 мм.рт.ст. (при -219 °C), 100 мм.рт.ст. (при -210 °C) |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | |
| Взрывоопасные концентрации смеси газа с кислородом, % объёмных | |
| Стандартная энтальпия образования ΔH | 0 кДж/моль (при 298 К, для состояния вещества – газ) |
| Стандартная энергия Гиббса образования ΔG | 0 кДж/моль (при 298 К, для состояния вещества – газ) |
| Стандартная энтропия вещества S | 199,9 Дж/(моль·K) (при 298 К, для состояния вещества – газ) |
| Стандартная мольная теплоемкость Cp | 29,1 Дж/(моль·K) (при 298 К, для состояния вещества – газ) |
| Энтальпия диссоциации ΔHдисс | |
| Диэлектрическая проницаемость | 1,000528 (при 25 °C) |
| Магнетизм | диамагнитный материал |
| Магнитная восприимчивость | |
| Электропроводность в твердой фазе | |
| Удельное электрическое сопротивление | |
| Сверхпроводимость при температуре | |
| Твёрдость по Моосу | |
| Твёрдость по Бринеллю | |
| Твёрдость по Виккерсу | |
| Скорость звука | 334 м/с (при 0 °C, состояние вещества – газ), 349 м/с (при 19,1 °C, состояние вещества – газ) |
| Поверхностное натяжение | |
| Динамическая вязкость газов и жидкостей | 0,0165 мПа·с (при 0 °C), 0,0208 мПа·с (при 100 °C), 0,0246 мПа·с (при 200 °C), 0,0311 мПа·с (при 400 °C), 0,0366 мПа·с (при 600 °C), |
| Коэффициент теплового расширения | |
| Модуль Юнга | |
| Модуль сдвига | |
| Объемный модуль упругости | |
| Коэффициент Пуассона | |
| Структура решётки | кубическая |
| Параметры решётки | a = 5,661 Å |
| Отношение c/a | |
| Температура Дебая | |
| Конденсат Бозе-Эйнштейна | |
| Двумерные материалы |
Примечание:
* Указан диапазон значений атомной массы в связи с различной распространённостью изотопов данного элемента в природе.
** Температура плавления азота согласно https://ru.wikipedia.org/wiki/Азот [Россия] составляет -209,86 °C (63,29 K, -345,75 °F); температура плавления азота согласно https://de.wikipedia.org/wiki/Stickstoff [Германия] составляет -210,1 °C (63,05 K, -346,18 °F). Температура кипения азота согласно https://ru.wikipedia.org/wiki/Азот [Россия] составляет -195,75 °C (77,4 K, -320,35 °F), температура кипения азота согласно https://de.wikipedia.org/wiki/Stickstoff [Германия] составляет -196 °C (77,15 К, -320,8 °F).
*** Критическая температура и критическое давление азота согласно https://chemister.ru/Database/properties.php?dbid=1&id=210 [Россия] составляет -149,9 °C (123,25 К, -237,82 °F) и 3,905 МПа соответственно.
**** Ковалентный радиус азота согласно https://ru.wikipedia.org/wiki/Азот [Россия] составляет 75 пм, атомный радиус азота (вычисленный) согласно https://ru.wikipedia.org/wiki/Азот [Россия] составляет 92 пм.
Физические свойства азота:
Химические свойства азота. Взаимодействие азота. Реакции с азотом:
Получение азота:
Применение азота:
Таблица химических элементов Д.И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Источник: https://ru.wikipedia.org/wiki/Азот, https://en.wikipedia.org/wiki/Nitrogen, https://de.wikipedia.org/wiki/Stickstoff, https://chemister.ru/Database/properties.php?dbid=1&id=210
Примечание: © Фото https://www.pexels.com, https://pixabay.com
карта сайта
азот атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле азота
сколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности
4 474
Источник
Азот относится к одним из самых биогенных элементов, так как он встречается в составе нуклеиновых кислот и белков. Также это самый распространенный газ в земной атмосфере, так как в составе воздуха на его долю выпадает 78%. Это двухатомное вещества, которое не обладает ни вкусом, ни цветом, ни запахом. Химические свойства азота определяют его как инертный газ, но в то же время он реагирует вместе с комплексными соединениями переходных металлов. Чаще всего данный газ добывают из воздуха, так как там содержится его большое количество. В сварке он применяется как инертная среда, но не очень активно используется.

Молекула азота
Помимо газообразного состояния в промышленности применяют жидкий азот. Это очень распространенный хладагент. В природе он образует множество изотопов. Для транспортировки и хранения материала используют баллоны черного цвета. Они должны выдерживать, как минимум, 150 атмосфер, так как именно под таким давлением хранится вещество. Азот в нормальном состоянии легче воздуха, так как в воздухе еще имеется кислород и другие, более тяжелые примеси.
Использование азота снижает у получаемого шва ударную вязкость. В это же время он повышает температуру перехода наплавленного металла в хрупкое состояние и делает их более прочными. Азот вызывает старение швов. Чтобы применять данный газ относительно безвредно, нужно использовать дополнительные легирующие элементы, которыми выступают бор и кислород в баллонах. Это сохраняет механические свойства металла на шве.
Область применения при сварке 
Применение азота в сварке не очень широко. Он значительно уступает по количеству общего количества операций другим газам, несмотря на то, что его легче добывать, и он обходится довольно дешево для индустрии. Это обусловлено тем, что азот активно взаимодействует со многими различными металлами. При контакте со сплавами нитриды и эти химические соединения могут навредить крепости и надежности шва. Из-за того, что прочность сварных соединений сильно страдает, приходится заменять его на другие, более нейтральные газы. При сварке сталей, различных сплавов и даже нержавейки азот не нашел должного применения, так как химические свойства азота обеспечивают слишком высокую активность по отношению к ним.

Баллон с азотом для сварки
Азотодуговая сварка лучше всего проявляет свои свойства при работе с медью. Именно с медью данный газ не образует ни каких соединений и практически не взаимодействует. Если сравнивать этот способ с аргонодуговой сваркой, то здесь лишь потребуется увеличить количество расходуемого газа, так как он не столь экономичен и потребуется, примерно, на треть больше вещества. С учетом того, что он стоит значительно ниже аргона, то в экономическом плане это выходит даже выгоднее. Помимо меди, другие металлы профессионалы предпочитают варить остальными инертными газами.
Преимущества 
Несмотря на то, что сфера применения газа в сварке довольно узкая, физические и химические свойства азота все же дают ему некоторые преимущества. Среди них стоит отметить:
- Большая распространенность и легкость получения;
- Относительно низкая стоимость;
- Удобство хранения и транспортировки;
- Безвредность для организма, если его концентрация в воздухе начнет повышаться, то это не так страшно, как с другими веществами.
Недостатки 
К негативным факторам использования относятся следующие:
- Невозможность применения со всеми видами сплавов и металлов;
- Активное образование нуклидов при контакте с металлами;
- Ограниченность применения только при сварке меди.
Виды азота 
В промышленности используется две основные разновидности. Первой является газообразный. Он используется преимущественно в сварке газовой и при использовании полуавтомата. Для своей области он не сильно распространен, но все же занимает уверенное место в мастерских, коммунальных учреждениях, в разнообразных мастерских и производственных цехах. Он хранится в баллонах под большим давлением, что позволяет получить концентрированную долю вещества.
Вторым видом является жидкий азот, который хранится в таком состоянии при очень низкой температуре. Это делает его отличным хладагентом. В промышленности он встречается очень часто.
Физические свойства азота 
В нормальных физических условиях азот является бесцветным газом, у которого нет цвета и запаха. Он очень плохо распространяется в воде. Плотность азота составляет 1,2506 кг/м кубический. Темпе6ратура кипения вещества составляет – 195,8 градусов Цельсия. В жидком состоянии он также остается бесцветным. В этом состоянии плотность будет 808 кг/м кубический. Если азот будет констатировать с воздухом, то он поглощает из него кислород. В твердом состоянии элемент может пребывать при -209,86 градусах Цельсия. Физически это выглядит как большие белые кристаллы или снегоподобная масса. Существует три основные кристаллические модификации вещества в твердом состоянии.
Химические свойства азота 
В свободном состоянии газ существует как образование двухатомных молекул. Атомы азота обладают тройной связью. Молекула вещества оказывается очень прочной для диссоциации, так данная реакция проходит не так просто. В нормальных условиях диссоциация практически отсутствует. При нормальных условиях молекулы азота неплохо поляризуются и не полярные. Взаимодействующие силы между ними оказываются очень слабыми.
Даже при условиях в 3000 градусов Цельсия степень диссоциации составляет только 1%. При 5000 градусов этот показатель повышается до нескольких процентов. Атомарный азот оказывается намного более активным, чем молекулярным. По причине того, что молекулы вещества оказываются очень прочными, многие его соединения оказываются эндотермичными. Они без проблем разлагаются при нагревании. Ковалентные радиус элемента составляет 75 пм. Электроотрицательность по шкале Полинга составляет 3,04 пункта.
Молярная масса и удельная теплоемкость 
Удельная теплоемкость азота при различных температурных условиях будет отличаться. Этот параметр в нормальных условиях вычисляется для недиссоциированного газа, так как диссоциация оказывает влияние только при температуре около 1500 градусов Цельсия. При температуре 27 градусов Цельсия удельная теплоемкость будет 1,04 кДж/(кг*градусы Цельсия).
Молярная масса азота составляет 28 г/моль. Если брать в расчет исключительно химический элемент, то этот показатель будет равен 14 г/моль. С учетом того, что формула газа азота – это N2, так как вещество состоит из двух атомов, то и значение на практике умножается на два.
Давление в баллонах с азотом при различных температурах 
Как и любой другой газ, при изменении температуры азот начинает сжиматься или расширяться. Это касается не только того состояния, когда он свободно находится в атмосфере, но и тогда, когда в баллоне под давлением. Соответственно, давление баллона также будет иметь различные отличия, если будут наблюдаться резкие перепады температур.
Давление, | Давление, МПа | Температура, градусы Цельсия | |||||
| -50 | -25 | 20 | 25 | 50 | |||
| Коэффициент сжимаемости газа при определенном давлении | |||||||
100 | 10 | 0,905 | 0,918 | 0,985 | 1,001 | 1,005 | 1,018 |
| 145 | 14,5 | 0,93 | 0,95 | 1,001 | 1,02 | 1,023 | 1,037 |
204 | 20,4 | 0,958 | 0,968 | 1,035 | 1,053 | 1,06 | 1,076 |
Инструкция по применению 
Перед использованием газа металлическую поверхность нужно очистить и желательно использовать дополнительные легирующие материалы. В качестве флюса применяется бор. Он помогает снизить негативное воздействие газа на металл. Дополнительным элементом выступает технический кислород, который и так используется в горелке, как усиливающий температуру газ.
Сначала в горелку пускается азот, чтобы проверить ее работоспособность, а затем только кислород. Принцип проведения сварочных работ принципиально ни чем не отличается от тех, которые проводятся с другими газами. Главное соблюдать правила использования и не сваривать им те металлы, которые не предназначены для этого.
Меры безопасности
Несмотря на то, что опасность использования азота не столь велика, как у других газов, здесь также нужно соблюдать правила безопасности. Баллоны не должны падать при переноске и перевозке. Во время транспортировки некоторых металлических емкостей нужно исключить их удары друг о друга. Источник пламени должен находиться на расстоянии от 5 метров от баллона. С учетом того, что давление в баллоне может сильно меняться в зависимости от температуры, не стоит допускать ее резких перепадов.
Заключение
Использование азота в сварке в последнее время распространено не столь широко, но он продолжает сохранять свои позиции в данной сфере. Помимо этого он оказывается востребованным для многих других промышленных областей. Его применение для получения качественных сварных швов оказывается не таким простым из-за высокой активности, но специалисты смогут сделать так, чтобы шов получился максимально надежным.
Источник
Ключевые слова конспекта: свойства простых веществ, азот, строение и физические свойства, химические свойства, производство и применение азота.
Азот – элемент группы VA. Его важнейшие параметры приведены в таблице.
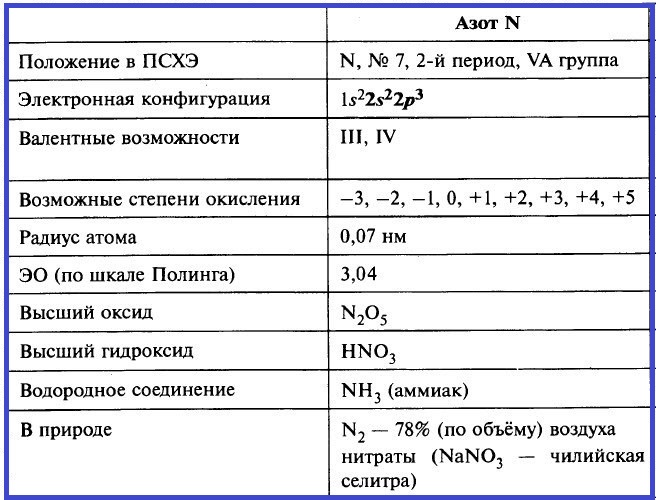
Таблица «Важнейшие параметры элемента азот»
На валентном энергетическом уровне атома азота нет вакантных орбиталей. Следовательно, электронная пара 2s-подуровня не может быть распарена, и поэтому азот в своих соединениях не может быть пятивалентным. Максимальная валентность азота в соединениях – IV.
Азот проявляет степени окисления от –3 (низшей) до +5 (высшей). Примеры соединений с различными степенями окисления азота приведены в таблице.

Примеры веществ с различными степенями окисления азота и фосфора
СТРОЕНИЕ И ФИЗИЧЕСКИЕ СВОЙСТВА АЗОТА
Для азота не характерна аллотропия, элемент азот образует одно простое вещество – N2. Это молекулярное вещество, молекула азота образована двумя атомами азота, связь – ковалентная неполярная, тройная (одна σ- и две π-связи):
Тройная связь в молекуле азота чрезвычайно прочна, её энергия составляет 946 кДж/моль. Именно это обусловливает крайне низкую реакционную способность азота.
Молекулярный азот – газ (при обычных условиях), без цвета, без запаха, чуть легче воздуха (DB = 28/29 ≈ 0,966), плохо растворим в воде.
ХИМИЧЕСКИЕ СВОЙСТВА АЗОТА
Электроотрицательность элемента азота довольно высока, но химическая активность азота – простого вещества крайне низкая. Это обусловлено прочностью тройной связи в молекуле азота.
Химические свойства азота представлены в таблице ниже. В обычных условиях азот взаимодействует только с литием Li, при нагревании азoт реагирует с металлами с образованием нитридов. Если говорить о неметаллах, то азот реагирует с водородом и кислородом. С водородом реакция идёт при нагревании и повышенном давлении, требуется катализатор.
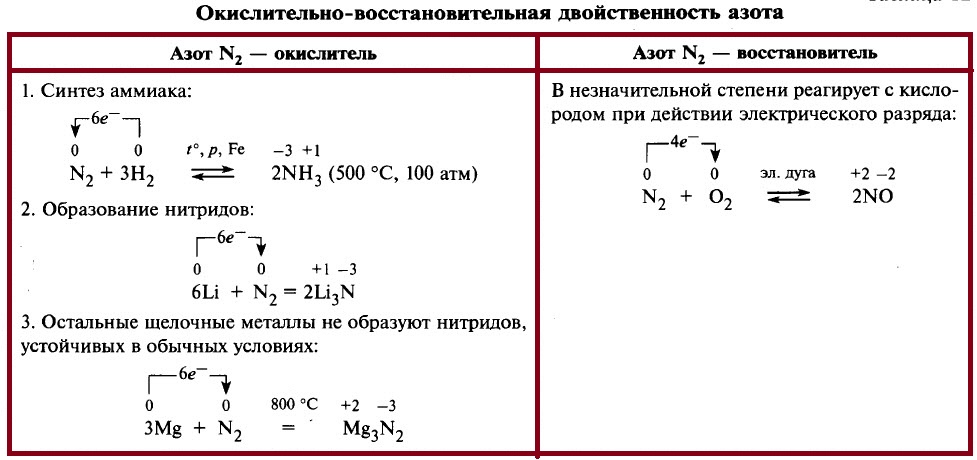
Реакция азота с кислородом начинается при температуре 3000–4000 °С, но даже при температуре 4000 °С содержание NO составляет всего около 10%. В отличие от других реакций кислорода с простыми веществами, эта реакция – эндотермическая, на образование 1 моль NO требуется 90 кДж. Обычно реакцию с кислородом осуществляют в электрической дуге, но всё равно она идёт с незначительным выходом продукта.
ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ АЗОТА
В промышленности азот получают методом разделения жидкого воздуха на компоненты. Лабораторным способом получения азота является термическое разложение нитрита аммония:![]()
Эта реакция относится к типу конпропорционирования: восстановителем является азот в составе иона аммония (N–3), а окислителем – азот в составе нитрит-иона (N+3).
Применение азота. Большая часть азота (примерно 3/4) расходуется для синтеза аммиака, который, в свою очередь, используется для получения удобрений.
Применение газообразного азота обусловлены его инертными свойствами. Газообразный азoт пожаро- и взрывобезопасен, препятствует окислению, гниению.
В лабораториях азот применяется для создания инертной среды при проведении некоторых реакций.
В нефтехимии его применяют для продувки резервуаров и трубопроводов, проверки работы трубопроводов под давлением, увеличения выработки месторождений.
В горнодобывающем деле азот может использоваться для создания в шахтах взрыво–безопасной среды, для распирания пластов породы.
В производстве электроники его применяют для продувки областей, не допускающих наличия окисляющего кислорода.
Aзот используется в коксовом производстве («сухое тушение кокса») при выгрузке кокса из коксовых батарей, а также для «передавливания» топлива в ракетах из баков в насосы или двигатели.
В пищевой промышленности азот используется как газ, наполняющий упаковки, как хладагент.
Газообразным азотом заполняют камеры шин летательных аппаратов.
В жидком азоте, имеющем температуру – 196 °С, хранят в медицинских и исследовательских целях клетки, органы, ткани, другие биологические объекты. Жидкий азот применяют в косметологии для удаления бородавок и родинок.

Конспект урока «Свойства простых веществ: Азот».
Следующая тема: «Свойства простых веществ: Фосфор».
Источник
