Какие частицы проявляют свойства как кислоты так и основания
После прочтения статьи Вы сможете разделять вещества на соли, кислоты и основания. В статье описано, что такое
pH раствора, какими общими свойствами обладают кислоты и основания.
Простым языком, кислота – это всё что с H, а основание – c OH. НО! Не всегда. Что бы отличать кислоту от основания
необходимо… запомнить их! Сожалею. Что бы хоть как то облегчить жизнь, три наших друга, Аррениус и Бренстед с
Лоури, придумали две теории, которые зовутся их именем.
Как металлы и неметаллы, кислоты и основания – это разделение веществ по схожим свойствам. Первая теория кислот
и оснований принадлежала швецкому учёному Аррениусу. Кислота по Аррениусу – это класс веществ, которые
в реакции с водой диссоциируют (распадаются), образовывая катион водорода H+. Основания Аррениуса в водном растворе образуют
анионы OH-. Следующая теория в 1923 году была предложена учёными Бренстедом и Лоури. Теория Бренстеда-Лоури
определяет кислотами вещества, способные в реакции отдавать протон (протоном в реакциях называют катион водорода). Основания,
соответственно, – это вещества, способные принять протон в реакции. Актуальная на данный момент теория – теория Льюиса.
Теория Льюиса определяет кислоты как молекулы или ионы, способные принимать электронные пары, тем самым формируя
аддукты Льюиса (аддукт – это соединение, образующееся соединением двух реагентов без образования побочных продуктов).
В неорганической химии, как правило, под кислотой имеют ввиду кислоту Бренстеда-Лоури, то есть вещества, способные отдать
протон. Если имеют ввиду определение кислоты по Льюису, то в тексте такую кислоту называют кислотой Льюиса. Данные правила
справедливы для кислот и оснований.
Диссоциация
Диссоциация – это процесс распада вещества на ионы в растворах или расплавах. Например, диссоциация соляной кислоты – это распад
HCl на H+ и Cl-.
Свойства кислот и оснований
Кислоты, содержащие водород, в водном растворе выделяют катионы водорода. Основания, содержащие гидроксид-ион,
в водном растворе выделяют анион OH-.
Основания, как правило, мыльные на ощупь, кислоты, в большинстве своём, имеют кислый вкус.
При реакции основания со многими катионами формируется осадок. При реакции кислоты с анионами, как правило, выделяется
газ.
Часто используемые кислоты:
H2O, H3O+, CH3CO2H, H2SO4,
HSO4−, HCl, CH3OH, NH3
Часто используемые основания:
OH−, H2O, CH3CO2−,
HSO4−, SO42−, Cl−
Сильные и слабые кислоты и основания
Сильные кислоты
Такие кислоты, которые полностью диссоциируют в воде, производя катионы водорода H+ и анионы.
Пример сильной кислоты – соляная кислота HCl:
HCl(р-р) + H2O(ж) → H3O+(р-р) + Cl-(р-р)
Примеры сильных кислот: HCl, HBr, HF, HNO3, H2SO4, HClO4
Список сильных кислот
- HCl – соляная кислота
- HBr – бромоводород
- HI – йодоводород
- HNO3 – азотная кислота
- HClO4 – хлорная кислота
- H2SO4 – серная кислота
Слабые кислоты
Растворяются в воде только частично, например, HF:
HF(р-р) + H2O(ж) → H3O+(р-р) + F-(р-р) –
в такой реакции более 90% кислоты не диссоциирует:
[H3O+]=[F-] < 0,01M для вещества 0,1М
Сильную и слабую кислоту можно различить измеряя проводимость растворов: проводимость зависит от количества ионов,
чем сильнее кислота тем она более диссоциирована, поэтому чем сильнее кислота тем выше проводимость.
Список слабых кислот
- HF фтороводородная
- H3PO4 фосфорная
- H2SO3 сернистая
- H2S сероводородная
- H2CO3 угольная
- H2SiO3 кремниевая
Сильные основания
Сильные основания полностью диссоциируют в воде:
NaOH(р-р) + H2O ↔ NH4
К сильным основаниям относятся гидроксиды металлов первой (алкалины, щелочные металы) и второй (алкалинотеррены,
щёлочноземельные металлы) группы.
Список сильных оснований
- NaOH гидроксид натрия (едкий натр)
- KOH гидроксид калия (едкое кали)
- LiOH гидроксид лития
- Ba(OH)2 гидроксид бария
- Ca(OH)2 гидроксид кальция (гашеная известь)
Слабые основания
В обратимой реакции в присутствии воды образует ионы OH-:
NH3 (р-р) + H2O ↔ NH+4 (р-р) + OH-(р-р)
Большинство слабых оснований – это анионы:
F-(р-р) + H2O ↔ HF(р-р) + OH-(р-р)
Список слабых оснований
- Mg(OH)2 гидроксид магния
- Fe(OH)2 гидроксид железа (II)
- Zn(OH)2 гидроксид цинка
- NH4OH гидроксид аммония
- Fe(OH)3 гидроксид железа (III)
Реакции кислот и оснований
Сильная кислота и сильное основание
Такая реакция называется нейтрализацией: при количестве реагентов достаточном для полной диссоциации кислоты и
основания, результирующий раствор будет нейтральным.
Пример:
H3O+ + OH- ↔ 2H2O
Слабое основание и слабая кислота
Общий вид реакции:
Слабое основание(р-р) + H2O ↔ Слабая кислота(р-р) + OH-(р-р)
Сильное основание и слабая кислота
Основание полностью диссоциирует, кислота диссоциирует частично, результирующий раствор имеет слабые свойства
основания:
HX(р-р) + OH-(р-р) ↔ H2O + X-(р-р)
Сильная кислота и слабое основание
Кислота полностью диссоциирует, основание диссоциирует не полностью:
NH3 (р-р) + H+ ↔ NH4
Диссоциация воды
Диссоциация – это распад вещества на составляющие молекулы. Свойства кислоты или основания зависят от
равновесия, которое присутствует в воде:
H2O + H2O ↔ H3O+(р-р) + OH-(р-р)
Kc = [H3O+][OH-]/[H2O]2
Константа равновесия воды при t=25°: Kc = 1.83⋅10-6, также имеет место следующее
равенство: [H3O+][OH-] = 10-14, что называется константой
диссоциации воды. Для чистой воды [H3O+] = [OH-] = 10-7,
откуда -lg[H3O] = 7.0.
Данная величина (-lg[h3O]) называется pH – потенциал водорода. Если pH < 7, то вещество
имеет кислотные свойства, если pH > 7, то вещество имеет основные свойства.
Способы определения pH
Инструментальный метод
Специальный прибор pH-метр – устройство, трансформирующее концентрацию протонов в растворе в электрический
сигнал.
Индикаторы
Вещество, которое изменяет цвет в некотором интервале значений pH в зависимости от кислотности раствора,
используя несколько индикаторов можно добиться достаточно точного результата.
Соль
Соль – это ионное соединение образованное катионом отличным от H+ и анионом отличным от O2-.
В слабом водном растворе соли полностью диссоциируют.
Что бы определить кислотно-щелочные свойства раствора соли, необходимо определить, какие ионы присутствуют
в растворе и рассмотреть их свойства: нейтральные ионы, образованные из сильных кислот и оснований не влияют на pH:
не отдают ионы ни H+, ни OH- в воде. Например, Cl-, NO-3,
SO2-4, Li+, Na+, K+.
Анионы, образованные из слабых кислот, проявляют щелочные свойства (F-, CH3COO-,
CO2-3), катионов с щелочными свойствами не существует.
Все катионы кроме металлов первой и второй группы имеют кислотные свойства.
Буфферный раствор
Растворы, которые сохраняют уровень pH при добавлении небольшого количества сильной кислоты или сильного
основания, в основном состоят из:
- Смесь слабой кислоты, соответствующей соли и слабого основания
- Слабое основание, соответствующая соль и сильная кислота
Для подготовки буфферного раствора определённой кислотности необходимо смешать слабую кислоту или основание
с соответствующей солью, при этом необходимо учесть:
- Интервал pH в котором буфферный раствор будет эффективен
- Ёмкость раствора – количество сильной кислоты или сильного основания, которые можно добавить не повлияв
на pH раствора - Не должно происходить нежелаемых реакций, которые могут изменить состав раствор
Тест:
Источник
Определение кислот и оснований по Бренстеду и Лаури
В $1923$ г. независимо друг от друга Бренстед и Лаури предложили определение кислот и оснований, учитывающих положение о том, что протон в растворе существовать не может. Согласно их определению,
кислота — это соединение, частицы которого (ионы или молекулы) в результате протонотранспортной реакции способны отдавать протон другому веществу;
основание — это соединение, частицы которого (ионы или молекулы) в результате протонотранспортной реакции принимают протон от другого вещества.
И основание, и кислота во время реакции могут переносить протон, поэтому их называют протолитами. Реакции между протолитами называются протолитическими.
Исходя из этого, кислоты являются протон – донорными веществами, а основания считают протон – акцепторными веществами.
- Кислота ↔ Основание + $H^+$
Однако данное соотношение не описывает истинную реакцию (протон $H^+$ в растворе не существует).
В растворе происходит соперничество за протон, в котором участвует и растворитель. Кислоту и основание, связанные за счет обмена протоном, называют сопряженной кислотно — основной парой:
Готовые работы на аналогичную тему
Получить выполненную работу или консультацию специалиста по вашему учебному проекту
Узнать стоимость
Кислота $1$ ↔ сопряженное основание $1$+ $H^+$;
Основание $2$ + $H^+$ ↔ сопряженная кислота $2$.
В общем виде реакцию между кислотой и основанием можно записать следующим образом:
- Кислота $1$ + Основание $2$ ↔ сопряженное основание $1$ + сопряженная кислота $2$.
Кислота $1$ будет превращаться в сопряженное с ней основание, и, наоборот, основание $2$ превращается в сопряженную с ним кислоту.
Реакции между кислотами и основаниями Бренстеда
Кислотные взаимодействия характеризуются как реакции между кислотами и основаниями. Если в растворе нет основания — акцептора протона, то вещество как кислота реагировать не может. При этом необходимо присутствие более сильного основания, способного оторвать протон от кислоты. Протон отщепляется от кислоты не самопроизвольно, а под действием основания. Нельзя разделять кислотные и основные свойства, так как существует единое кислотно — основное взаимодействие.
Вода является амфотерным растворителем и может выступать как в роли кислоты, так и в роли основания.
Пример 1
Вода в роли кислоты, является донором протона:
- $RNH_2 + H_2O ↔ RN{H_3}^+ + OH^-$;
- $HS{O_4}^- + H_3O^+ ↔ H_2SO_4 + H_2O$;
- $CH_3{CO}^{2-} + H_2O ↔ CH_3CO_2H + OH^-$.
Вода в роли основания, действует как акцептор протонов:
- $HS{O_4}^- + H_2O ↔ H_3O^+ +{SO_4}^{2-}$;
- $CH_3CO_2H + H_2O ↔ H_3O^+ + CH_3CO^{2-}$.
Ионы могут обнаруживать двойные функции: выступать и как основание и как кислота. Свойства конкретного соединения зависят от свойств, проявляемых конкурирующей сопряженной пары.
Пример 2
Гидрокарбонат — анион $HCO_3$- может проявлять двойственный характер взаимодействия с водой.
ведет себя как донор (кислота):
- ${HCO}_{{3^-}(p)} + H_2O(ж) > {H_3O^+}_{(p)} + {{CO_3}^{2-}}_{(p)}$
ведет себя как акцептор (основание):
- ${HCO}_{{3^-}(p)} + H_2O(ж) > {H_2CO}_{3 (p)} + {OH^-}_{(p)}$
Определение 1
Вещества – протолиты, способные отдавать и присоединять протоны, называются амфолитами или амфипротонными веществами.
Свойства кислот и оснований противоположны и при взаимодействии они нейтрализуют друг друга, то есть протекает реакция нейтрализации. В результате данной реакции образуется соль (ионное соединение) и вода.
Согласно теории Бренстеда — Лоури, кислоты можно рассматривать как гидратированные ионы металлов. Вода, которая находится во внутренней сфере ионов, выступает донором протонов.
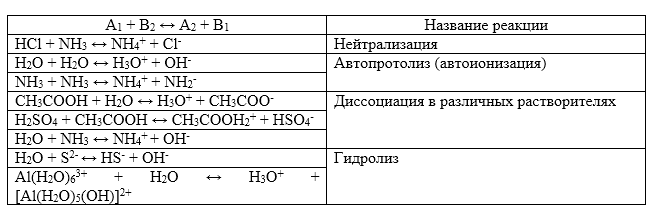
Протолитическая теория описывает многие равновесия. Примеры таких процессов изображены в таблице:

Рисунок 1.
Кислотно – основное титрование – одно из важнейших применений реакции нейтрализации. С его помощью определяют концентрации основания или кислоты в растворе, широко используется в аналитической химии.
При определении концентрации кислоты, пользуются стандартным раствором основания (т.е. с известной концентрацией). И наоборот, при определении концентрации основания пользуются стандартным раствором кислоты.
Количественная характеристика силы кислоты
Кислотно – основные взаимодействия необходимо рассматривать с позиций термодинамики, так как оно является достаточно быстрым и равновесным процессом.
Количественно кислотность вычисляют по отношению к воде. При этом мерой кислотности выступает константа равновесия реакции (константа кислотности) $Ka$:
$A ↔ B + H^+$
Измерить абсолютное значение Кa невозможно, так как данное равновесие возможно при наличии сопряженной пары. Значение константы кислотности можно предопределить относительно выбранного стандарта.
Стандартное равновесие имеет вид:
$H_3O^+ ↔ H_2O + H^+$, $Ka = 1;$
Тогда для любого кислотно — основного процесса:
$A_1 + B_2 ↔ A_2 + B_1$
Константы кислотности кислоты при взаимодействии с водой будут теми же, что и в теории Аррениуса. Для многоосновных кислот первая константа равновесия всегда больше последующих.
Источник
Немного теории
Кислоты
Кислоты ― это сложные
вещества, образованные атомами водорода, способными замещаться на атомы металла и кислотными остатками.
Кислоты – это электролиты, при диссоциации
которых образуются только катионы водорода и анионы кислотных остатков.
Классификация кислот
Классификация кислот по составу
Кислородсодержащие кислоты | Бескислородные кислоты |
H2SO4 серная кислота H2SO3 сернистая кислота HNO3 азотная кислота H3PO4 фосфорная кислота H2CO3 угольная кислота H2SiO3 кремниевая кислота | HF фтороводородная кислота HCl хлороводородная кислота (соляная кислота) HBr бромоводородная кислота HI иодоводородная кислота H2S сероводородная кислота |
Классификация кислот по числу атомов водорода
К И С Л О Т Ы | ||
Одноосновные | Двухосновные | Трехосновные |
HNO3 азотная HF фтороводородная HCl хлороводородная HBr бромоводородная HI иодоводородная | H2SO4 серная H2SO3 сернистая H2S сероводородная H2CO3 угольная H2SiO3 кремниевая | H3PO4 фосфорная |
Классификация кислот на сильные и слабые кислоты.
Сильные кислоты | Слабые кислоты |
HI иодоводородная HBr бромоводородная HCl хлороводородная H2SO4 серная HNO3 азотная | HF фтороводородная H3PO4 фосфорная H2SO3 сернистая H2S сероводородная H2CO3 угольная H2SiO3 кремниевая |
Химические свойства кислот
- Взаимодействие с основными оксидами с образованием соли и воды:
- Взаимодействие с амфотерными оксидами с образованием соли и воды:
- Взаимодействие со щелочами с образованием соли и воды (реакция нейтрализации):
- Взаимодействие с солями, если выпадает осадок или выделяется газ:
- Сильные кислоты вытесняют более слабые из их солей:
(в данном случае образуется неустойчивая угольная кислота , которая сразу же распадается на воду и углекислый газ)
- С азотной кислотой и концентрированной серной кислотами реакция идёт иначе:
- Кислоты диссоциируют с образованием катиона водорода, что приводит к изменению окраски индикаторов:
– лакмус становится красным
– метилоранж становится красным.
1. водород+неметалл
H2+ S → H2S
2. кислотный оксид+вода
P2O5
+ 3H2O→2H3PO4
Исключение:
2NO2
+ H2O→HNO2 + HNO3
SiO2 + H2O —не реагирует
3. кислота+соль
В продукте реакции должен
образовываться осадок, газ или вода. Обычно более сильные кислоты вытесняют
менее сильные кислоты из солей. Если соль нерастворима в воде, то она реагирует
с кислотой, если образуется газ.
Na2CO3
+ 2HCl→2NaCl + H2O + CO2↑
K2SiO3
+ H2SO4→K2SO4 + H2SiO3↓
Основания (осно́вные гидрокси́ды) — сложные вещества, которые состоят из атомов металла или иона аммония и гидроксогруппы (-OH). В водном растворе диссоциируют с образованием катионов и анионов ОН−. Название основания обычно состоит из двух слов: «гидроксид металла/аммония». Хорошо растворимые в воде основания называются щелочами.
1. По растворимости в воде.
Растворимые основания
(щёлочи): гидроксид натрия NaOH, гидроксид калия KOH, гидроксид бария Ba(OH)2, гидроксид стронция Sr(OH)2, гидроксид цезия CsOH, гидроксид рубидия RbOH.
Практически нерастворимые основания
: Mg(OH)2, Ca(OH)2, Zn(OH)2, Cu(OH)2
Деление на растворимые и нерастворимые основания практически полностью совпадает с делением на сильные и слабые основания, или гидроксиды металлов и переходных элементов
2. По количеству гидроксильных групп в молекуле.
– Однокислотные (гидроксид натрия NaOH)
– Двукислотные (гидроксид меди(II) Cu(OH)2)
– Трехкислотные (гидроксид железа(III) In(OH)3)
3. По летучести.
– Летучие: NH3
– Нелетучие: щёлочи, нерастворимые основания.
4. По стабильности.
– Стабильные: гидроксид натрия NaOH, гидроксид бария Ba(OH)2
– Нестабильные: гидроксид аммония NH3·H2O (гидрат аммиака).
5. По степени электролитической диссоциации.
– Сильные (α > 30 %): щёлочи.
– Слабые (α < 3 %): нерастворимые основания.
- Взаимодействие сильноосновного оксида с водой позволяет получить сильное основание или щёлочь.
Слабоосновные и амфотерные оксиды с водой не реагируют, поэтому соответствующие им гидроксиды таким способом получить нельзя.
- Гидроксиды малоактивных металлов получают при добавлении щелочи к растворам соответствующих солей. Так как растворимость слабоосновных гидроксидов в воде очень мала, гидроксид выпадает из раствора в виде студнеобразной массы.
- Также основание можно получить при взаимодействия щелочного или щелочноземельного металла с водой.
- Гидроксиды щелочных металлов в промышленности получают электролизом водных растворов солей:
- Некоторые основания можно получить обменными реакциями:
- В водных растворах основания диссоциируют, что изменяет ионное равновесие:
это изменение проявляется в цветах некоторых
кислотно-основных индикаторов:
лакмус становится синим,
метилоранж — жёлтым,
фенолфталеин приобретает цвет фуксии.
- При взаимодействии с кислотой происходит реакция нейтрализации и образуется соль и вода:
Примечание:
реакция не идёт, если и кислота и основание слабые.
- При избытке кислоты или основания реакция нейтрализации идёт не до конца и образуются кислые или осно́вные соли, соответственно:
- Растворимые основания могут реагировать с амфотерными гидроксидами с образованием гидроксокомплексов:
- Основания реагируют с кислотными или амфотерными оксидами с образованием солей:
- Растворимые снования вступают в обменные реакции с растворимыми солями:
Нерастворимые основания при нагреве разлагаются:
Источник
В настоящее время не существует однозначного определения понятий кислоты и основания, которое в равной степени можно было бы использовать для характеристики кислотно-основных взаимодействий в любых растворителях. Для характеристики электролитов в водных растворах в настоящее время можно использовать понятия кислоты и основания, данные Аррениусом.
Согласно теории Аррениуса кислотой считается соединение, при электролитической диссоциации которого образуются катионы водорода, а основанием считается соединение, в результате диссоциации которого образуется гидроксид-ион. Амфолитом (амфотерным гидроксидом) называют электролит, диссоциирующий в растворе с образованием как катионов водорода, так и гидроксид – ионов. К амфолитам относят гидроксиды цинка, алюминия, хрома и других аммфотерных элементов, а так же аминокислоты, белки, нуклеиновые кислоты.
Таким образом, свойства кислот обусловлены наличием в их растворах водород – ионов, а свойства оснований – присутствием в их растворах гидроксид – ионов. Однако такой взгляд на кислоты и основания применим только для водных растворов.
Ограниченность понятий кислоты и основания, данных Аррениусом, можно проиллюстрировать примерами:
1. Молекула NH3+ не содержит иона ОН-, а молекула СО2- иона H+, однако в водном растворе первая проявляет свойства основания, а вторая – кислоты.
2. Безводный хлорид водорода, состоящий только из молекул, реагирует с безводными основаниями.
3. Многие электролиты, содержащие водород, в одном растворителе диссоциируют как кислоты, а в другом – как основания. Например, СН3СООН в воде – слабая кислота:
СН3СООH СН3СОО- + H+
а в жидком фториде водорода – основание:
НF + СН3СООH СН3СООH2+ + F-
Исследования подобного типа реакций, и в особенности реакций, протекающих в неводных растворителях, привело к созданию более общих теорий кислот и оснований.
Протонная теория кислот и оснований.
В 1923 г. И. Бренстед и Т. Лоури разработали протонную теорию кислот и оснований.
Согласно этой теории:
– кислотой называют любое вещество, молекулярные частицы которого (в том числе ионы) способны отдавать протон, т.е. быть донором протонов;
– основанием называют вещество, молекулярные частицы которого (в том числе и ионы) способны присоединять протоны, т.е. быть акцептором протонов.
Такие определения кислот и оснований позволяют включать в их число не только молекулы, но и ионы. Например, карбонат-ион согласно протонной теории является основанием, т.к. в водном растворе он присоединяет протон:
СО32- + H+ HCO3-
Согласно протонной теории кислоты подразделяют на три типа:
1. Нейтральные кислоты, например HCl, H2SO4, H3PO4 и др.
H2SO4 H++ HSO4-
2. Катионные кислоты, представляющие собой положительные ионы, например NH4+ , Н3О+:
NH4+ NH3+Н+
3. Анионные кислоты, представляющие собой отрицательные ионы, например, HSO4-, H2PO4-, HPO42- и др.:
HSO4- H++ SO42-
Подобного типа классификация имеется и для оснований:
1. Нейтральные основания, например, NH3,Н2О, С2Н5ОН и др.:
NH3+Н+ NH4+
2. Анионные основания, представляющие собой отрицательные ионы, например, Cl-, СН3СОО-, ОН-:
СН3СОО-+Н+ СН3СООН
3. Катионные основания, представляющие собой положительные ионы, например, Н2N−NH3+.
Растворители типа воды, жидкого аммиака, а так же анионы многоосновных кислот, которые могут быть и донорам и акцепторами протонов, являются амфолитами.
Например, в реакции Н2О + NH3 → ОН-+ NH4+ молекула воды отдает протон и является кислотой.
Однако в реакции Н2О+ HCl→ Н3О++Сl- молекула воды присоединят протон и является основанием. Таким образом, вода – типичный амфолит.
Процесс диссоциации (ионизации) вещества происходит в контакте с растворителем. При этом растворитель выполняет или функцию кислоты или основания. Например, при растворении аммиака вода – кислота NH3+ Н2О NH4++ ОН- При растворении фторида водорода – основание HF+ Н2О F-+H3O+
Если сродство к протону у растворителя больше, чем у растворенного вещества, то растворитель выступает как основание (сродство к протону Н2О больше сродства к протону HF), а если оно меньше – как кислота (сродство к протону Н2О меньше сродства к протону NH3).
Согласно протонной теории, отдавая протон, кислота превращается в основание, которое называют сопряженным этой кислоте:
I. (кислота)1 = (сопряженное основание)1 + Н+ т.е. каждой кислоте соответствует сопряженное основание.
Наоборот, основание, присоединяя протон, превращается в сопряженную кислоту:
II. (основание)2 + Н+ = (сопряженная кислота)2
Например, кислоте H2SO4 соответствует сопряженное основание HSO4-, а основанию Cl– сопряженная кислота НСl.
III. (кислота)1 + (основание)2 = (кислота)2 + (основание)1
Для краткости обратимый процесс кислотно-основного взаимодействия называют кислотно-основным равновесием.
Например:
HCl+ NH3 NH4++Cl-
Несмотря на свои достоинства теория Бренстеда, как и теория Аррениуса, не применима к веществам, проявляющим функцию кислоты веществ, не содержащих водорода, например галогенидам бора, алюминия, кремния и олова. Поэтому более общей является теория кислот и оснований Льюиса.
Теория Льюиса (электронная теория).
В теории Льюиса за основу взято наиболее общее свойство кислот и оснований – их электронное строение.
Согласно этой теории:
– кислотой называют вещество, принимающее неподеленную электронную пару, – акцептор электронов;
– основанием называют вещество, поставляющее электроны для образования химической связи, – донор электронов.
По Льюису отличительной способностью кислот и оснований является их взаимная нейтрализация путем образования ковалентной связи:
Cl3Br + : NH3 Cl3Br: NH3;
O3S + : OH2 O3S: OH2
В приведенных примерах в качестве кислоты выступают молекулы трихлорида брома и оксида серы (VI), а в качестве оснований – молекулы аммиака и воды.
Таким образом, теория Льюиса рассматривает разные химические процессы как однотипные: реакцию аминов с галогенидом бора, комплексообразование.
К основаниям Льюиса относят галогенид – ионы, аммиак, алифатические и ароматические амины, кислородсодержащие соединения общей формулы R2CO (где R – органический радикал).
К кислотам Льюиса относят галогениды бора, алюминия, кремния, олова и других элементов.
Рассмотренные теории кислот и оснований не противоречат, а дополняют друг друга и имеют глубокую внутреннюю связь. Так, кислоты, по Бренстеду, можно рассматривать как частный случай льюисовских кислот, поскольку протон характеризуется большим сродством к электронной паре и может рассматриваться, по Люйсу, как кислота.
Источник
