Какие частицы обусловливают такие свойства металлов как пластичность металлический блеск
В данной статье ознакомимся с основными физическими свойствами металлов. Вашему вниманию будут представлены пластичность, электропроводность, теплопроводность, металлический блеск, твёрдость, плотность, температура плавления.
Начнём с пластичности.
Пластичность — это свойство вещества изменять форму под внешним воздействием, не разрушаясь, и сохранять принятую форму после прекращения этого воздействия.
Почему у металлов так выходит? Это происходит из-за их строения, виновной выступает кристаллическая решётка. Она состоит из узлов и свободных электронов, которые бегают между углами, никому не принадлежа. В узлах могут быть атомы, молекулы или ионы. Электроны то присоединяются к ним, то уходят. Именно взаимосвязью между бегающими по всему веществу электронами и узлами объяснятся свойство пластичности: слои смещаются друг с другом без разрыва.
Как же определить и сравнить пластичность разных металлов? Она определяется при испытании на растяжение. Под действием нагрузки образцы разных металлов в различной степени удлиняются, а их поперечное сечение уменьшается. Чем больше способен образец удлиняться, а его поперечное сечение сужаться, тем пластичнее образец.
Существуют две единицы измерения: относительное удлинение и относительное сужение при разрыв.
По степени пластичности металлы принято подразделять следующим образом:
-высокопластичные (относительное удлинение превосходит 40 %) — металлы, составляющие основу большинства конструкционных сплавов (алюминий, медь, железо, титан, свинец) и «легкие» металлы (натрий, калий, рубидий и др.);
-пластичные (относительное удлинение лежит в диапазоне между 40 и 3%) — магний, цинк, молибден, вольфрам, висмут и др. (наиболее обширная группа);
-хрупкие (относительное удлинение меньше 3%) — хром, марганец, кобальт, сурьма.
Электропроводность — свойство проводить электрический ток.
Электрическим током зовём упорядоченное движение частиц. В нашем случае под действие некого поля начинают двигаться в одном направлении все свободные электроны в образце.
Электропроводность металлов обусловлена концентрацией электронов и их подвижностью. Чем сильнее металл нагрет, тем сильнее прыгающие узлы будут мешать электронам свободно передвигаться в выбранном направлении. Чем больше столкновений, тем сильнее нагревается металл. Данный эффект применяется в нагревательных приборах и в лампах накаливания.
- https://promplace.ru/vidy-metallov-i-klassifikaciya-staty/electroprovodnost-metallov-1479.htm
Теплопроводность — свойство металлов переносить энергию от одной части тела к другой.
Оно связано с высокой подвижностью электронов: сталкиваясь с колеблющимися в узлах решётки ионами, атомами, электроны обмениваются с ними энергией. Как видим, данное свойство связано с предыдущим.
Металлический блеск — способность металлов отражать световые лучи.
Данное свойство обуславливается несколькими причинами. Во-первых, от гладкости поверхности, т.е. падающая электромагнитная волна (свет) не застревала в неровностях, а могла отразиться обратно.
Во-вторых, свет попадает на металл, поглощается электронами и через некое малое время излучается обратно, при этом количество энергии, которое может уйти на нагревание, небольшое. Отражённую волну воспринимает наш глаз, цвет волны определяется из величины «длина волны».
Твёрдость — свойство твёрдого тела сопротивляться проникновению в него другого тела.
Если хотите много теории по данному свойству, то прошу сюда:
- https://libmetal.ru/prop/tverd.htm
Оценка металла по шкале Мооса берёт за основу то, насколько легко образец может быть поцарапан другими металлами. Например, коэффициент твердости золота — 2,5-3, что значительно ниже коэффициента твердости большинства других материалов. В то время как графит и некоторые виды пластика стоят на одном конце шкалы, имея значение 1, то на другой её конец ставится алмаз, одно из самых твердых веществ на Земле. Он оценивается в 10 баллов.
Олово: 1.5
Цинк: 2.5
Золото: 2.5-3
Серебро: 2.5-3
Алюминий: 2.5-3
Медь: 3
Медь: 3
Бронза: 3
Никель: 4
Платина: 4-4.5
Сталь: 4-4.5
Железо: 4.5
Палладий: 4.75
Родий: 6
Титан: 6
Укрепленная сталь: 7-8
Вольфрам: 7.5
Карбид вольфрама: 8.5-9
Плотность — это отношение массы на объём.
Тяжело расшифровать определение, но я попробую. Оно значит, что при равном объёме разные металлы будут проявлять разную инерцию. Конечно, если и стало понятнее, то на чуток.
-лёгкие (плотность не более 5 г/см3) — магний, алюминий, титан и др.:
-тяжёлые — (плотность от 5 до 10 г/см3) — железо, никель, медь, цинк, олово и др. (это наиболее обширная группа);
-очень тяжёлые (плотность более 10 г/см3) — молибден, вольфрам, золото, свинец и др.
Таблицы с плотностями:
- https://thermalinfo.ru/svojstva-materialov/metally-i-splavy/plotnost-metallov-i-splavov-tablitsa
Температура плавления — температура, при которой осуществляется процесс перехода вещества из твёрдого состояния в жидкое.
При увеличении внутренней энергии начинают сильнее колебаться узлы, решётка теряет свою структуру, нарушаются связи. Примерно такой процесс можно назвать переходом в жидкое состоянии.
Делят металлы на несколько групп:
-легкоплавкие (температура плавления не превышает 600 oС) — цинк, олово, свинец, висмут и др.;
-среднеплавкие (от 600 oС до 1600 oС) — к ним относятся почти половина металлов, в том числе магний, алюминий, железо, никель, медь, золото;
-тугоплавкие ( более 1600 oС) — вольфрам, молибден, титан, хром и др.
Больше про плавление написано здесь:
- https://stanok.guru/stanki/metallorezhuschiy-stanok/temperatura-plavleniya-raznyh-metallov-v-tablice.html
Дополнительная общая ссылка:
- https://examer.ru/ege_po_himii/teoriya/svojstva_prostyx_veshhestv
Большое спасибо за внимание!
Источник
Глава 2. Металлы
Из курса химии 9 класса вы уже имеете представление о природе химической связи, существующей в кристаллах металлов, — металлической связи. Напомним, что в узлах металлических кристаллических решёток располагаются атомы и положительные ионы металлов, связанные посредством обобществлённых внешних электронов, принадлежащих всему кристаллу. Эти электроны компенсируют силы электростатического отталкивания между положительными ионами и тем самым связывают их, обеспечивая устойчивость металлической решётки.
Металлическая связь обусловливает все важнейшие физические свойства металлов: пластичность, электро- и теплопроводность, металлический блеск и другие свойства, характерные для этого класса простых веществ.
Пластичность — это свойство вещества изменять форму под внешним воздействием и сохранять принятую форму после прекращения этого воздействия.
Способность расплющиваться от удара или вытягиваться в проволоку под действием силы составляет важнейшее механическое свойство металлов. Оно лежит в основе такой уважаемой большинством народов мира профессии, как профессия кузнеца. Недаром покровителем кузнечного дела у разных народов был бог огня: у греков — Гефест, у римлян — Вулкан, у славян — Сварог.
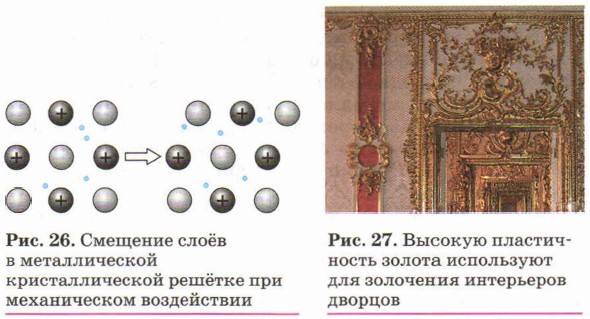
Пластичность металлов обусловлена способностью одних слоёв атом-ионов в кристаллах под внешним воздействием легко смещаться (как бы скользить) по отношению к другим слоям без разрыва связей между ними (рис. 26). Наиболее пластичны золото, серебро и медь. Например, из золота можно изготовить «золотую фольгу» толщиной 0,003 мм, которую используют для золочения изделий (рис. 27).
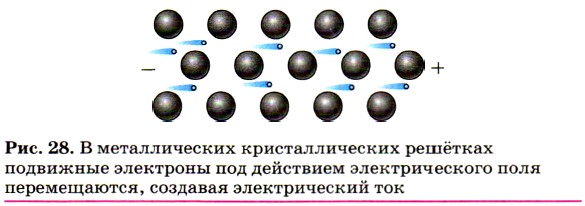
Высокая электропроводность большинства металлов обусловлена присутствием в их кристаллических решётках подвижных электронов, которые направленно перемещаются под действием электрического поля (рис. 28).
При нагревании колебательные движения ионов в кристалле усиливаются, что затрудняет направленное движение электронов и ведёт к снижению электрической проводимости. При охлаждении электропроводность металлов увеличивается и вблизи абсолютного нуля переходит в сверхпроводимость. Наибольшую электропроводность имеют серебро и медь, наименьшую — марганец, свинец, ртуть и вольфрам.
Такое свойство, как теплопроводность металлов, также связано с высокой подвижностью свободных электронов: сталкиваясь с колеблющимися в узлах решётки ионами, электроны обмениваются с ними энергией. С повышением температуры колебания ионов при посредстве электронов передаются другим ионам, и температура всего металлического предмета быстро выравнивается.
Для гладкой поверхности металлов характерен металлический блеск — результат отражения световых лучей. В порошкообразном состоянии большинство металлов теряет блеск, приобретая чёрную или серую окраску, и только алюминий и магний сохраняют блеск в порошке. Из алюминия, серебра и палладия, обладающих наиболее высокой отражательной способностью, изготовляют зеркала, в том числе и применяемые в прожекторах.
Для большинства металлов характерен белый или серый цвет. Золото и медь окрашены соответственно в жёлтый и жёлто-красный цвет.
Из других физических свойств металлов наибольший практический интерес представляют твёрдость, плотность и температура плавления.
Для большинства металлов характерен белый или серый цвет. Золото и медь окрашены соответственно в жёлтый и жёлто-красный цвет.
Из других физических свойств металлов наибольший практический интерес представляют твёрдость, плотность и температура плавления.
Для всех металлов (кроме ртути) при обычных условиях характерно твёрдое агрегатное состояние. Однако твёрдость их различна. Наиболее твёрдые — металлы побочной подгруппы VI группы (VIB группы) Периодической системы Д. И. Менделеева. Так, хром по твёрдости приближается к алмазу. Самые мягкие — металлы главной подгруппы I группы (IA группы) Периодической системы Д. И. Менделеева — щелочные металлы. Например, натрий и калий легко режутся ножом.

По плотности металлы делят на лёгкие (плотность меньше 5 г/см3) и тяжёлые (плотность больше 5 г/см3). К лёгким относят щелочные, щёлочноземельные металлы и алюминий. Из переходных металлов сюда включают скандий, иттрий и титан. Эти металлы, благодаря лёгкости и тугоплавкости, всё шире применяют в различных областях техники.
Самый лёгкий металл — это литий (р = 0,53 г/см3). Самый тяжёлый — осмий (р = 22,6 г/см3).
Лёгкие металлы обычно легкоплавки, галлий может плавиться уже на ладони руки, а тяжёлые металлы — тугоплавки. Наибольшей температурой плавления, которая равна 3380 °С, обладает вольфрам. Это свойство вольфрама используют для изготовления ламп накаливания (рис. 29, 2). Кроме него в конструкцию лампы входят ещё семь металлов.
В Российской Федерации в настоящее время, как и ранее в Евросоюзе и США, на государственном уровне принято решение о замене привычных ламп накаливания на более экономичные и долговечные современные лампы, например галогенные, люминесцентные и светодиодные. Галогенная лампа (рис. 29, 2) — это та же лампа накаливания с вольфрамовой нитью, заполненная инертными газами с добавкой паров галогенов (брома или иода).

Люминесцентные (рис. 29, 3) — это хорошо знакомые вам лампы дневного света, имеющие один существенный недостаток — они содержат ртуть, а потому нуждаются в соблюдении особых правил утилизации на специальных пунктах приёма. Светодиодные лампы (рис. 29, 4) — самые экономичные и самые долговечные (срок работы до 100 тыс. ч), но пока и самые дорогие из ламп.
В технике, как вы уже знаете, металлы делят на чёрные (железо и его сплавы) и цветные (все остальные, более подробно о них будет рассказано в следующем параграфе) (рис. 30). Золото, серебро, платину и некоторые другие металлы относят к драгоценным металлам (рис. 31). 1


1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.
2. Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и слово-сочетаниям следующего параграфа.

1. Назовите самый легкоплавкий металл.
2. Какие физические свойства металлов используют в технике?
3. Фотоэффект, т. е. свойство металлов испускать электроны под действием лучей света, характерен для щелочных металлов, например для цезия. Почему? Где это свойство находит применение?
4. Какие физические свойства вольфрама лежат в основе его применения в лампах накаливания?
5. Какие свойства металлов лежат в основе образных литературных выражений: «серебряный иней», «золотая заря», «свинцовые тучи»?
- Физические свойства металлов. Ответы
Источник
Металлы
Металлы относятся к основным природным материалам используемым человечеством.
Металлургия – одна из базовых отраслей промышленности, определяющих экономический и военный потенциал страны. Создаются новые сплавы с заданными свойствами, в качестве добавок используются различные металлы.
Около 80% всех известных химических элементов ПСЭ составляют металлы. Наиболее распространенными металлами являются: Al – 8,8%; Fe – 4,0%; Ca – 3,6%; Na – 2,64%; K – 2,6%; Mg – 2,1%; Ti – 0,64%.
Для металлов характерны свой специфические свойства, отличающие их от металлоидов: пластичность, высокая тепло – и электропроводность, твердость, для большинства металлов высокая температура плавления и кипения, металлический блеск.
Пластичностью называется способность металлов под действием внешних сил подвергаться деформации, которая остается и после прекращения этого действия. Благодаря пластичности металлы подвергаются ковке, прокатке, штамповке. Металлы имеют различную пластичность.
Металлический блеск. Гладкая поверхность металлов отражает световые лучи. Чем меньше она эти лучи поглощает, тем больше металлический блеск. По блеску металлы можно расположить в следующий ряд: Ag, Pd, Cu, Au, Al, Fe.
На этом свойстве металлов основано производство зеркал.
Металлы характеризуются также высокой тепло – и электропроводностью. По электропроводности I место занимает Ag, Cu, Al.
С повышением температуры электропроводность уменьшается, так как усиливается колебательное движение ионов в узлах кристаллической решетки, что препятствует направленному движению электронов.
С понижением температуры электропроводность увеличивается и в области близкой к абсолютному нулю у многих металлов наблюдается сверхпроводимость.
Причиной общности физических и химических свойств металлов объясняется общностью строения их атомов и природой кристаллических решеток металлов.
Атомы металлов имеют большее, по сравнению с неметаллами размеры. Внешние электроны атомов металлов значительно удалены от ядра и связаны с ним слабо, поэтому металлы имеют низкие потенциалы ионизации (являются восстановителями).
Специфические свойства металлов – пластичность, тепло – и электропроводность, блеск объясняются тем, что в металлах имеются «свободные» электроны, способные перемещаться по всему кристаллу.
Для металлов характерна металлическая связь (она объясняется на основе метода МО).
Физические свойства металлов.
Все металлы, за исключением ртути, при обыкновенной температуре являются твердыми веществами с характерным металлическим блеском.
Большинство металлов имеют цвет от темно-серого, до серебристо-белого. Золото и цезий имеют желтый цвет, совершенно чистая медь – светло-розовый, некоторые металлы обладают красноватым оттенком (висмут).
Плотность металлов может колебаться в широких пределах; например плотность Li = 0,53г/см3 (самый легкий), а Os является самым тяжелым металлом 22,48г/см3.
В пределах одной подгруппы аналогов величины плотностей, как правило, растут с возрастанием заряда ядра атома.
В технике металлы классифицируются по плотности: легкие, тяжелые, легкоплавкие и тугоплавкие.
Нахождение в природе.
В природе металлы встречаются как в самородном состоянии, так и в виде различных соединений. В самородном состоянии находятся только химически малоактивные металлы – Pt, Ag, Au. Химически активные металлы встречаются только в виде различных соединений – руд.
Руды бывают: окисные, сульфидные и соли.
Предварительно руду обогащают, то есть отделяют от пустой породы. Самый распространенный метод – флотационный, он основан на различной смачиваемости поверхности минералов водой.
Методы извлечения минералов из руд определяются их химическим составом. Все способы получения металлов сводятся к реакциям окисления – восстановления.
Карботермия. В этом методе получения металлов восстановителем служит углерод – самый дешевый и самый доступный. Углерод применяют в виде кокса, а окисленный углерод легко удаляется в виде СО2.
Углерод применяется для восстановления сравнительно малоактивных металлов: Fe, Cu, Zn, Pb.
При восстановлении углеродом смеси железной руды с оксидами Cr, Mo, W или Mn в промышленности получают сплавы, содержащие примерно 70% указанных металлов и очень небольшое количество углерода. Это ферросплавы, служат для получения специальных легированных сталей. Для восстановления углеродом пригодны только окиси.
Сульфидные руды (цинковые, свинцовые, медные) сначала подвергают окислительному прокаливанию:
2ZnS + 2O2 → 2ZnO + SO2
Li, Ca, Ba также, как и металлы III группы, не могут быть получены восстановлением углеродом, так как они сразу же после выделения в свободном состоянии с избытком углерода образуют карбиды.
Металлотермия. Основана на процессах вытеснения одного металла (менее активного) другим (более активным) из соответствующих окислов, хлоридов, сульфидов.
Очень хорошим восстановителем окислов металлов вследствие большого сродства к кислороду является алюминий. Процесс называется алюминотермия.
Fe2O3 + 2Al = Al2O3 + 2Fe
Алюминотермией получают и другие металлы (Mn, Cr, Ti), которые не могут быть получены в чистом виде восстановлением их окисей углем из-за образования карбидов. В алюмотермической реакции выделяется большое количество тепла за очень короткое время, вследствие чего развивается высокая температура.
Электролитическое или катодное восстановление металлов. Для трудновосстанавливаемых металлов уголь как восстановитель непригоден и в этом случае применяют катодное восстановление, то есть выделение путем электролиза. Такие металлы могут окисляться водой, поэтому их соединения подвергаются электролизу не в водных растворах, а в расплавах или растворах других растворителей.
Например, металлические Na, K, Ba, Ca, Mg, Be получают электролизом расплавов соответствующих хлоридов.
Получение металлов высокой чистоты.
В связи с бурным развитием техники потребовались металлы, обладающие очень высокой чистотой. Например, для надежной работы ядерного реактора необходимо, чтобы в расщепляющихся материалах такие примеси как бор, кадмий и др., содержались в количестве, не превышающих миллионных долей процента. Чистый цирконий – один из лучших конструкционных материалов для атомных реакторов – становится совершенно непригодным для этой цели, если в нем содержится даже ничтожная примесь гафния.
Перегонка в вакууме. Этот метод основан на различной летучести очищаемого металла и имеющихся в нем примесей. Исходный металл загружается в специальный сосуд, соединенный с вакуумным насосом и в сосуде создают вакуум, после чего нижняя часть сосуда нагревается. На холодных частях сосуда осаждаются либо примеси, либо чистый металл, в зависимости от того, что является более летучим.
Термическое разложение.
1. Карбонильный процесс. Этот процесс используют в основном для получения чистого никеля и чистого железа. Металл содержащий примеси, нагревают в присутствии СО (окиси углерода) и получающийся летучий карбонил отгоняют от нелетучих примесей. Затем карбонилы разлагают при более высоких температурах с образованием высокочистых металлов.
2. Йодистый процесс дает возможность получать такие металлы, как цирконий, титан.
3. Очистка металла (обычно содержащего в качестве примесей окисел) в вакууме при нагревании его до очень высокой температуры при помощи электрической дуги.
Зонная плавка. Этот метод заключается в протягивании бруска неочищенного Германия через узкую печь; образующаяся при этом расплавленная зона, по мере продвижения бруска через нее перемещается вдоль него и уносит за собой примеси.
Многократным повторением этого процесса можно достигнуть высокой степени чистоты.
Химические свойства металлов.
У металлов отсутствует способность присоединять электроны, следовательно металлы являются восстановителями. Мерой химической активности металлов является энергия ионизации J.
Окислителями металлов могут быть: элементарные вещества, кислоты, соли менее активных металлов и т. д.
1. Взаимодействие с элементарными веществами.
2. Взаимодействие с кислотами:
а) Окислитель – ион Н+ (HCl, H2SO4 (разб.) и т. д.);
б) Окислитель анион кислоты (к таким кислотам относятся HNO3 и H2SO4 (конц.);
в) Взаимодействие с водой;
г) Взаимодействие со щелочами;
д) Взаимодействие с растворами солей.
Оксиды металлов
Все атомы кислорода непосредственно связаны с атомами металла и не связаны друг с другом: Ме * О2.
Классификация оксидов металлов
Основные – оксиды наиболее активных металлов (s – элементы I и II групп) – связь ионная: Na2O, K2O, CaO, MgO и т. д.
Их свойства: а) взаимодействуют с кислотами; б) с кислотными оксидами; в) с водой.
Амфотерные оксиды (менее активных металлов и d – элементов): Al2O3, ZnO, Cr2O3 и т. д.
Их свойства: а) взаимодействие с кислотами; б) взаимодействие со щелочами.
Кислотные – оксида малоактивных металлов в высших степенях окисления (CrO3, Mn2O7 и др.). Их свойства: а) взаимодействие с водой, образуя кислоты; б) взаимодействуют с основаниями (щелочами).
Характер изменения свойств оксидов
В пределах одного периода происходит ослабление основных свойств через амфотерные и усиление кислотных слева на право.
В группе у одного и того же элемента наблюдается такое же изменение свойств.
Получение оксидов.
1. Непосредственное окисление металлов – горение.
Са + О = СаО
4Na + O2 = 2Na2O
2. Окисление сульфидов.
ZnS + O2 = ZnO + SO2
3. Окисление оксидами других элементов, если теплота образования получающегося оксида больше теплоты образования исходного (металлотермия).
Al + Cr2O3 = Cr + Al2O3 + Q
4. Обезвоживание соответствующих гидроксидов.
Al(OH)3 Al2O3 + H2O
5. Термическое разложение карбонатов, нитратов, сульфатов и других солей.
СаСО3 СаО + СО2
Гидроксиды металлов.
Классификация: основные, амфотерные, кислотные (соответствуют оксидам).
Характер изменения свойств в природе – аналогично оксидам.
Источник
