Какие частицы обусловливают такие свойства металлов

Похожие вопросы:

Химия, 12.03.2019 14:40
Некое вещество имеет атомную кристаллическую решетку. охарактеризуйте предположительно его свойства по плану : а) твердость; б) электропроводимость; в) пластичность или хрупкость; г) металлический блеск; д) температура плавления
Ответов: 1

Другие предметы, 16.04.2019 23:10
Укажите свойство металлов, которое используется при производстве зеркал 1) пластичность 2) металлический блеск
Ответов: 2

Другие предметы, 17.04.2019 07:30
Дополните. Химическая связь, обусловливающая металлический блеск и пластичность металлов, – … .
Ответов: 2

Химия, 25.05.2019 22:20
1. ионная связь возникает в результате а. образования общих электронных пар б. обобществления электронов внешнего энергетического уровня многих атомов в. взаимного притяжения разноименно заряженных ионов г. различие в электроотрицательности атомов 2. какие частицы обуславливают такие свойства, металлов, как пластичность, металлический блеск, электрическая проводимость, теплопроводность а. атомы б. ионы в. молекулы г. обобществленные электроны (электронный газ)
Ответов: 1

Химия, 04.07.2019 02:00
Где применяется теплопроводность металлов, металлический блеск, и пластичность
Ответов: 3

Химия, 08.07.2019 12:20
Стестом по а4. оцените следующие утверждения: а) для атомов металлов характерны восстановительные и окислительные свойства; б) на внешнем энергетическом уровне атомов металлов от 4 до 8 электронов. 1) верно только а 2) верно только б 3) верны оба суждения 4) оба суждения неверны а5. металлы, встречающиеся в природе только в виде сложных соединений: 1) золото и алюминий 2) натрий и кальций 3) медь и железо 4) серебро и золото а6. тип связи в простом веществе кальции: 1) ионная 2) ковалентная неполярная 3) ковалентная полярная 4) металлическая а7. к свойствам металлов не относят: 1) пластичность 2) металлический блеск 3) электропроводность 4) растворимость в воде
Ответов: 1

Химия, 10.07.2019 22:50
Что не является общим свойством металлов? а)тугоплавкость б)пластичность в)высокая электропроводность г)металлический блеск
Ответов: 2

Химия, 15.07.2019 14:00
Какое свойство нехарактерно для простых веществ- металлов? a)хорошая теплопроводность b)хрупкость c)пластичность d)металлический блеск
Ответов: 3

Химия, 13.08.2019 19:40
Какие утверждения верны 1) металлическая связь обуславливает общие свойства металлов 2) металлический блеск металлов являются результатом отражения от их поверхности световых лучей 3) железо самый тугоплавкий металл 4) основы сна принадлежностей железо и его сплавы металлы делятся на черные и цветные 5) самый легкий металл относится к семейству щелочноземельных металлов 6) способность отдавать электроны в реакциях это характерно свойство металлов за .
Ответов: 2

Химия, 13.09.2019 08:50
Ксвойствам металлов не относят: a. пластичность b. металлический блеск c. электропроводность d. растворимость в воде
Ответов: 3

Физика, 02.10.2019 17:10
Увсех металлов компактном состоянии есть металлический блеск. большинство металлов при переходе в стружку опилки или пыль утрачивает это свойство. а какие два металла великолепной семерки сохраняют блеск даже в таком состоянии? а)золото, б)железо, в)медь, г)свинец, д)серебро.
Ответов: 2

Химия, 23.10.2019 11:31
а
1. охарактеризуйте эпохи металлов в человечества (8 7):
– век медный – .
– век бронзовый – .
– век железный – .
і. свойства металлов
1.заполните таблицу “строение и свойства металлов” (8 9)
шедев
vll, po na
свойство
cacau,
особенность строения | примеры металлов, у
кристаллической решётки которых свойство наиболее
выражено
пластичность
электропроводность
теплопроводность
металлический блеск
твердость
arme zou
плотность
– твердые – .
– мягкие –
– лёгкие –
– тяжёлые –
– лёгкоплавкие . .
– тугоплавкие —
температура плавления
в технике металлы
черные . .
– цветные – .
– драгоценные . .
Ответов: 1
У тебя есть свой ответ?
Какие частицы обусловливают такие свойства металлов, как пластичность, металлический блеск, электрич…
Отправлено
Вопросы по другим предметам:

Другие предметы, 17.04.2019 03:40

Другие предметы, 17.04.2019 03:40

Другие предметы, 17.04.2019 03:40

Другие предметы, 17.04.2019 03:40

Другие предметы, 17.04.2019 03:40

Другие предметы, 17.04.2019 03:40

Другие предметы, 17.04.2019 03:40

Другие предметы, 17.04.2019 03:40

Другие предметы, 17.04.2019 03:40

Другие предметы, 17.04.2019 03:40
Источник
Атомы в молекуле удерживаются посредством химической связи. Если молекула состоит из разных атомов (KF, Na2S, CO2, H2O), то речь идёт о ковалентной полярной (случай, когда в молекулу входят атомы неметаллов) или ионной связи (случай, когда молекула состоит из атома металла и атома неметалла). Если мы имеем дело с молекулой, состоящей из атомов неметалла одного вида (О2, N2, Br2), то в этом случае имеет место ковалентная неполярная связь. А как же связаны атомы в металлах, например, в натрии Na, кальции Са или алюминии Al?
Фото: livemaster.ru
Металлическая связь
Составляющие металл атомы удерживаются в единой структуре посредством химической связи. Не будь её, не существовало бы кристаллов. И эта связь носит название металлическая.
Металлическая связь – это связь, возникающая в результате обобществления электронов, находящихся на внешних электронных слоях атомов.
Чтобы понять это довольно сложно определение, посмотрим пример. Но для начала вспомним, как построены атомы металлов. В таблице Менделеева элементы-металлы располагаются в левом нижнем углу (мы говорим о главных подгруппах). У атомов металлов на внешнем электронном слое мало электронов. Кроме того, чем ниже мы опускаемся по группе в периодической таблице, тем больше становится радиус атома. Это означает, что на внешний слой всё дальше от ядра (напомню, что ядро атома имеет положительный заряд). Из-за этого электроны на внешнем уровне все меньше притягиваются к ядру. Малое число электронов и их удалённость от ядра позволяют им с лёгкостью отрываться от атома. При этом, как вы помните, атом превращается в ион, в данном случае в катион:
Me – 1e- → Me+1
Здесь Me – произвольный металл, с одним электроном на внешнем электронном уровне. В случае, если на внешнем электронном уровне несколько электронов, схема выглядит так:
Me – ne- → Me+n
Здесь n – число валентных электронов. Например, для кальция, стоящего во второй группе таблицы Менделеева и имеющего 2 электрона не внешнем уровне, схема такова:
Са – 2e- → Са+2
Для алюминия, стоящего в третьей и группе и имеющего 3 электрона на внешнем уровне, мы можем записать такую схему:
Al – 3e- → Al+3
Тут уместно задаться вопросом, а куда же деваются эти самые оторвавшиеся от атомов электроны? Они никуда не исчезают, а просто перемещаются от одного атома к другому. «Найдя» катион, электрон просто временно присоединяется к нему, чтобы тут же оторваться и отправиться в новое путешествие между атомами в поисках нового катиона. Фактически образуется эдакая динамическая система, в которой есть атомы и катионы металлов и курсирующие между ними электроны, которые то и дело присоединяются и отрываются, превращая катионы в атомы и атомы в катионы:
Me – ne- ⇄ Me+n
За счёт чего удерживается эта структура? За счёт электростатического взаимодействия, то есть притяжения отрицательно и положительно заряженных частиц.
Чтобы представить себе это более чётко, вообразите структуру из катионов, которая погружена в своеобразный «газ» из электронов. Это и есть металлическая связь. Подобным образом построены все металлы и их сплавы, когда они находятся в твёрдом или расплавленном состоянии.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Источник
Глава 2. Металлы
Из курса химии 9 класса вы уже имеете представление о природе химической связи, существующей в кристаллах металлов, — металлической связи. Напомним, что в узлах металлических кристаллических решёток располагаются атомы и положительные ионы металлов, связанные посредством обобществлённых внешних электронов, принадлежащих всему кристаллу. Эти электроны компенсируют силы электростатического отталкивания между положительными ионами и тем самым связывают их, обеспечивая устойчивость металлической решётки.
Металлическая связь обусловливает все важнейшие физические свойства металлов: пластичность, электро- и теплопроводность, металлический блеск и другие свойства, характерные для этого класса простых веществ.
Пластичность — это свойство вещества изменять форму под внешним воздействием и сохранять принятую форму после прекращения этого воздействия.
Способность расплющиваться от удара или вытягиваться в проволоку под действием силы составляет важнейшее механическое свойство металлов. Оно лежит в основе такой уважаемой большинством народов мира профессии, как профессия кузнеца. Недаром покровителем кузнечного дела у разных народов был бог огня: у греков — Гефест, у римлян — Вулкан, у славян — Сварог.
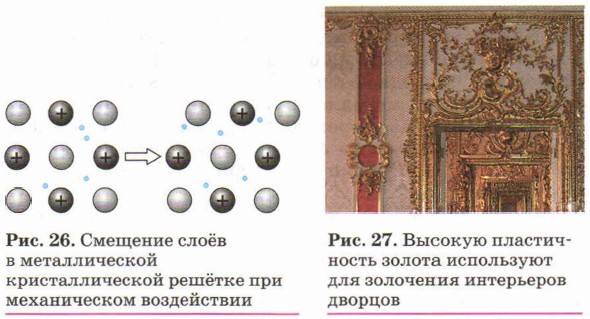
Пластичность металлов обусловлена способностью одних слоёв атом-ионов в кристаллах под внешним воздействием легко смещаться (как бы скользить) по отношению к другим слоям без разрыва связей между ними (рис. 26). Наиболее пластичны золото, серебро и медь. Например, из золота можно изготовить «золотую фольгу» толщиной 0,003 мм, которую используют для золочения изделий (рис. 27).
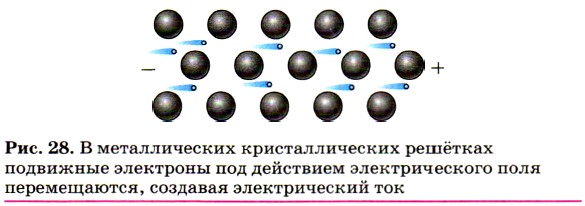
Высокая электропроводность большинства металлов обусловлена присутствием в их кристаллических решётках подвижных электронов, которые направленно перемещаются под действием электрического поля (рис. 28).
При нагревании колебательные движения ионов в кристалле усиливаются, что затрудняет направленное движение электронов и ведёт к снижению электрической проводимости. При охлаждении электропроводность металлов увеличивается и вблизи абсолютного нуля переходит в сверхпроводимость. Наибольшую электропроводность имеют серебро и медь, наименьшую — марганец, свинец, ртуть и вольфрам.
Такое свойство, как теплопроводность металлов, также связано с высокой подвижностью свободных электронов: сталкиваясь с колеблющимися в узлах решётки ионами, электроны обмениваются с ними энергией. С повышением температуры колебания ионов при посредстве электронов передаются другим ионам, и температура всего металлического предмета быстро выравнивается.
Для гладкой поверхности металлов характерен металлический блеск — результат отражения световых лучей. В порошкообразном состоянии большинство металлов теряет блеск, приобретая чёрную или серую окраску, и только алюминий и магний сохраняют блеск в порошке. Из алюминия, серебра и палладия, обладающих наиболее высокой отражательной способностью, изготовляют зеркала, в том числе и применяемые в прожекторах.
Для большинства металлов характерен белый или серый цвет. Золото и медь окрашены соответственно в жёлтый и жёлто-красный цвет.
Из других физических свойств металлов наибольший практический интерес представляют твёрдость, плотность и температура плавления.
Для большинства металлов характерен белый или серый цвет. Золото и медь окрашены соответственно в жёлтый и жёлто-красный цвет.
Из других физических свойств металлов наибольший практический интерес представляют твёрдость, плотность и температура плавления.
Для всех металлов (кроме ртути) при обычных условиях характерно твёрдое агрегатное состояние. Однако твёрдость их различна. Наиболее твёрдые — металлы побочной подгруппы VI группы (VIB группы) Периодической системы Д. И. Менделеева. Так, хром по твёрдости приближается к алмазу. Самые мягкие — металлы главной подгруппы I группы (IA группы) Периодической системы Д. И. Менделеева — щелочные металлы. Например, натрий и калий легко режутся ножом.

По плотности металлы делят на лёгкие (плотность меньше 5 г/см3) и тяжёлые (плотность больше 5 г/см3). К лёгким относят щелочные, щёлочноземельные металлы и алюминий. Из переходных металлов сюда включают скандий, иттрий и титан. Эти металлы, благодаря лёгкости и тугоплавкости, всё шире применяют в различных областях техники.
Самый лёгкий металл — это литий (р = 0,53 г/см3). Самый тяжёлый — осмий (р = 22,6 г/см3).
Лёгкие металлы обычно легкоплавки, галлий может плавиться уже на ладони руки, а тяжёлые металлы — тугоплавки. Наибольшей температурой плавления, которая равна 3380 °С, обладает вольфрам. Это свойство вольфрама используют для изготовления ламп накаливания (рис. 29, 2). Кроме него в конструкцию лампы входят ещё семь металлов.
В Российской Федерации в настоящее время, как и ранее в Евросоюзе и США, на государственном уровне принято решение о замене привычных ламп накаливания на более экономичные и долговечные современные лампы, например галогенные, люминесцентные и светодиодные. Галогенная лампа (рис. 29, 2) — это та же лампа накаливания с вольфрамовой нитью, заполненная инертными газами с добавкой паров галогенов (брома или иода).

Люминесцентные (рис. 29, 3) — это хорошо знакомые вам лампы дневного света, имеющие один существенный недостаток — они содержат ртуть, а потому нуждаются в соблюдении особых правил утилизации на специальных пунктах приёма. Светодиодные лампы (рис. 29, 4) — самые экономичные и самые долговечные (срок работы до 100 тыс. ч), но пока и самые дорогие из ламп.
В технике, как вы уже знаете, металлы делят на чёрные (железо и его сплавы) и цветные (все остальные, более подробно о них будет рассказано в следующем параграфе) (рис. 30). Золото, серебро, платину и некоторые другие металлы относят к драгоценным металлам (рис. 31). 1


1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.
2. Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и слово-сочетаниям следующего параграфа.

1. Назовите самый легкоплавкий металл.
2. Какие физические свойства металлов используют в технике?
3. Фотоэффект, т. е. свойство металлов испускать электроны под действием лучей света, характерен для щелочных металлов, например для цезия. Почему? Где это свойство находит применение?
4. Какие физические свойства вольфрама лежат в основе его применения в лампах накаливания?
5. Какие свойства металлов лежат в основе образных литературных выражений: «серебряный иней», «золотая заря», «свинцовые тучи»?
- Физические свойства металлов. Ответы
Источник
В данной статье ознакомимся с основными физическими свойствами металлов. Вашему вниманию будут представлены пластичность, электропроводность, теплопроводность, металлический блеск, твёрдость, плотность, температура плавления.
Начнём с пластичности.
Пластичность — это свойство вещества изменять форму под внешним воздействием, не разрушаясь, и сохранять принятую форму после прекращения этого воздействия.
Почему у металлов так выходит? Это происходит из-за их строения, виновной выступает кристаллическая решётка. Она состоит из узлов и свободных электронов, которые бегают между углами, никому не принадлежа. В узлах могут быть атомы, молекулы или ионы. Электроны то присоединяются к ним, то уходят. Именно взаимосвязью между бегающими по всему веществу электронами и узлами объяснятся свойство пластичности: слои смещаются друг с другом без разрыва.
Как же определить и сравнить пластичность разных металлов? Она определяется при испытании на растяжение. Под действием нагрузки образцы разных металлов в различной степени удлиняются, а их поперечное сечение уменьшается. Чем больше способен образец удлиняться, а его поперечное сечение сужаться, тем пластичнее образец.
Существуют две единицы измерения: относительное удлинение и относительное сужение при разрыв.
По степени пластичности металлы принято подразделять следующим образом:
-высокопластичные (относительное удлинение превосходит 40 %) — металлы, составляющие основу большинства конструкционных сплавов (алюминий, медь, железо, титан, свинец) и «легкие» металлы (натрий, калий, рубидий и др.);
-пластичные (относительное удлинение лежит в диапазоне между 40 и 3%) — магний, цинк, молибден, вольфрам, висмут и др. (наиболее обширная группа);
-хрупкие (относительное удлинение меньше 3%) — хром, марганец, кобальт, сурьма.
Электропроводность — свойство проводить электрический ток.
Электрическим током зовём упорядоченное движение частиц. В нашем случае под действие некого поля начинают двигаться в одном направлении все свободные электроны в образце.
Электропроводность металлов обусловлена концентрацией электронов и их подвижностью. Чем сильнее металл нагрет, тем сильнее прыгающие узлы будут мешать электронам свободно передвигаться в выбранном направлении. Чем больше столкновений, тем сильнее нагревается металл. Данный эффект применяется в нагревательных приборах и в лампах накаливания.
- https://promplace.ru/vidy-metallov-i-klassifikaciya-staty/electroprovodnost-metallov-1479.htm
Теплопроводность — свойство металлов переносить энергию от одной части тела к другой.
Оно связано с высокой подвижностью электронов: сталкиваясь с колеблющимися в узлах решётки ионами, атомами, электроны обмениваются с ними энергией. Как видим, данное свойство связано с предыдущим.
Металлический блеск — способность металлов отражать световые лучи.
Данное свойство обуславливается несколькими причинами. Во-первых, от гладкости поверхности, т.е. падающая электромагнитная волна (свет) не застревала в неровностях, а могла отразиться обратно.
Во-вторых, свет попадает на металл, поглощается электронами и через некое малое время излучается обратно, при этом количество энергии, которое может уйти на нагревание, небольшое. Отражённую волну воспринимает наш глаз, цвет волны определяется из величины «длина волны».
Твёрдость — свойство твёрдого тела сопротивляться проникновению в него другого тела.
Если хотите много теории по данному свойству, то прошу сюда:
- https://libmetal.ru/prop/tverd.htm
Оценка металла по шкале Мооса берёт за основу то, насколько легко образец может быть поцарапан другими металлами. Например, коэффициент твердости золота — 2,5-3, что значительно ниже коэффициента твердости большинства других материалов. В то время как графит и некоторые виды пластика стоят на одном конце шкалы, имея значение 1, то на другой её конец ставится алмаз, одно из самых твердых веществ на Земле. Он оценивается в 10 баллов.
Олово: 1.5
Цинк: 2.5
Золото: 2.5-3
Серебро: 2.5-3
Алюминий: 2.5-3
Медь: 3
Медь: 3
Бронза: 3
Никель: 4
Платина: 4-4.5
Сталь: 4-4.5
Железо: 4.5
Палладий: 4.75
Родий: 6
Титан: 6
Укрепленная сталь: 7-8
Вольфрам: 7.5
Карбид вольфрама: 8.5-9
Плотность — это отношение массы на объём.
Тяжело расшифровать определение, но я попробую. Оно значит, что при равном объёме разные металлы будут проявлять разную инерцию. Конечно, если и стало понятнее, то на чуток.
-лёгкие (плотность не более 5 г/см3) — магний, алюминий, титан и др.:
-тяжёлые — (плотность от 5 до 10 г/см3) — железо, никель, медь, цинк, олово и др. (это наиболее обширная группа);
-очень тяжёлые (плотность более 10 г/см3) — молибден, вольфрам, золото, свинец и др.
Таблицы с плотностями:
- https://thermalinfo.ru/svojstva-materialov/metally-i-splavy/plotnost-metallov-i-splavov-tablitsa
Температура плавления — температура, при которой осуществляется процесс перехода вещества из твёрдого состояния в жидкое.
При увеличении внутренней энергии начинают сильнее колебаться узлы, решётка теряет свою структуру, нарушаются связи. Примерно такой процесс можно назвать переходом в жидкое состоянии.
Делят металлы на несколько групп:
-легкоплавкие (температура плавления не превышает 600 oС) — цинк, олово, свинец, висмут и др.;
-среднеплавкие (от 600 oС до 1600 oС) — к ним относятся почти половина металлов, в том числе магний, алюминий, железо, никель, медь, золото;
-тугоплавкие ( более 1600 oС) — вольфрам, молибден, титан, хром и др.
Больше про плавление написано здесь:
- https://stanok.guru/stanki/metallorezhuschiy-stanok/temperatura-plavleniya-raznyh-metallov-v-tablice.html
Дополнительная общая ссылка:
- https://examer.ru/ege_po_himii/teoriya/svojstva_prostyx_veshhestv
Большое спасибо за внимание!
Источник
