Какие бывают атомы и их свойства
Атомы – мельчайшие частицы, из которых состоит все вокруг: все, что нас окружает, состоит из молекул, состоящих из атомов. Их невозможно увидеть с использованием каких бы то ни было увеличительных приборов в силу их невероятно маленьких размеров. Но ведь атомы тоже должны из чего-то состоять. Значит, должны существовать еще более маленькие частицы. Сразу говорю, это довольна непростая для понимания тема, поэтому текста много, да и читать нужно вдумчиво. Тем не менее, это крайне увлекательно – знать о настолько малых частицах, которые невозможно даже увидеть. Что ж, давайте разбираться!
Немного о самом атоме
Вообще, термин “атом” был изобретен очень давно: за 400 лет до н. э. греческий философ Демокрит выдвинул идею, что вещество можно делить до тех пор, пока не будут получены его наименьшие возможные частицы, названные атомами. Конечно, в гипотезе Демокрита атомы являются совсем не тем, чем их считают сейчас, но, тем не менее, идея атомизма очень древняя. В 1808 г. химик Джон Дальтон сформулировал атомистическую теорию: все вещества состоят из атомов, мельчайших неделимых частиц, которые нельзя ни создать, ни уничтожить. Также, Дальтон утверждал, что атомы одного и того же элемента абсолютно одинаковы. Так зародилась атомистическая теория, и было заложено начало к изучению самих атомов.
Теперь немного о характеристиках атома. Не для кого не секрет, что атом чрезвычайно мал. Но даже его можно измерить – а именно указать его массу и диаметр. Диаметры атомов в среднем – 0,2 нм (0,0000000002 м). Массы рознятся сильнее: от 10 в минус 27 степени (ноль с двадцатью шестью нолями и единицей после запятой) кг до 10 в минус 25 степени ( ноль с двадцатью четырьмя нолями и единицей после запятой) кг. Для избежания участия столь малых цифр в расчетах, массы атомов обычно выражают в атомных единицах массы (а. е. м.). 1 а. е. м. = 1,661 на 10 в минус 27 степени.
Какие частицы входят в состав атома?
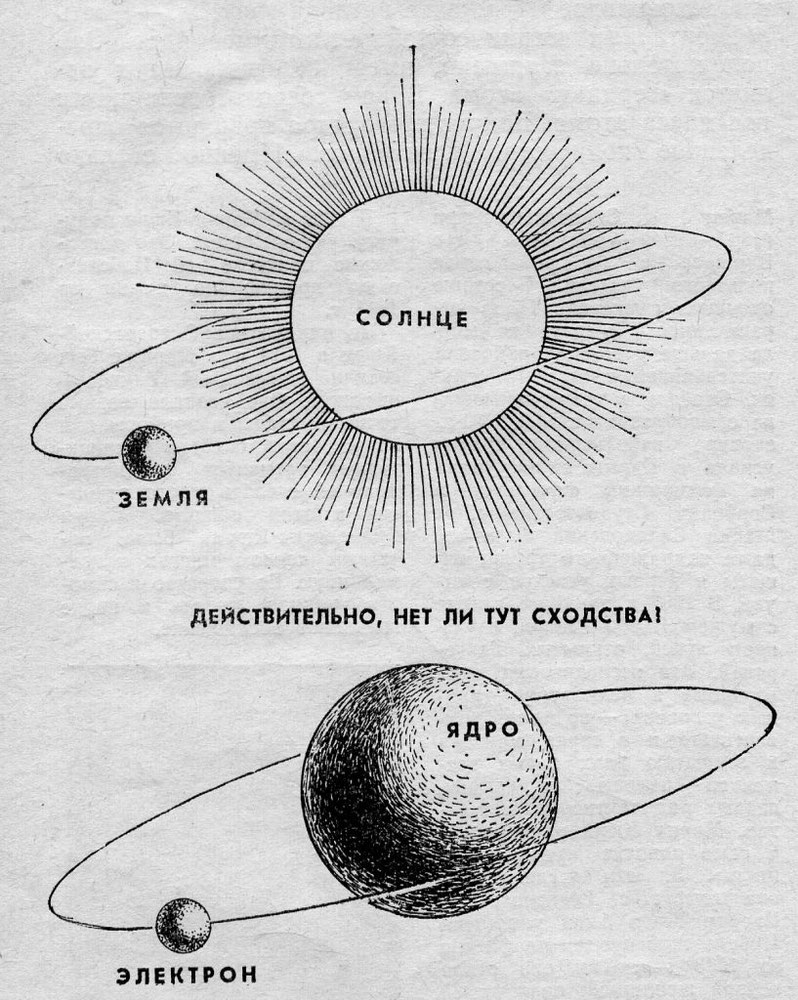
Мы уже представляли себе атом таким, каким его рисуют в sci-fi фильмах: ядро, состоящее из протонов и нейтронов в центре, и электроны, вращающиеся вокруг ядра. Но что представляют из себя протоны, нейтроны и электроны?
Строение атома из фильмов, отражающее частицы, входящие в него
Нейтрон – это элементарная незаряженная частица. Электрический заряд равен 0 е, масса равна 1 а. е. м. Нейтрон был открыт в 1932 г. Чедвиком в ходе ядерной реакции между атомами бериллия и гелия. Нейтрон входит в состав атомного ядра
Протон – это элементарная положительная частица. Электрический заряд равен +1 е, масса равна 1 а. е. м. Открыт в 1919 г. Резерфордом. Входит в состав атомного ядра вместе с нейтроном, представляет собой ядро атома водорода.
Электрон – это элементарная отрицательная частица. Электрический заряд равен -1 е (равен по модулю заряду протона), масса равна 0,00054 а. е. м., поэтому для простоты расчетов считается, что электрон не имеет массы. Открыт в 1897 г. Томсоном при изучении поведения катодных лучей (электронов) в магнитном и электрическом поле. Электроны не входят в состав ядра, а находятся снаружи, двигаясь по специальным траекториям, но об этом позднее.
Как частицы располагаются в атоме?
Ученые Гейгер и Марсден в 1909 г. проводили бомбардировку золотой фольги альфа-частицами (ядрами гелия). Частицы проходили через фольгу, как и ожидалось, однако, малая их часть отражалась обратно. Примерно 1 из 8000 частиц отскакивали. Был сделан вывод, что частицы сталкиваются с положительными и тяжелыми центрами, которые должны располагаться в ничтожно малой части атома, раз так мало частиц отражается обратно. Так появилось представление об атомном ядре: отражались только те частицы, которые сталкивались с ядрами. Таким образом, атомное ядро имеет намного меньший размер, чем сам атом; остальное пространство в атоме занимают электроны. И если с ядром все понятно – лишь малая часть атома, состоящая из протонов и нейтронов, то с электронами все сложнее.
В 1925 г. Шредингер сформулировал свое уравнение, названное в его честь. Оно позволяло проследить поведение электрона в атоме. Однако, в силу принципа неопределенности Гейзенберга (электрон обладает частично-волновым дуализмом) нельзя определить точное положение электрона и его скорость. Можно лишь говорить об области пространства, где электрон находится чаще. Так появился термин атомная орбиталь – это место, где вероятность нахождения электрона составляет больше 90%. Вот и получаем первое различие с изображениями из фильмов: там электроны вращаются вокруг ядра, оставляя следы в виде полосок. На деле электроны как бы расплываются вокруг ядра. Физик Бор сформулировал постулат о том, что электроны могут обладать определенным количеством энергии, а не произвольным. Так были введены квантовые числа:
- главное квантовое число (n, положительное целое число – 1, 2, 3…) характеризует энергетический уровень электрона и указывает число подуровней на уровне;
- орбитальное квантовое число (l, неотрицательное целое число – 0, 1, 2…) характеризует форму атомной орбитали, на которой находится электрон;
- магнитное квантовое число (ml, целое число от -l до +l) характеризует количество атомных орбиталей на энергетическом подуровне;
- спиновое квантовое число (ms, значения – либо -1/2, либо +1/2) характеризует вращение электрона относительно собственной оси.
У каждого электрона в атоме свой набор квантовых чисел, на основании которых можно оценить его энергию, по которой можно судить о его местоположении в атоме. В заполнении электронами атомных орбиталей участвуют некоторые закономерности. Одна из них – это запрет Паули. Он гласит о том, что в атоме не может быть двух электронов с одинаковыми наборами всех квантовых чисел, т. е. обладающих одинаковыми энергиями.
Немного об атомных орбиталях
Другое отличие реального атома от киношного изображения – это изображение атомных орбиталей. На картинках электроны движутся по окружностям. В реальности электроны не только расплываются, но и делают это по определенной области – орбитали. На каждой атомной орбитали может находится только 2 электрона. Всего различают 5 видов орбиталей в зависимости от значения орбитального квантового числа l:
- l = 0 – s-орбиталь;
- l = 1 – p-орбиталь;
- l = 2 – d-орбиталь;
- l = 3 – f-орбиталь;
- l = 4 – g-орбиталь.
s-орбиталь представляет собой симметричную относительно ядра сферу. Вероятность нахождения электрона на каждом участке орбитали одинакова. Всего на s-орбитали может располагаться два электрона.
s-орбиталь
p-орбиталь представляет собой форму гантели. Она направлена в трех разных направлениях – по координатным осям x, y и z и в совокупности они образуют энергетический подуровень.
p-орбитали, направленные по разным осям
d-, f- и g-орбитали имеют еще намного более сложные формы, чем p-орбиталь, поэтому их описание не представляется целесообразным.
Формы d-орбиталей, по-разному расположенных в пространстве
Каждое значение орбитального числа l является энергетическим подуровнем атома. Для каждого следующего энергетического уровня количество энергетических подуровней увеличивается и содержит в себе подуровни прошлых уровней. Звучит сложновато, да. Говоря проще, чем больше значение n, тем больше ему соответствует значений l. Попробуем на примере. Значение главного числа n задает основной энергетический уровень. Например: n=1, тогда l=0. Это значит, что на первом энергетическом уровне есть только один подуровень с одной s-орбиталью. Теперь пусть n=2. Это второй энергетический уровень. Для него l=0 и l=1. Это значит, что на нем два подуровня: на одном s-орбиталь, а на другом p-орбиталь. Для n=3 уже 3 подуровня и т. д. Такое заполнение электронами орбиталей является еще одной закономерностью, называемой правилом Клечковского. Правило Клечковского гласит о том, что электроны заполняют атомные орбитали так, чтобы их суммарная энергия была минимальна, т. е. начиная с меньших энергетических уровней.
Пример сопоставления энергетическим уровням (n) энергетических подуровней (l) и орбиталей
Теперь давайте поговорим о заполнении непосредственно орбиталей. Представим себе s-орбиталь: сфера вокруг ядра, на которой есть 2 электрона: спиновое число одного – 1/2, другого – -1/2. Теперь представим себе p-орбиталь в форме гантели. Три p-орбитали (направленные по координатным осям) образуют энергетический подуровень. Поскольку на каждой орбитали может быть по 2 электрона, то на таком подуровне может быть всего 6 электронов. Но как они его заполняют? Допустим, у нас есть 4 электрона. Заполняют ли они сначала одну орбиталь, затем другую, а третью оставляют нетронутой? Здесь на помощь приходит третья закономерность – правило Гунда. Оно гласит, что электроны при заполнении подуровней занимают максимальное число свободных орбиталей. Таким образом, сначала по один займет каждую орбиталь, а затем еще один займет полузаполненную орбиталь. Таким образом, две орбитали будут заполнены наполовину, а одна полностью.
Так устроен атом. Подведем итоги. В маленькой части атома, в центре, располагается атомное ядро, состоящее из протонов и нейтронов. Вокруг располагаются энергетические уровни с подуровнями, на которых находятся орбитали разной формы – места, где скорее всего находятся электроны в данный момент времени. Электроны заполняют орбитали в соответствии запретом Паули, правилом Клечковского и правилом Гунда.
Если Вам понравилась статья, подписывайтесь на канал и ставьте лайки!
Источник

Все в мире состоит из атомов. Но откуда они взялись, и из чего состоят сами? Сегодня отвечаем на эти простые и фундаментальные вопросы. Ведь многие люди, живущие на планете, говорят, что не понимают строения атомов, из которых сами и состоят.
Естественно, уважаемый читатель понимает, что в данной статье мы стараемся изложить все на максимально простом и интересном уровне, поэтому не «грузим» научными терминами. Тем, кто хочет изучить вопрос на более профессиональном уровне, советуем читать специализированную литературу. Тем не менее, сведения данной статьи могут сослужить хорошую службу в учебе и просто сделать Вас более эрудированными.
Атом – это частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, которая является носителем его свойств. Иными словами, это мельчайшая частица того или иного вещества, которая может вступать в химические реакции.
История открытия и строение
Понятия атома было известно еще в Древней Греции. Атомизм – физическая теория, которая гласит, что все материальные предметы состоят из неделимых частиц. Наряду с Древней Грецией, идеи атомизма параллельно развивался еще и в Древней Индии.
Не известно, рассказали тогдашним философам об атомах инопланетяне, или они додумались сами, но экспериментально подтвердить данную теорию химики смогли много позже – только в семнадцатом веке, когда Европа выплыла из пучины инквизиции и средневековья.
Долгое время господствующим представлением о строении атома было представление о нем как о неделимой частице. То, что атом все-таки можно разделить, выяснилось только в начале двадцатого века. Резерфорд, благодаря своему знаменитому опыту с отклонением альфа-частиц, узнал, что атом состоит из ядра, вокруг которого вращаются электроны. Была принята планетарная модель атома, в соответствии с которой электроны вращаются вокруг ядра, как планеты нашей Солнечной системы вокруг звезды.
 Планетарная модель
Планетарная модель
Современные представления о строении атома продвинулись далеко. Ядро атома, в свою очередь, состоит субатомных частиц, или нуклонов – протонов и нейтронов. Именно нуклоны составляют основную массу атома. При этом протоны и нейтроны также не являются неделимыми частицами, и состоят из фундаментальных частиц – кварков.
Ядро атома имеет положительный электрический заряд, а электроны, вращающиеся по орбите – отрицательный. Таким образом, атом электрически нейтрален.
Ниже приведем элементарную схему строения атома углерода.
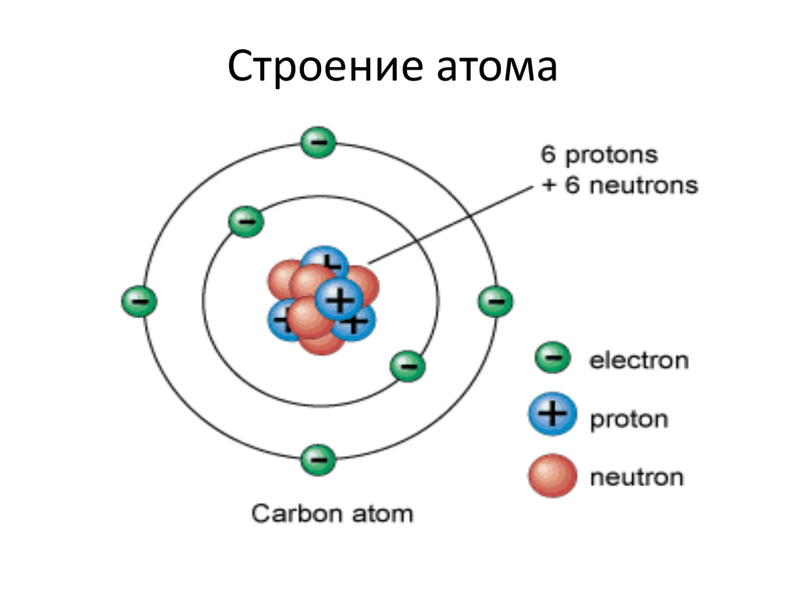 Схема строения атома
Схема строения атома
Свойства атомов
Масса
Массу атомов принято измерять в атомных единицах массы – а.е.м. Атомная единица массы представляет собой массу 1/12 части свободно покоящегося атома углерода, находящегося в основном состоянии.
В химии для измерения массы атомов используется понятие “моль”. 1 моль – это такое количество вещества, в котором содержится число атомов, равное числу Авогадро.
Размер
Размеры атомов чрезвычайно малы. Так, самый маленький атом – это атом Гелия, его радиус – 32 пикометра. Самый большой атом – атом цезия, имеющий радиус 225 пикометров. Приставка пико означает десять в минус двенадцатой степени! То есть , если 32 метра уменьшить в тысячу миллиардов раз, мы получим размер радиус атома гелия.
При этом, масштабы вещей таковы, что, по сути, атом на 99% состоит из пустоты. Ядро и электроны занимают крайне малую часть его объема. Для наглядности, рассмотрим такой пример. Если представить атом в виде олимпийского стадиона в Пекине (а можно и не в Пекине, просто представьте себе большой стадион), то ядро этого атома будет представлять собой вишенку, находящуюся в центре поля. Орбиты электронов при этом находились бы где-то на уровне верхних трибун, а вишня весила бы 30 миллионов тонн. Впечатляет, не так ли?
 Если предсавить атом в виде стадиона, ядро будет размером с вишню в центре поля
Если предсавить атом в виде стадиона, ядро будет размером с вишню в центре поля
Откуда взялись атомы?
Как известно, сейчас различные атомы сгруппированы в таблицу Менделеева. В ней насчитывается 118 (а если с предсказанными, но еще не открытыми элементами – 126) элементов, не считая изотопов. Но так было далеко не всегда.
В самом начале формирования Вселенной никаких атомов не было и подавно, существовали лишь элементарные частицы, под воздействием огромных температур взаимодействующие между собой. Как сказал бы поэт, это был настоящий апофеоз частиц. В первые три минуты существования Вселенной, из-за понижения температуры и совпадения еще целой кучи факторов, запустился процесс первичного нуклеосинтеза, когда из элементарных частиц появились первые элементы: водород, гелий, литий и дейтерий (тяжелый водород). Именно из этих элементов образовались первые звезды, в недрах которых проходили термоядерные реакции, в результате которых водород и гелий «сгорали», образуя более тяжелые элементы. Если звезда была достаточно большой, то свою жизнь она заканчивала так называемым взрывом «сверхновой», в результате которого атомы выбрасывались в окружающее пространство. Так и получилась вся таблица Менделеева.
 Вселенная
Вселенная
Так что, можно сказать, что все атомы, из которых мы состоим, когда-то были частью древних звезд.
Почему ядро атома не распадается?
В физике существует четыре типа фундаментальных взаимодействий между частицами и телами, которые они составляют. Это сильное, слабое, электромагнитное и гравитационное взаимодействия.
Именно благодаря сильному взаимодействию, которое проявляется в масштабах атомных ядер и отвечает за притяжение между нуклонами, атом и является таким «крепким орешком».
Не так давно люди поняли, что при расщеплении ядер атомов высвобождается огромная энергия. Деление тяжелых атомных ядер является источником энергии в ядерных реакторах и ядерном оружии.
 Ядерный взрыв
Ядерный взрыв
Итак, друзья, познакомив Вас со структурой и основами строения атома, нам остается только напомнить о том, что наши авторы готовы в любой момент прийти Вам на помощь. Не важно, нужно Вам выполнить диплом по ядерной физике, или самую маленькую контрольную – ситуации бывают разные, но выход есть из любого положения. Подумайте о масштабах Вселенной, закажите работу в Zaochnik и помните – нет поводов для беспокойства.
Источник
Атомы – основные единицы материи. Термин происходит от древнегреческого “неделимый”, потому что раньше считалось, что атомы являются наименьшими частицами во вселенной и не могут быть разделены. Но сейчас мы знаем, что атомы состоят из трех частиц – протонов, нейтронов и электронов, которые состоят из еще более меньших частиц, таких как кварки.
Атомы были сформированы после Большого Взрыва 13,7 миллиардов лет назад. Когда горячая и плотная новорожденная вселенная начала охлаждаться, то условия в ней стали подходящими для образования кварков и электронов. Кварки объединились для образования протонов и нейтронов, и эти частицы объединились в ядро. Согласно данным ЦЕРН, это произошло в течении первых нескольких минут существования Вселенной.
Потребовалось 380 000 лет, чтобы вселенная остыла настолько, чтобы электроны замедлились и ядра смогли захватить их. Так смогли образоваться первые атомы. Самые ранние атомы были в основном водородом и гелием, которые по-прежнему являются самыми распространенными элементами во вселенной. Благодаря гравитации облака газа слились и образовались звезды, а более тяжелые атомы как раз и создаются благодаря звездам и “посылаются” во вселенную после взрыва звезды.
Атомные частицы
Протоны и нейтроны тяжелее электронов и находятся в ядре в самом центре атома. Электроны чрезвычайно легкие и существуют в облаке, вращающимся вокруг ядра. Облако электронов имеет радиус в 10 000 раз больше ядра.
Протоны и нейтроны имеют примерно такую же массу. Однако один протон весит больше чем 1800 электронов. Атомы всегда имеют равное количество протонов и электронов, и количество протонов и нейтронов, как правило, то же самое. Добавление протона к атому создает новый элемент, в то время как добавление нейтрона создает изотоп или более тяжелую версию данного атома.
Ядро
Ядро атома было обнаружено в 1911 году Эрнестом Резерфордом, который в 1920 году предложил имя “протон” для положительно заряженных частиц атома. Резерфорд также предположил, что в ядре есть нейтральная частица, что подтвердил в 1932 году Джеймс Чадвик, британский физик и ученик Резерфорда.
Практически вся масса атома находится в ядре. Протоны и нейтроны, составляющие ядро, примерно одинаковой массы (протон немного меньше) и имеют одинаковый угловой момент.
Ядро удерживается благодаря “сильному взаимодействию” – одной из четырех основных сил в природе. Эта сила между протонами и нейтронами преодолевает отталкивающую электрическую силу, которая исходя из правил электричества, раздвигала бы протоны. Некоторые атомные ядра неустойчивы, потому что сила связи изменяется для разных атомов в зависимости от размера ядра. Затем атомы с неустойчивыми ядрами распадаютсяна другие элементы, такие как углерод-14, распадающийся на азот-14.
Протоны
Протоны – это положительно заряженные частицы, находящиеся внутри атомных ядер. Резерфорд обнаружил их в экспериментах с электронно-лучевыми трубами, проведенными между 1911 и 1919 годами. Протоны немного меньше по массе, чем нейтроны.
Число протонов в атоме определяет то, каким элементом он является. Например, атом углерода имеет шесть протонов, атом водорода – один, кислорода – восемь. Число протонов в атоме называется атомным номером этого элемента. Число протонов в атоме также определяет химическое поведение элемента. В периодической таблице Менделеева элементы упорядочены в порядке возрастания атомного номера.
Три кварка составляют каждый протон – два кварка с положительным зарядом и один с отрицательным. Они удерживаются вместе другими субатомными частицами, которые называются глюонами и являются безмассовыми.
Электроны
Электроны совсем крошечные – в 1800 раз меньше – по сравнению с протонами и нейтронами. Дж. Дж. Томсон, британский физик, обнаружил электрон в 1897 году. Электроны имеют отрицательный заряд и электрически притягиваются к положительно заряженным протонам. Электроны окружают атомное ядро, вращаясь по круговым орбиталям. Данная идея была выдвинута в 1920-х годах австрийским физиком Эрвином Шредингером. Сегодня эта модель известна как квантовая модель или модель электронного облака. Внутренние орбитали, окружающие атом, являются округлыми, но внешние орбитали гораздо сложнее.
Электронная конфигурация типичного атома представляет собой орбитальное описание расположения электронов. Используя электронную конфигурацию атома и принципы физики, химики могут предсказать свойства атома, такие как стабильность, точку кипения и проводимость. Как правило, в химии имеют значение только внешние электронные оболочки.
Нейтроны
Нейтрон используется в качестве сравнения, чтобы найти относительную массу протонов и электронов.
В 1920 году Резерфорд выдвинул теорию о существовании нейтрона. А в 1932 году Джеймс Чедвик уже обнаружил его. Тонкий лист бериллия был подвергнут бомбардировке атомами. Высвобожденные субатомные частицы без заряда оказались нейтронами.
Нейтроны – это незаряженные частицы, обнаруженные во всех атомных ядрах (за исключением водорода-1). Масса нейтрона намного больше массы протона. Подобно протонам, нейтроны также состоят из кварков – одного с положительным зарядом и двух с отрицательным.
Изотопы
Число нейтронов в ядре определяет изотоп этого элемента. Например, водород имеет три изотопа – протий, дейтерий и тритий. Протий, или 1Н, является обычным водородом – он имеет один протон и один электрон и не имеет нейтронов. Дейтерий (D или 2H) имеет один протон, один электрон и один нейтрон. Тритий (3Н или Т) имеет один протон, один электрон и два нейтрона.
История атома
Теория атома исходит от греческого ученого и философа Демокрита и датируется 440 г. до нашей эры. Скорее всего он построил свою теорию атома на работе прошлых философов. Например, Парменид, учитель Демокрита, известен тем, что предложил принцип идентичности. Этот принцип гласит, что все вместе образует бытие. Другие философы, включая Демокрита, продолжили его работу, что привело к созданию теории атома.
Демокрит
Объяснения атома Демокритом начинается с камня. Камень, поделенный пополам, дает две половины одного и того же камня. Если бы камень продолжали делить, то в какой-то момент появился бы кусок камня, настолько маленький, чтобы его нельзя было поделить. По мнению Демокрита, атом должен быть точкой, в которой любая форма материи больше не могла бы быть разделена. Его теория включала идеи о том, что атомы существуют отдельно друг от друга, что существует бесконечное количество атомов, способных двигаться и объединятся для создания материи, но не в коем случае не сливаться, создавая новый атом. Также он утверждал, что атом является неделимым. Однако, поскольку большинство философов того времени, особенно влиятельный Аристотель, считали, что вся материя была создана из земли, воздуха, огня и воды, теория атома Демокрита была надолго отложена в сторону.
Британский химик Джон Дальтон в 1803 году построил свою атомную теорию на идеях Демокрита. Теория Дальтона заключала в себя несколько идей Демокрита – то что атом неделимый и неразрушимый, что разные атомы собираются вместе, чтобы создать материю. Дополнения Дальтона к теории были в идеях, что все атомы определенного элемента идентичны, что атомы одного элемента имеют другой вес и другие свойства, нежели у атомов других элементов. Атомы не могут быть созданы и уничтожены и материя образуется атомами, объединяющимися в простые целые числа.
Джон Дальтон
В 1897 году британский физик Дж.Дж. Томсон открыл электрон. Тем самым он доказал, что на самом деле атомы могут быть разделены. Он смог определить существование отрицательно заряженных частиц, изучив свойства электрического разряда в электронно-лучевых трубках. В статье 1897 года Томсон писал, что лучи были отклонены в трубке, что доказывало то, что в вакуумной трубке есть что-то отрицательно заряженное. В 1899 году он опубликовал описание своей версии атома, широко известной как “пудинговая модель атома“. Модель атома Томсона включала в себя большое количество электронов, подвешенных в облаке положительного заряда, что обеспечивало электронейтральность атома. Электроны в этой модели располагались так, что напоминали изюм в британском десерте.
Дж.Дж. Томсон
Следующим ученым, который внес изменения и развил атомную модель, был Эрнест Резерфорд, который учился под руководством Томсона. В 1911 он опубликовал свою версию атома, которая включала положительно заряженное ядро, и отрицательно заряженные электроны вокруг него. Планетарная модель атома появилась после того, как Резерфорд с помощниками выпустил по тонкой фольге из золота альфа-частицы, состоящие из двух протонов и двух нейтронов, удерживаемых той же электростатической силой, которая связывает ядро любого атома.
Эрнест Резерфорд
Ученые заметили, что небольшой процент альфа-частиц был рассеян под очень большим углом к первоначальному направлению движения. Резерфорд смог ориентировочно вычислить размер ядра атома золота, обнаружив, что оно в 10 000 раз меньше, чем размер всего атома. При этом большая часть атома является пустым пространством. Модель атома Резерфорда по-прежнему остается базовой моделью, которая используется сегодня, несмотря на ее ограниченные возможности.
Несколько других ученых в последствии продвигали атомную модель. Нильс Бор продвигал теорию, построенную на модели Резерфорда, включив в нее свойства электронов на основе спектра водорода. Эрвин Шредингер разработал квантовую модель атома. Вернер Гейзенберг указал, что нельзя узнать одновременно положение и скорость электрона. А Мюррей Гелл-Манн и Джордж Цвейг, независимо друг от друга, разработали теорию о том, что протоны и нейтроны состоят из кварков.
Эрвин Шредингер
???? ???? ????
Источник
