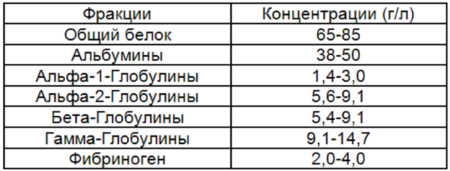
Какие белки содержаться в плазме крови

Состав белков в организме очень обширен и разнообразен. На сегодняшний день ученым удалось определить и идентифицировать более ста единиц. Причем большая их часть выделена в чистом виде и хорошо изучена. Простые белки крови, в состав которых входят альбумины, глобулины и фибриноген представлены в большом объеме, тогда как сложные – в маленьком количестве.
В зависимости от аминокислотного состава и физико-химических параметров выделяют белковые фракции, которые обладают специфическими характеристиками.
Чтобы повысить точность разделения на фракции, эту операцию рекомендуется проводить в электрическом поле при электрофорезе. Данная методика основывается на перемещении белковых молекул при воздействии электрического импульса с разной скоростью.
Термины: Электрофорез – это явление перемещения частиц, содержащихся в белковых расворах (крови в данном случае) под влиянием внешнего электрического поля.
Альбумины – самая большая фракция, которая способна удерживать воду, и на ее долю приходится около 85 % коллоидно-осмотического давления плазмы крови.
Снижение уровня альбуминов называется гипоальбуминемией. Причины такого рода патологии связаны с нехваткой белка в организме, проблемами с его синтезом, в том числе если человек соблюдает безбелковую диету. При этом отмечается понижение онкотического давления, следствием чего становится сильная отечность. Гидрофильность альбуминов значительно снижается по причине наличия в крови психотропных, наркотических, отравляющих веществ и алкоголя.
Глобулины делятся на два вида: альфа-1-глобулины и альфа-2-глобулины. Повышенная концентрация альфа-глобулинов обязательно сопровождает воспалительный процесс в организме, в том числе стрессовые ситуации, ожоги, травмы. Эти белковые компоненты позволяют определить, насколько интенсивно протекает воспалительное поражение организма. Они считаются белками острой фазы заболевания. Когда увеличивается концентрация альфа-2-глобулинов, чаще всего это свидетельствует о протекании гнойного процесса.
Белки плазмы крови и их функции
Функции белков плазмы крови следующие:
- Питательная.
В организме человека около трех литров крови. При этом одну шестую часть объема занимают белки. Этого хватает для реализации нормальной жизнедеятельности. Чаще всего клетки организма захватывают не столько белки, сколько аминокислоты (альбумины – их главный резерв). Хотя есть единицы, которые способны выполнять захват плазменного белка и расщеплять его посредством специальных ферментов. Далее высвободившееся количество аминокислот блуждает по кровотоку, где остальные клетки могут их использовать, чтобы в дальнейшем создавать новые белковые элементы.
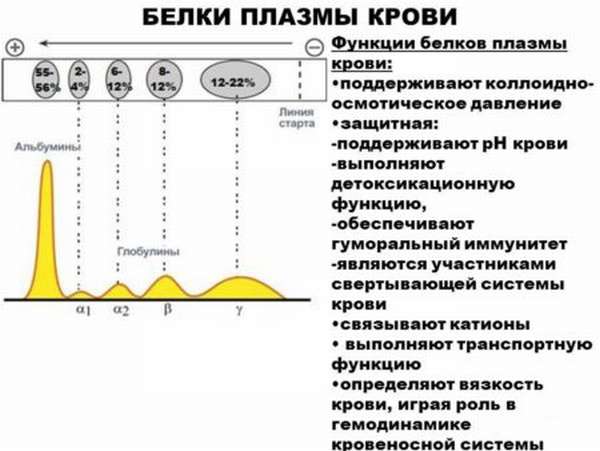
- Транспортная.
Некоторые молекулы при транспортировке их по кишечнику к месту назначения налаживают взаимосвязь со специфическими плазменными белковыми соединениями (гормоны, липиды, жирные кислоты и др.).
- Обеспечение коллоидно-осмотического давления
В виду того, что молекулярный объем белков невелик, говорить об их существенной роли для онкотического давления не стоит. Но если учесть то, что именно белковые вещества создают коллоидно-осмотическое давление, выполняя важную задачу в перераспределении воды между плазмой и межклеточной жидкостью, ситуация меняется кардинально.
Капиллярные элементы легко пропускают некрупные молекулы, поэтому их количество и создаваемое ими давление идентично в плазме и в межклеточной жидкости. Габаритным молекулам нужно потратить больше усилий, чтобы проникнуть внутрь клетки. Для альбумина это время составляет около пятнадцати часов. Более того, белковые соединения способны захватываться клетками и транспортироваться посредством лимфы крови. В связи с чем плазма и межклеточная жидкость устанавливают некий градиент их количества, что обязательно обуславливается различием в коллоидно-осмотическом давлении.
И если концентрация белковых элементов, содержащихся в плазме, меняется, может произойти нарушение нормального обмена веществ в организме и перераспределение воды между кровью и межклеточной жидкостью.
- Буферная.
Благодаря тому, что белки плазмы крови способны участвовать в различных процессах, вступая в связь с кислотами и щелочами, они играют важнейшую роль в поддержании нормального уровня pН.
- Предупреждение кровопотерь.
Белки обеспечивают работу свертывающей и противосвертывающей системы крови, рассасывание сгустков. Наша физиология установлена так, что свертываемость крови позволяет препятствовать кровотечению, частично обуславливаясь присутствием фибриногена. При этом свертывание представлено некоторой цепной реакцией. А без определенных ферментов и целой фракции белков плазмы здесь не обойтись. В завершение этого процесса фибриноген превращается в фибрин, образовывая сгусток. Он становится преградой для дальнейшего кровотечения.
- Защитная функция белкового компонента плазмы.
Благодаря иммуноглобулинам в плазме происходит нахождение и распознавание чужеродных антител, в том числе их дальнейшее уничтожение. Белковая фракция комплемента реализует удаление антигена. Фракция ингибиторов ферментов позволяет создать новые активные ферменты, воссоединяясь с ними. Примером тому становится защита тканей легкого при гидролизе.
Фракции белков
Белковые соединения крови, в зависимости от своего состава, подразделяются на простые и сложные. Примером первой фракции являются альбумины, а второй – липопротеины, металлопротеины и гликопротеины. Рассмотрим же основные из них:
- Альбумины – индивидуальные белки плазмы крови, синтез которых происходит в печени. Обновляются эти элементы стремительно. Буквально за двадцать четыре часа синтезируется и распадается около 15 грамм альбумина. Если рассматривать функциональное назначение данной фракции, то ее задачи различны. В первую очередь это поддержка онкотического давления, создание резерва аминокислот, транспортировка полезных веществ к месту назначения (органам и тканям), особенно тех, что не растворяются в воде.

- Альфа-1-глобулины – физиологические полезные белки плазмы крови, отличающиеся гидрофильностью и невысокой молекулярной массой. Как только происходит сбой в работе почек, они выводятся вместе с мочой, при этом не создавая какого-либо влияния на онкотическое давление. Белки плазмы крови из фракции глобулинов доставляют липиды в место назначения, помогают крови нормально свертываться, в том числе угнетают определенные ферменты, неблаготворно влияющие на организм,

- Альфа-2-глобулины стоит отнести к разряду высокомолекулярных белков. Их синтез происходит в печени. Эта фракция включает регуляторные вещества: а-макроглобулины, без участия которых невозможно протекание любого инфекционного или воспалительного процесса, гаптоглобулины – соединяясь с молекулами глобулина не дают выводиться железу из организма, церулоплазмины – задерживают медь в тканях.

- Бета-глобулины синтезируются в печени. При этом они участвуют в процессе свертываемости крови. Данная фракция включает липопротеины невысокой плотности, трансферрин, который позволяет доставить железо в место назначения, вещества системы комплемента, которые позволяют иммунной системе функционировать должным образом, бета-липоротеиды, траснпортирующие молекулы протеина.
- Гамма-глобулины синтезируются посредством В-лимфоцитов. Эти белки крови биохимия изучает крайне подробно. Ведь данная фракция содержит иммуноглобулины, а они защищают наш организм от инфекции и внешних опасностей.
Глобулины слабо растворяются в воде и составляют почти 50% от всей массы белков крови. Нарушения их соотношения сигнализируют о заболеваниях и патологических состояниях. При этом меняется и структура белков. Подробнее об этом можно узнать в разделе медицины под названием патофизиология. Определить такие нарушения можно после проведения биохимического анализа крови. Результаты такого рода исследования и динамическая их характеристика по совокупности позволят точно сказать, насколько долго протекает болезнь, и эффективно ли ее лечение.
Почему меняется соотношение белковых составов сыворотки крови?
Белки плазмы крови подробно изучает биохимия, но изменение их концентрации тоже касается биологических процессов. Именно об этом далее и пойдет речь.
Любые изменения в концентрации белковых элементов фракций в плазме свидетельствуют о том, что в организме произошел сбой. Могут проявляться признаки инфекционного и вирусного процесса. Синтез большого количества а-1-глобулинов – это сигнал того, что в организме протекает воспаление, есть опухолевые образования, произошло хирургическое вмешательство или нарушена функция печени. Однако женщины в положении на третьем триместре могут показать такие же результаты анализа.
С увеличением объема соединений альфа-2-глобулинов связаны ожоги, воспаления, диффузные изменения соединительной ткани.
Если увеличилось число гамма-глобулинов, значит, произошел хронический сбой в функционировании печени, любого рода инфицирование, развился ревматизм или же красная волчанка. Высокая концентрация фракции бета-глобулинов говорит о гиперлипопротеинемии, нехватке железа, желтухе или нефротическом синдроме. Возможная – физиологическая причина беременность.
Важно! Кроме патологий, вызывать изменение соотношения белковых компонентов фракций могут и лекарственные средства.
Белки плазмы участвуют в разнообразных жизненно важных процессах в организме человека. С помощью этих небольших элементов в клетки, органы и ткани поступает необходимое количество питательных веществ, обеспечивается нормальная свертываемость крови. Концентрация определенных фракций изменяется под влиянием инфекций и в результате нарушения работы внутренних органов. Чтобы определить соотношение белков, обязательно проводится биохимический анализ крови крови.
Характеристика белков плазмы крови для новорожденных
При рождении у ребенка концентрация белковых соединений в сыворотке крови существенно ниже, если сравнивать с параметрами взрослого человека. К окончанию первого месяца от рождения это значение падает до минимальной отметки, а еще через два месяца нормализуется до объема взрослого человека.
В течение первых недель жизни у новорожденного количество глобулинов низкое. Тогда как после месяца и до одного года концентрация таких белков может даже превышать показания взрослого.
Что касается фибриногена, то к окончанию первого месяца после рождения параметры данного белка нормализуются.
Повышение и понижение общего объема белка
Общий объем белка в плазме может повышаться (гиперпротеинемия) или понижаться (гипопротеинемия).
Главные причины нехватки белка:
- недостаточное поступление белков и аминокислот в организм,
- высокие потери белка (распад),
- проблемы с синтезом белков в печени и органах. отвечающих за иммунитет.
Дефицит поступления белка в организм возникает как следствие голодания на протяжении длительного времени, безбелкового диетического питания, нарушения нормального функционировании желудочно-кишечного тракта. Организм может потерять большое количество белка после сильных кровотечений, острых и хронических, вследствие развития злокачественных опухолей.
Ярко выраженная гипопротеинемия обязательно присутствует при патологических изменениях в почках и связывается с выводом из них большого количества белковых соединений.
Нарушения синтеза белка встречаются при недостаточности функции печени (цирроз).
Резкое превышение количества белка в плазме развивается после обезвоживания, когда организм теряет существенный объем внутрисосудистой жидкости. К примеру, такое состояние развивается после сильного перегревания тела, ожогов тяжелой степени, кишечных заболеваний (холера, дизентерия).
Вывод
Белки играют важную роль в организме человека, без их участия во множестве процессов ни один орган не смог бы работать. Поскольку белковых веществ существует огромное количество, их выделяют во фракции по функциям и физико-химическому составу. На долю каждой фракции возлагаются определенные задачи, и любое отклонение от количественной нормы таких элементов свидетельствует о развитии патологий. Главное – вовремя проходить медицинское обследование и при недомогании обратиться к врачу. Только своевременное выявление отклонений позволит успешно вылечить заболевание.
Загрузка…
Источник
Пла́зма кро́ви (от греч. πλάσμα — нечто сформированное, образованное) — жидкая часть крови, в которой взвешены форменные элементы. Процентное содержание плазмы в крови составляет 52—61 %. Макроскопически представляет собой однородную несколько мутную (иногда почти прозрачную) желтоватую жидкость, собирающуюся в верхней части сосуда с кровью после осаждения форменных элементов. Гистологически плазма является межклеточным веществом жидкой ткани крови.
Белки плазмы крови
Основную массу растворимых нелетучих веществ плазмы крови образуют белки. Их концентрация лежит в пределах 60-80 г/л; они составляют примерно 4% всех белков организма.
А. Белки плазмы крови
В плазме крови человека содержится около 100 различных белков. По подвижности при электрофорезе (см. ниже) их можно грубо разделить на пять фракций: альбумин, α1-, α2-, β- и γ-глобулины. Разделение на альбумин и глобулин первоначально основывалось на различии в растворимости: альбумины растворимы в чистой воде, а глобулины — только в присутствии солей.
В среди белков плазмы наиболее представлен альбумин, который играет роль в поддержании коллоидно-осмотического давления в крови и служит для организма важным резервом аминокислот. Альбумин обладает способностью связывать липофильные вещества, вследствие чего он может функционировать в качестве белка-переносчика длинноцепочечных жирных кислот, билирубина, лекарственных веществ, некоторых стероидных гормонов и витаминов. Кроме того, альбумин связывает ионы Са2+ и Mg2+.
белки глобулинов участвуют в транспорте липидов, гормонов, витаминов и ионов металлов, они образуют важные компоненты системы свертывания крови; фракция γ-глобулинов содержит антитела иммунной системы.
Образование и разрушение. Большинство белков плазмы синтезируется в клетках печени. Исключение составляют иммуноглобулины, которые продуцируются плазматическими клетками иммунной системы, и пептидные гормоны, секретируемые клетками эндокринных желез.
Кроме альбумина почти все белки плазмы являются гликопротеинами.Они включают олигосахариды, присоединенные к аминокислотным остаткам N- и О-гликозидными связями. на поверхности белка оказываются концевые остатки галактозы. Остатки галактозы узнаются и связываются рецепторами галактозы. В печени эти «состарившиеся» белки плазмы удаляются путем эндоцитоза. Таким образом, олигосахариды на поверхности белка определяют время жизни белков плазмы, полупериод выведения (биохимический полупериод) которых составляет от нескольких дней до нескольких недель.
В здоровом организме концентрация белков плазмы поддерживается на постоянном уровне. Однако их концентрация изменяется при заболевании органов, участвующих в синтезе и катаболизме этих белков.
1. Белки поддерживают коллоидно-осмотическое (онкотическое) давление и тем самым постоянный объем крови.
2. Белки плазмы принимают активное участие в свертывании крови. Ряд белков, в том числе фибриноген, являются основными компонентами системы свертывания крови.
3. Белки плазмы в известной мере определяют вязкость крови, которая, как отмечалось, в 4–5 раз выше вязкости воды и играет важную роль в поддержании гемодинамических отношений в кровеносной системе.
4. Белки плазмы принимают участие в поддержании постоянного рН крови, так как составляют одну из важнейшихбуферных систем крови.
5. Важна также транспортная функция белков плазмы крови: соединяясь с рядом веществ (холестерин, билирубин и др.), а также с лекарственными средствами (пенициллин, салицилаты и др.), они переносят их к тканям.
6. Белки плазмы играют важную роль в процессах иммунитета (особенно это касается иммуноглобулинов).
7. В результате образования с белками плазмы недиализируемых комплексов поддерживается уровень катионов в крови. Например, 40–50% кальция сыворотки связано с белками, значительная часть железа, магния, меди и других элементов также связана с белками сыворотки.
8. Наконец, белки плазмы крови могут служить резервом аминокислот. Современные физико-химические методы позволили открыть и описать около 100 различных белковых компонентов плазмы крови. Особое значение приобрело электрофоретическое разделение белков плазмы (сыворотки) крови.
Источник
Тема 1. БИОЛОГИЧЕСКАЯ РОЛЬ БЕЛКОВЫХ И НЕБЕЛКОВЫХ КОМПОНЕНТОВ ПЛАЗМЫ КРОВИ.
Практическая значимость темы. Кровь является важнейшим и наиболее доступным объектом биохимического исследования. Наиболее изученные компоненты крови – это гемоглобин, альбумин, иммуноглобулины и разнообразные факторы свёртывания. При различных заболеваниях наблюдаются изменения уровня белков в плазме; эти изменения можно обнаружить при электрофорезе. Важным диагностическим признаком при некоторых патологических состояниях служит повышение активности некоторых ферментов плазмы крови. Определение содержания небелковых компонентов плазмы (глюкоза, мочевина, холестерол, билирубин и др.) также используется в диагностике заболеваний.
Цель занятия. После изучения данной темы студент должен знать состав и биологическую роль различных групп белков, небелковых азотистых компонентов (остаточного азота), безазотистых органических соединений и минеральных веществ, входящих в состав плазмы крови; уметь применять полученные знания при решении теоретических и практических задач.
Исходный уровень знаний.
- Строение и биологические функции аминокислот и белков, жирных кислот и липидов, моно- и полисахаридов.
- Участие минеральных веществ в процессах жизнедеятельности.
- Кислотно-основные свойства биологических макромолекул.
- Гидрофильные и гидрофобные свойства биологических макромолекул.
- Механизмы регуляции активности ферментов.
Общая характеристика.
Кровь – жидкая подвижная ткань, циркулирующая в замкнутой системе кровеносных сосудов, транспортирующая различные химические вещества к органам и тканям, и осуществляющая интеграцию метаболических процессов, протекающих в различных клетках.
Кровь состоит из плазмы и форменных элементов (эритроцитов, лейкоцитов и тромбоцитов). Сыворотка крови отличается от плазмы отсутствием фибриногена. 90% плазмы крови составляет вода, 10% – сухой остаток, в состав которого входят белки, небелковые азотистые компоненты (остаточный азот), безазотистые органические компоненты и минеральные вещества.
Белки плазмы крови.
Плазма крови содержит сложную многокомпонентную (более 100) смесь белков, различающихся по происхождению и функциям. Большинство белков плазмы синтезируется в печени. Иммуноглобулины и ряд других защитных белков иммунокомпетентными клетками.
Содержание общего белка в сыворотке крови здорового человека составляет 65 – 85 г/л (в плазме крови этот показатель на 2 – 4 г/л выше за счёт фибриногена).
1.2.1. Белковые фракции. При помощи высаливания белков плазмы можно выделить альбуминовую и глобулиновую фракции. В норме соотношение этих фракций составляет 1,5 – 2,5. Использование метода электрофореза на бумаге позволяет выявить 5 белковых фракций (в порядке убывания скорости миграции): альбумины, α1-, α2-, β- и γ-глобулины. При использовании более тонких методов фракционирования в каждой фракции, кроме альбуминовой, можно выделить целый ряд белков (содержание и состав белковых фракций сыворотки крови см. рисунок 1).
Рисунок 1. Электрофореграмма белков сыворотки крови и состав белковых фракций.
Альбумины – белки с молекулярной массой около 70000 Да. Благодаря гидрофильности и высокому содержанию в плазме играют важную роль в поддержании коллоидно-осмотического (онкотического) давления крови и регуляции обмена жидкостей между кровью и тканями. Выполняют транспортную функцию: осуществляют перенос свободных жирных кислот, желчных пигментов, стероидных гормонов, ионов Са2+, многих лекарств. Альбумины также служат богатым и быстро реализуемым резервом аминокислот.
α1-Глобулины:
- Кислый α1-гликопротеин (орозомукоид) – содержит до 40% углеводов, изоэлектрическая точка его находится в кислой среде (2,7). Функция этого белка до конца не установлена; известно, что на ранних стадиях воспалительного процесса орозомукоид способствует образованию коллагеновых волокон в очаге воспаления (Я.Мусил, 1985).
- α1-Антитрипсин – ингибитор ряда протеаз (трипсина, химотрипсина, калликреина, плазмина). Врождённое снижение содержания α1-антитрипсина в крови может быть фактором предрасположенности к бронхо-лёгочным заболеваниям, так как эластические волокна лёгочной ткани особенно чувствительны к действию протеолитических ферментов.
- Ретинолсвязывающий белок осуществляет транспорт жирорастворимого витамина А.
- Тироксинсвязывающий белок – связывает и транспортирует иодсодержащие гормоны щитовидной железы.
- Транскортин – связывает и транспортирует глюкокортикоидные го рмоны (кортизол, кортикостерон).
α2-Глобулины:
- Гаптоглобины (25% α2-глобулинов) – образуют стабильный комплекс с гемоглобином, появляющимся в плазме в результате внутрисосудистого гемолиза эритроцитов. Комплексы гаптоглобин-гемоглобин поглощаются клетками РЭС, где гем и белковые цепи подвергаются распаду, а железо повторно используется для синтеза гемоглобина. Тем самым предотвращается потеря железа организмом и повреждение почек гемоглобином.
- Церулоплазмин – белок, содержащий ионы меди (одна молекула церулоплазмина содержит 6-8 ионов Cu2+), которые придают ему голубую окраску. Является транспортной формой ионов меди в организме. Обладает оксидазной активностью: окисляет Fe2+ в Fe3+, что обеспечивает связывание железа трансферрином. Способен окислять ароматическиеамины, участвует в обмене адреналина, норадреналина, серотонина.
β-Глобулины:
- Трансферрин – главный белок β-глобулиновой фракции, участвует в связывании и транспорте трёхвалентного железа в различные ткани, особенно в кроветворные. Трансферрин регулирует содержание Fe3+ в крови, предотвращает избыточное накопление и потерю с мочой.
- Гемопексин – связывает гем и предотвращает его потерю почками. Комплекс гем-гемопексин улавливается из крови печенью.
- С-реактивный белок (С-РБ) – белок, способный преципитировать (в присутствии Са2+) С-полисахарид клеточной стенки пневмококка. Биологическая роль его определяется способностью активировать фагоцитоз и ингибировать процесс агрегации тромбоцитов. У здоровых людей концентрация С-РБ в плазме ничтожно мала и стандартными методами не определяется. При остром воспалительном процессе она увеличивается более чем в 20 раз, в этом случае С-РБ обнаруживается в крови. Исследование С-РБ имеет преимущество перед другими маркерами воспалительного процесса: определением СОЭ и подсчётом числа лейкоцитов. Данный показатель более чувствителен, его увеличение происходит раньше и после выздоровления быстрее возвращается к норме.
γ-Глобулины:
- Иммуноглобулины (IgA, IgG, IgM, IgD, IgE) представляют собой антитела, вырабатываемые организмом в ответ на введение чужеродных веществ с антигенной активностью. Подробнее об этих белках см. 1.2.5.
1.2.2. Количественные и качественные изменения белкового состава плазмы крови. При различных патологических состояниях белковый состав плазмы крови может изменяться. Основными видами изменений являются:
- Гиперпротеинемия – увеличение содержания общего белка плазмы. Причины: потеря большого количества воды (рвота, диарея, обширные ожоги), инфекционные заболевания (за счёт увеличения количества γ-глобулинов).
- Гипопротеинемия – уменьшение содержания общего белка в плазме. Наблюдается при заболеваниях печени (вследствие нарушения синтеза белков), при заболеваниях почек (вследствие потери белков с мочой), при голодании (вследствие недостатка аминокислот для синтеза белков).
- Диспротеинемия – изменение процентного соотношения белковых фракций при нормальном содержании общего белка в плазме крови, например, снижение содержания альбуминов и увеличение содержания одной или нескольких глобулиновых фракций при различных воспалительных заболеваниях.
- Парапротеинемия – появление в плазме крови патологических иммуноглобулинов – парапротеинов, отличающихся от нормальных белков по физико-химическим свойствам и биологической активности. К таким белкам относятся, например, криоглобулины, образующие друг с другом преципитаты при температуре ниже 37° С. Парапротеины обнаруживаются в крови при макроглобулинемии Вальденстрема, при миеломной болезни (в последнем случае они могут преодолевать почечный барьер и обнаруживаться в моче как белки Бенс-Джонса). Парапротеинемия, как правило, сопровождается гиперпротеинемией.
1.2.3. Липопротеиновые фракции плазмы крови. Липопротеины – сложные соединения, осуществляющие транспорт липидов в крови. В состав их входят: гидрофобное ядро, содержащее триацилглицеролы и эфиры холестерола, и амфифильная оболочка, образованная фосфолипидами, свободным холестеролом и белками-апопротеинами (рисунок 2). В плазме крови человека содержатся следующие фракции липопротеинов:
Рисунок 2. Схема строения липопротеина плазмы крови.
- Липопротеины высокой плотности или α-липопротеины, так как при электрофорезе на бумаге они движутся вместе с α-глобулинами. Содержат много белков и фосфолипидов, транспортируют холестерол из периферических тканей в печень.
- Липопротеины низкой плотности или β-липопротеины, так как при электрофорезе на бумаге они движутся вместе с β-глобулинами. Богаты холестеролом; транспортируют его из печени в периферические ткани.
- Липопротеины очень низкой плотности или пре-β-липопротеины (на электрофореграмме расположены между α- и β-глобулинами). Служат транспортной формой эндогенных триацилглицеролов, являются предшественниками липопротеинов низкой плотности.
- Хиломикроны – электрофоретически неподвижны; в крови, взятой натощак, отсутствуют. Являются транспортной формой экзогенных (пищевых) триацилглицеролов.
1.2.4. Белки острой фазы воспаления. Это белки, содержание которых увеличивается в плазме крови при остром воспалительном процессе. К ним относятся, например, следующие белки:
- гаптоглобин;
- церулоплазмин;
- С-реактивный белок;
- α1-антитрипсин;
- фибриноген (компонент свёртывающей системы крови; см. 2.2.2).
Скорость синтеза этих белков увеличивается прежде всего за счёт снижения образования альбуминов, трансферрина и альбуминов (небольшая фракция белков плазмы, обладающая наибольшей подвижностью при диск-электрофорезе, и которой соответствует полоса на электрофореграмме перед альбуминами), концентрация которых при остром воспалении снижается.
Биологическая роль белков острой фазы: а) все эти белки являются ингибиторами ферментов, освобождаемых при разрушении клеток, и предупреждают вторичное повреждение тканей; б) эти белки обладают иммунодепрессорным действием (В.Л.Доценко, 1985).
1.2.5. Защитные белки плазмы крови. К белкам, выполняющим защитную функцию, относятся иммуноглобулины и интерфероны.
Иммуноглобулины (антитела) – группа белков, вырабатываемых в ответ на попадание в организм чужеродных структур (антигенов). Они синтезируются в лимфоузлах и селезёнке лимфоцитами В. Выделяют 5 классов иммуноглобулинов – IgA, IgG, IgM, IgD, IgE.
Рисунок 3.Схема строения иммуноглобулинов (серым цветом показана вариабельная область, не закрашена – константная область).
Молекулы иммуноглобулинов имеют единый план строения. Структурную единицу иммуноглобулина (мономер) образуют четыре полипептидные цепи, соединённые между собой дисульфидными связями: две тяжёлые (цепи Н) и две лёгкие (цепи L) (см. рисунок 3). IgG, IgD и IgЕ по своей структуре, как правило, являются мономерами, молекулы IgM построены из пяти мономеров, IgA состоят из двух и более структурных единиц, или являются мономерами.
Белковые цепи, входящие в состав иммуноглобулинов, можно условно разделить на специфические домены, или области, имеющие определённые структурные и функциональные особенности.
N-концевые участки как L-, так и Н-цепей называются вариабельной областью (V), так как их структура характеризуется существенными различиями у разных классов антител. Внутри вариабельного домена имеются 3 гипервариабельных участка, отличающихся наибольшим разнообразием аминокислотной последовательности. Именно вариабельная область антител ответственна за связывание антигенов по принципу комплементарности; первичная структура белковых цепей в этой области определяет специфичность антител.
С-концевые домены Н- и L-цепей обладают относительно постоянной первичной структурой в пределах каждого класса антител и называются константной областью (С). Константная область определяет свойства различных классов иммуноглобулинов, их распределение в организме, может принимать участие в запуске механизмов, вызывающих уничтожение антигенов.
Интерфероны – семейство белков, синтезируемых клетками организма в ответ на вирусную инфекцию и обладающих противовирусным эффектом. Различают несколько типов интерферонов, обладающих специфическим спектром действия: лейкоцитарный (α-интерферон), фибробластный (β-интерферон) и& иммунный (γ-интерферон). Интерфероны синтезируются и секретируются одними клетками и проявляют свой эффект, воздействуя на другие клетки, в этом отношении они подобны гормонам. Механизм действия интерферонов показан на рисунке 4.
Рисунок 4.Механизм действия интерферонов (Ю.А.Овчинников, 1987).
Связываясь с клеточными рецепторами, интерфероны индуцируют синтез двух ферментов — 2′,5′-олигоаденилатсинтетазы и протеинкиназы, вероятно, за счет инициации транскрипции соответствующих генов. Оба образующихся фермента проявляют свою активность в присутствии двухцепочечных РНК, а именно такие РНК являются продуктами репликации многих вирусов или содержатся в их вирионах. Первый фермент синтезирует 2′,5′-олигоаденилаты (из АТФ), которые активируют клеточную рибонуклеазу I; второй фермент фосфорилирует фактор инициации трансляции IF2. Конечным результатом этих процессов является ингибирование биосинтеза белка и размножения вируса в инфицированной клетке (Ю.А.Овчинников, 1987).
1.2.6. Ферменты плазмы крови. Все ферменты, содержащиеся в плазме крови, можно разделить на три группы:
- секреторные ферменты – синтезируются в печени, выделяются в кровь, где выполняют свою функцию (например, факторы свёртывания крови);
- экскреторные ферменты – синтезируются в печени, в норме выделяются с желчью (например, щелочная фосфатаза), их содержание и активность в плазме крови возрастает при нарушении оттока желчи;
- индикаторные ферменты – синтезируются в различных тканях и попадают в кровь при разрушении клеток этих тканей. В разных клетках преобладают различные ферменты, поэтому при повреждении того или иного органа в крови появляются характерные для него ферменты. Это может быть использовано в диагностике заболеваний.
Например, при повреждении клеток печени (гепатит) в крови возрастает активность аланинаминотраноферазы (АЛТ), аспартатаминотрансферазы (ACT), изофермента лактатдегидрогеназы ЛДГ5, глутаматдегидрогеназы, орнитинкарбамоилтрансферазы.
При повреждении клеток миокарда (инфаркт) в крови возрастает активность аспартатаминотрансферазы (ACT), иэофермента лактатдегидрогеназы ЛДГ1, изофермента креатинкиназы MB.
При повреждении клеток поджелудочной железы (панкреатит) в крови возрастает активность трипсина, α-амилазы, липазы.
Источник
