Какие аномальные свойства воды

Аномальные свойства воды до сих пор являются для академической науки загадкой …
Что такое аномальные свойства воды …
Целый ряд свойств воды выпадает из общих закономерностей и правил таких наук как физика и химия. Эти свойства не соответствуют законам «периодической системы», разработанной гениальным ученым-химиком Дмитрием Ивановичем Менделеевым.
Про общие физические и химические свойства воды, мы писали в нашем материале – ХИМИЧЕСКИЕ И ФИЗИЧЕСКИЕ СВОЙСТВА ВОДЫ В ЖИДКОМ СОСТОЯНИИ ( читать >>> ).
Аномальные свойства воды
В этом материале, мы кратко перечислим основные аномальные свойства воды.
Замерзание и кипение
Температуры замерзания и кипения воды не соответствуют общим закономерностям и законам химии. Так мы знаем, что вода в реальной жизни замерзает при 0°C, а кипит при 100°C, в то время как в соответствии с общими правилами химии эти процессы должны проходить при -90°C (минус девяносто) и -70°C (минус 70) соответственно.
Уникальные термические свойства воды
Вода имеет уникальную по своей величине аномальную теплоемкость равную 4,18 кДж (кг-К). Это означает, что вода медленно охлаждается и медленно нагревается.
Вода является эффективным регулятором температур, она ограничивает резкие перепады температур. Более подробно с этим ее свойством вы можете ознакомиться в нашей статье – Удельная теплоемкость воды, или почему мы такие, какие есть.
Температурная яма
Наибольшая скорость нагрева и охлаждения воды происходит в так называемой «температурной яме», которая образуется вследствие того, что в районе 37 °C теплоемкость у воды наименьшая.
Как мы видим, температура человеческого тела 36,6 °C близка к этому значению.
Эффект Мпембы – эффект горячей воды
Удивительно, но факт – горячая вода замерзает быстрее холодной, что противоречит логике и общему восприятию вещей.
Температура воды + 3,98 °C
Как мы уже отметили выше, температура + 3,98 °C, является для воды важным значением. При понижении температуры до этого уровня вода ведет себя в соответствии с общими законами и правилами этих наук. При дальнейшем понижении температуры у воды начинают проявляются ее аномальные свойства.
При температуре + 3,98 °C у воды плотность имеет наибольшее значение, а объем наименьший.
Объем и плотность
Еще одним важным для всех нас является ее аномальное свойство при замерзании увеличиваться в объеме, тем самым уменьшая свою плотность. Уточним, что до + 3,98 °C вода ведет в соответствии с общими законами химии и физики, а далее проявляются ее аномальные свойства.
Поверхностное натяжение
Еще одним удивительным и во многом аномальным свойством воды является ее поверхностное натяжение.
Хорошо всем известный пример демонстрирует, как аккуратно положенная на воду металлическая швейная игла плавает на ее поверхности, что во многом удивительно. Ведь плотность метала гораздо больше плотности воды.
Вся жизнь на Земле своим существованием во многом обязано именно этому свойству воды.
Вода — отличный растворитель
Вода является отличным растворителем, она удивительно легко растворяет большое количество самых разнообразных веществ и газов. И что тоже весьма важно, так же легко их отдает. Например, благодаря именно этому свойству после дождя мы чувствуем удивительную свежесть – дождь очищает воздух.
Вода и магнитное поле
Под воздействием магнитного поля у воды меняется ее способность к растворению веществ, изменяется скорость, проходящих в ней, химических реакций.
Заключение
Аномальные свойства воды еще раз подтверждают общеизвестное высказывание — удивительное рядом.
Аномальные свойства воды, или удивительное рядом
2015-09-22
Автор: Waterman
Источник
Люди привыкли к воде и считают ее обычным веществом. Они часто воспринимают ее как нечто само собой разумеющееся до тех пор, пока засуха не начнет угрожать посевам и запасам питьевой воды, или сильное наводнение не создаст угрозу жизни и имуществу. Многие не осознают, что структура воды и ее аномальные свойства обеспечивают существование жизни на Земле.
Один из ранних греческих философов, Фалес Милетский (640-546 гг. до н. э.), исследовал универсальный характер воды. Он считал ее основным элементом, из которого рождается все. Обилие воды было очевидным, но Фалес заметил, что она является единственным веществом, естественным образом присутствующим на Земле одновременно в трех разных состояниях: твердом, жидком и газообразном. В холодный зимний день снег и лед покрывают поля, рядом течет река, а над головой плывут облака.
Формы материи
Все вещества существуют в трех различных состояниях, которые зависят от температуры и давления. Твердые тела обладают определенной формой и имеют кристаллическую внутреннюю структуру. По этому определению вещество, подобное стеклу, будет считаться высоковязкой жидкостью, поскольку оно не обладает кристаллическим строением. Твердые тела склонны противостоять внешним воздействием. Они могут быть преобразованы в жидкость путем нагрева. Температура замерзания воды при давлении в 1 атмосферу равна 0 °С, ниже которой она существует в виде льда.
Жидкость, в отличие от твердого тела, не обладает твердостью и не имеет определенной формы. У нее есть объем, и она принимает форму сосуда, в котором хранится. Внешнее воздействие вынуждает ее течь. Вода представляет собой жидкость между температурами замерзания и кипения (100 °С). Жидкости могут переходить в газообразную фазу при нагреве выше точки кипения.
Газ не имеет ни формы, ни определенного объема. Он принимает форму и занимает объем сосуда, в котором находится. Газ расширяется и сжимается с изменением температуры и давления и способен легко диффундировать в другие газы.

Точки кипения и замерзания
Аномальными свойствами воды являются ее необычно высокие температуры кипения и замерзания по сравнению с другими соединениями с аналогичной молекулярной структурой. Другие подобные вещества в обычных условиях являются газами. Ожидается, что вода с ее более низкой молекулярной массой, чем аналогичные соединения, должна иметь более низкие температуры кипения и замерзания. Однако из-за полярной природы ее молекулы и водородных связей температура ее кипения равна 100 °C, а замерзания – 0 °C. Для сравнения, соответствующие значения у сероводорода H2S равны -60 °C и -84 °C, у селеноводорода H2Se этот показатель составляет -42 °C и -64 °C и у теллуроводорода -2 °C и -49 °C.
Твердая фаза
Как правило, с понижением температуры вещества становятся более плотными, и вода не является исключением. Ее плотность при 25 °C составляет 0,997 г/мл и увеличивается с до максимальной (1 г/мл) при T = 4 °C. В метрической системе измерения килограмм определяется как масса 1 л воды с максимальной плотностью. Между 4 °C и точкой замерзания 0 °C происходит удивительная вещь, которая наблюдается у очень небольшого числа веществ. Вода постепенно расширяется, становясь менее плотной. Плотность льда при 0 °C составляет около 0,917 г/мл. Молекулы воды образуют кристаллы в форме тетраэдра (четырехсторонней фигуры, каждая грань которой представляет собой равносторонний треугольник). Поскольку плотность твердой фазы меньше, чем жидкой, лед плавает. При замораживании объем воды увеличивается на 1%.
Очень важно, что лед расширяется и плавает на поверхности. Из-за этого зимой лопаются водопроводы и появляются выбоины на дорогах. Замерзание и таяние воды в значительной степени ответственно за разрушение скал и образование почв. Кроме того, если бы озера и потоки замерзали снизу вверх, то водная жизнь вообще перестала бы существовать, а климатические и погодные условия резко изменились.

Теплоемкость
Еще одним аномальным свойством воды является ее чрезвычайно высокая способность поглощать тепло без значительного повышения температуры. Например, летнее солнце на пляже нагревает песок до такой степени, что становится невозможно по нему ходить. Вода при этом остается прохладной. Оба вещества поглощают равное количество тепловой энергии, но температура песка выше. Пустой железный котелок, висящий над огнем, быстро раскалится докрасна, но если он заполнен водой, то его нагрев происходит постепенно. Высокая теплоемкость воды делает ее хорошей охлаждающей жидкостью в конденсаторах и автомобильных радиаторах, предотвращающих двигатели от перегрева. Ее значение в 5 раз превышает теплоемкость песка и примерно в 10 раз – железа.
Умеренный климат в прибрежных районах является результатом поглощения в течение дня огромного количества солнечной тепловой энергии водой и медленного высвобождения ее ночью. Внутренние районы вдали от побережья обычно испытывают гораздо более высокие экстремальные температуры. Огромные океаны на Земле (около 75% площади поверхности) отвечают за смягчение климата на нашей планете, поддерживая существование жизни.
Теплота плавления и испарения
С теплоемкостью связана теплота фазового перехода. Это количество тепловой энергии, поглощаемой или высвобождаемой веществом, которое изменяется в фазе (от жидкого до твердого состояния, или наоборот, и от жидкого до газообразного, или наоборот) без изменения температуры. Необычайно высокие значения удельной теплоты плавления (332,4 кДж/кг) и испарения (2256,2 кДж/кг) – очередные аномальные физические свойства воды. При замерзании выделяется такое же количество тепла, которое поглощается в процессе плавления.

Практическим примером использования удельной теплоты плавления воды является использование льда для охлаждения напитков в изолированном кулере. В процессе таяния лед поглощает тепловую энергию напитков, сохраняя их прохладными. Емкость с водой в теплице в холодную зимнюю ночь смягчит температуру в помещении из-за тепла, выделяемого при замерзании. Конденсация пара высвобождает то же количество тепла, которое поглощается в процессе испарения. Удельная теплота испарения в 5 раз превышает теплоту, необходимую для повышения температуры от 0 до 100 °C. Аномальное свойство воды хранить большое количество накопленной тепловой энергии делает паровое отопление эффективным. В процессе конденсации пар высвобождает накопленную тепловую энергию. Дневная гроза в жаркий летний день – еще один пример высвобождения тепловой энергии в верхних слоях атмосферы при конденсации горячего влажного воздуха. Даже ураган является примером влияния перераспределения огромного количества тепловой энергии, поглощенной тропическими океанами.
Системы испарительного охлаждения работают наоборот. Вода в процессе испарения поглощает тепловую энергию из воздуха, охлаждая его.
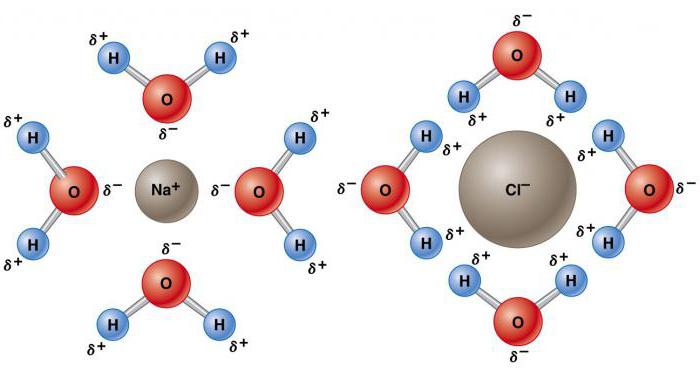
Универсальный растворитель
Растворитель способен растворять другое вещество с образованием гомогенной смеси (раствора) на молекулярном уровне. Еще одним аномальным свойством воды в химии благодаря ее полярной природе является ее способность растворять другие полярные соединения – соли, спирты, карбоксильные соединения и т. д. В воде растворяется больше веществ, чем в любом другом растворителе. В ней можно найти более половины известных химических элементов, некоторые в высоких концентрациях, а другие – только в следовых количествах. Например, концентрация насыщения хлорида натрия составляет около 36 г на 100 мл, а карбоната кальция – около 0,0015 г. Способность воды растворять вещество зависит от его химического состава, силы химических связей элементов, температуры и рН.
Неполярные соединения, в том числе большинство углеводородов, растворяются в низких или следовых количествах. Например, масла, как правило, плавают на поверхности воды.

Поверхностное натяжение
К аномальным свойствам воды относят и ее самое высокое (после ртути) поверхностное натяжение по сравнению с любой другой жидкостью. Это сила притяжения молекул, расположенных под поверхностью и тех, которые находятся на границе раздела жидкость-воздух. Она удерживает воду от растекания. Полярные соединения, как правило, имеют гораздо более высокое поверхностное натяжение, чем неполярные. И вода не является исключением. При 20 °С данный показатель равен 0,07286 Н/м (у этилового спирта – 0,0228 Н/м).
Без внешнего воздействия капля H2O принимает форму сферы, поскольку эта фигура обладает наименьшей площадью поверхности на единицу объема. Капли дождя являются крошечными пулями, которые при длительном воздействии разрушают горные породы. По этой же причине объекты, более тяжелые, чем вода, могут удерживаться на ее поверхности. Насекомые способны ходить по ней, а лезвие бритвы – плавать.
Водородная связь определяет аномальное свойство воды смачивать большинство поверхностей. Такие вещества считаются гидрофильными. Вода способна подниматься по стенкам стакана и других емкостей. Другие вещества, такие как масла, жиры, воск и синтетика (полипропилен и т. д.), не намокают. Они являются гидрофобными. Мембранные фильтровальные картриджи с размером пор менее 1 мкм изготавливают из гидрофобных полимеров с помощью смачивающих агентов, снижающих поверхностное натяжение воды, чтобы последняя могла проникнуть и оставаться в них. Это явление называется капиллярным эффектом. Он отвечает за движение воды в почве и по корням растений и крови по кровеносным сосудам.

Аномальные свойства воды и их значение для жизни
H2O является неотъемлемым компонентом существования всего живого. Это объясняет недавний интерес к обнаружению воды в других частях Вселенной. Все известные биохимические процессы происходят в водной среде. Большинство живых существ содержат 70–80% H2O по весу.
Кроме того, вода играет значительную роль в процессе фотосинтеза. Растения используют лучистую энергию солнца для превращения воды и углекислого газа в углеводы: 6CO2 + 6H2O + 672 ккал → C6H12O6 + 6O2. Фотосинтез – самая основная и важная химическая реакция на Земле. Он поставляет питательные вещества, прямо или косвенно, всем живым организмам и является основным источником атмосферного кислорода.
Аномальные свойства воды и их причины
Способность элементов формировать соединения зависит от способности их атомов отдавать или принимать электроны. Элементы первого типа становятся положительно заряженными ионами (катионами), а второго – отрицательно заряженными анионами.
Способность элемента взаимодействовать с другими элементами для образования соединений называется валентностью. Она соответствует количеству полученных или отданных электронов. Для неорганических соединений алгебраическая сумма валентных чисел элементов равна нулю. Электростатическое притяжение противоположно заряженных ионов с образованием соединения называется ионной связью.
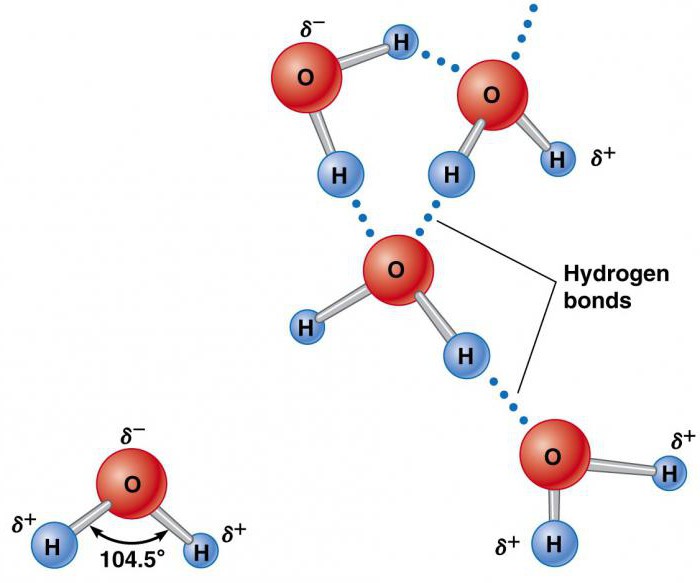
Элементы, которые образуют воду (водород и кислород), существуют отдельно в молекулах H2 и O2, содержащих по два атома. Они удерживаются вместе благодаря обмену электронной парой в химической связи, называемой ковалентной. Она намного сильнее ионной. Два атома, удерживаемые вместе ковалентной связью, образуют намного более устойчивую молекулу, чем ее составные части. В ней водород объединяется кислородом посредством общих электронных пар. Это уникальное распределение электронов в образованном химическом соединении заставляет атомы H располагаться по отношению к O под углом 104,5°.
Аномальные физические свойства воды объясняются ее структурой и химической связью.
Атом кислорода оказывает относительно сильное воздействие на общую пару электронов, в результате чего атомы водорода становятся электроположительными, а атом кислорода – электроотрицательной областью. Поскольку положительно и отрицательно заряженные участки распределены неравномерно по отношению к центральной точке, молекула воды является полярной.
Такая ее природа заставляет ее становиться электростатически привлекательной для других молекул H2O, а также ионов и контактных поверхностей с заряженными участками. Электроположительные атомы водорода притягиваются к электроотрицательным атомам кислорода соседних молекул воды. Это явление называется водородной связью. Ее прочность составляет всего около 10% ковалентной, но она отвечает за большинство аномальных физических свойств воды. К ним относятся высокие температуры замерзания и кипения, теплоемкость, удельная теплота плавления и испарения, растворимость и поверхностное натяжение.
Водородная связь отвечает за поддержание целостности молекулы H2O во время химических реакций. В то время как другие соединения подвергаются ионизации, сама вода сохраняет свою химическую целостность. Лишь относительно небольшое число молекул ионизируется в водород и гидроксильные ионы. Поэтому H2O является относительно плохим проводником электрического тока. Специфическое сопротивление теоретически чистой воды составляет 18,3 МОм∙см, в то время как питьевая имеет удельное сопротивление менее 10 000 Ом∙см. Таким образом можно легко проверить чистоту H2O.
Аномальные свойства воды объясняются наличием водородных связей, из-за которых имеет место низкая плотность льда. Вдоль них при замерзании располагаются молекулы, что приводит к расширению вещества. По этой причине лед плавает на поверхности воды. Повышенное давление снижает температуру плавления. Давление, создаваемое лезвием конька, топит лед, создавая слой, обеспечивающий изящное скольжение. Даже при чрезвычайно низких температурах высокое давление ослабляет кристаллическую решетку. Это является причиной того, что огромные ледяные массы, такие как ледники, постепенно движутся.
Дипольный момент
Полярная природа молекулы воды заставляет ее ориентироваться в электрическом или магнитном поле. Электроотрицательный атом кислорода выстраивается к положительному полюсу, а электроположительные атомы водорода – в направлении отрицательного. Вода имеет исключительно большой дипольный момент, представляющий собой произведение расстояния между зарядами, умноженное на величину заряда.
Диэлектрическая проницаемость является еще одним свойством, связанным с дипольным моментом. Молекулы воды путем выравнивания в электрическом поле стремятся нейтрализовать его и создать устойчивость к передаче электростатического заряда. Диэлектрическая проницаемость вещества определяется ε в уравнении F = Q1∙Q2/ε∙r2, где F – сила между двумя зарядами Q, разделенная расстоянием r в среде.
По мере увеличения диэлектрической проницаемости сила между зарядами уменьшается. Высокая диэлектрическая постоянная уменьшает силу притяжения ионов, что объясняет аномальные химические свойства воды растворять самые разнообразные вещества.
Заключение
Для людей вода – это обычное вещество, которое часто принимается как должное. Несмотря на то что аномальные свойств воды объясняются на атомном уровне, ее значение действительно велико. Очевидно, что она необходима для существования жизни на Земле. Аномальные свойства воды, кратко говоря, позволяют ей служить медиатором химических и биохимических процессов, формировать нашу природную среду и участвовать в создании климата и погоды.
Источник
