Какие аномалии физических свойств воды

Аномальные свойства воды до сих пор являются для академической науки загадкой …
Что такое аномальные свойства воды …
Целый ряд свойств воды выпадает из общих закономерностей и правил таких наук как физика и химия. Эти свойства не соответствуют законам «периодической системы», разработанной гениальным ученым-химиком Дмитрием Ивановичем Менделеевым.
Про общие физические и химические свойства воды, мы писали в нашем материале – ХИМИЧЕСКИЕ И ФИЗИЧЕСКИЕ СВОЙСТВА ВОДЫ В ЖИДКОМ СОСТОЯНИИ ( читать >>> ).
Аномальные свойства воды
В этом материале, мы кратко перечислим основные аномальные свойства воды.
Замерзание и кипение
Температуры замерзания и кипения воды не соответствуют общим закономерностям и законам химии. Так мы знаем, что вода в реальной жизни замерзает при 0°C, а кипит при 100°C, в то время как в соответствии с общими правилами химии эти процессы должны проходить при -90°C (минус девяносто) и -70°C (минус 70) соответственно.
Уникальные термические свойства воды
Вода имеет уникальную по своей величине аномальную теплоемкость равную 4,18 кДж (кг-К). Это означает, что вода медленно охлаждается и медленно нагревается.
Вода является эффективным регулятором температур, она ограничивает резкие перепады температур. Более подробно с этим ее свойством вы можете ознакомиться в нашей статье – Удельная теплоемкость воды, или почему мы такие, какие есть.
Температурная яма
Наибольшая скорость нагрева и охлаждения воды происходит в так называемой «температурной яме», которая образуется вследствие того, что в районе 37 °C теплоемкость у воды наименьшая.
Как мы видим, температура человеческого тела 36,6 °C близка к этому значению.
Эффект Мпембы – эффект горячей воды
Удивительно, но факт – горячая вода замерзает быстрее холодной, что противоречит логике и общему восприятию вещей.
Температура воды + 3,98 °C
Как мы уже отметили выше, температура + 3,98 °C, является для воды важным значением. При понижении температуры до этого уровня вода ведет себя в соответствии с общими законами и правилами этих наук. При дальнейшем понижении температуры у воды начинают проявляются ее аномальные свойства.
При температуре + 3,98 °C у воды плотность имеет наибольшее значение, а объем наименьший.
Объем и плотность
Еще одним важным для всех нас является ее аномальное свойство при замерзании увеличиваться в объеме, тем самым уменьшая свою плотность. Уточним, что до + 3,98 °C вода ведет в соответствии с общими законами химии и физики, а далее проявляются ее аномальные свойства.
Поверхностное натяжение
Еще одним удивительным и во многом аномальным свойством воды является ее поверхностное натяжение.
Хорошо всем известный пример демонстрирует, как аккуратно положенная на воду металлическая швейная игла плавает на ее поверхности, что во многом удивительно. Ведь плотность метала гораздо больше плотности воды.
Вся жизнь на Земле своим существованием во многом обязано именно этому свойству воды.
Вода — отличный растворитель
Вода является отличным растворителем, она удивительно легко растворяет большое количество самых разнообразных веществ и газов. И что тоже весьма важно, так же легко их отдает. Например, благодаря именно этому свойству после дождя мы чувствуем удивительную свежесть – дождь очищает воздух.
Вода и магнитное поле
Под воздействием магнитного поля у воды меняется ее способность к растворению веществ, изменяется скорость, проходящих в ней, химических реакций.
Заключение
Аномальные свойства воды еще раз подтверждают общеизвестное высказывание — удивительное рядом.
Источник
Вода является веществом необычным, заслуживающим детального изучения. Советский академик И. В. Петрянов написал об этом удивительном веществе книгу «Самое необыкновенное вещество в мире». Какие аномалии физических свойств воды представляют особый интерес? Вместе будем искать ответ на этот вопрос.
Интересные факты
Мы редко задумываемся над смыслом слова “вода”. На нашей планете более 70 % от всей площади занимают реки и озера, моря и океаны, айсберги, ледники, болота, снега на вершинах гор, а также вечная мерзлота. Несмотря на такое огромное количество воды, для питья пригоден только 1 %.

Биологическое значение
Организм человека на 70-80 % состоит из воды. Это вещество обеспечивает протекание всех жизненно важных процессов, в частности, благодаря ей из него выводятся токсины, восстанавливаются клетки. Основной функцией воды в живой клетке является структурно-энергетическая, при снижении количественного содержания ее в теле человека происходит его «усыхание».
Нет такой системы в живом организме, которая бы могла функционировать без H2O. Несмотря на аномалии воды, она является эталоном для определения количества теплоты, массы, температуры, высоты местности.

Основные понятия
H2O — оксид водорода, в котором содержится 11,19 % водорода, 88,81% кислорода по массе. Это бесцветная жидкость, которая не имеет ни запаха, ни вкуса. Вода является обязательным компонентом технологических процессов в промышленности.
Впервые данное вещество было синтезировано в конце 18 века Г. Кавендишем. Ученый взрывал смесь кислорода и водорода электрической дугой. Впервые проанализировал разницу в плотности льда и воды в 1612 году Г. Галилей.
В 1830 году была создана паровая машина французскими учеными П. Дюлонгом и Д. Араго. Это открытие позволило изучить взаимосвязь между давлением насыщенного пара и температурой. В 1910 году американским ученым П. Бриджменом и немцем Г. Тамманом обнаружено несколько полиморфных модификаций у льда при высоком давлении.
В 1932 году американскими учеными Г. Юри и Э. Уошберном была открыта тяжелая вода. Аномалии физических свойств данного вещества были открыты благодаря совершенствованию аппаратуры и методов проведения исследований.
Некоторые противоречия в физических свойствах
Чистая вода является прозрачной бесцветной жидкостью. Ее плотность при превращении в жидкость из твердого вещества возрастает, в этом проявляется аномалия свойств воды. Нагревание ее от 0 до 40 градусов приводит к росту плотности. В качестве аномалии воды необходимо отметить высокую теплоемкость. Температура кристаллизации составляет 0 градусов по Цельсию, а кипения — 100 градусов.
У молекулы этого неорганического соединения угловое строение. Ядра, входящие в ее состав, формируют равнобедренный треугольник, в основании которого располагаются два протона, а вершиной является атом кислорода.
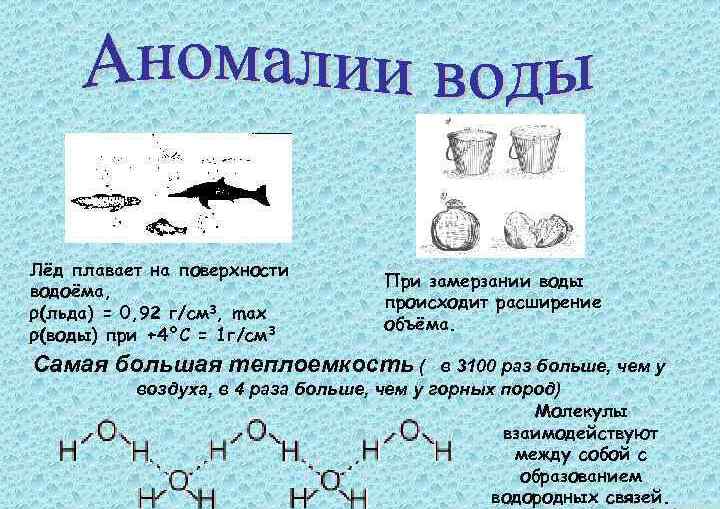
Аномалии плотности
Ученым удалось выявить порядка сорока особенностей, характерных для H2O. Аномалии воды заслуживают пристального рассмотрения и изучения. Ученые пытаются пояснить причины каждого фактора, дать ему научное объяснение.
Аномалия плотности воды заключается в том, что у данного вещества свое максимальное значение плотность начинается при +3,98°С. При последующем охлаждении, переводе из жидкости в твердое состояние наблюдается уменьшение плотности.
Для остальных соединений плотность в жидкостях при уменьшении температуры снижается, так как увеличение температуры способствует росту кинетической энергии молекул (растет скорость их передвижения), что приводит к повышенной рыхлости вещества.
Рассматривая подобные аномалии воды, необходимо отметить, что и для нее при повышении температуры свойственен рост скорости, но плотность понижается только при повышенных температурных значениях.
После уменьшения плотности льда он будет находиться на поверхности воды. Объяснить данное явление можно тем, что молекулы имеют в кристалле регулярное строение, имеющее пространственную периодичность.
Если у обычных соединений молекулы упакованы в кристаллах плотно, то после плавления вещества, регулярность пропадает. Подобное явление наблюдается только при расположении молекул на значительных расстояниях. Уменьшение плотности при плавлении металлов является ничтожно малой величиной, оценивается в 2-4 %. Плотность воды превышает аналогичный показатель у льда на 10 процентов. Таким образом, это и есть проявление аномалии воды. Химия объясняет подобное явление дипольным строением, а также ковалентной полярной связью.

Аномалии сжимаемости
Продолжим разговор об особенностях воды. Для нее характерно непривычное температурное поведение. Ее сжимаемость, то есть уменьшение объема, по мере повышения давления вполне можно считать примером аномалии физических свойств воды. Конкретно какие особенности здесь необходимо отметить? Другие жидкости гораздо проще сжать под давлением, а вода приобретает такие признаки только при высоких температурах.
Температурное поведение теплоемкости
Данная аномалия является одной из сильнейших для воды. Теплоемкость говорит о том, какое необходимо затратить количество теплоты для того, чтобы повысить температуру на 1 градус. Для многих веществ после плавления теплоемкость жидкости увеличивается не больше чем на 10 процентов. А для воды после плавления льда данная физическая величина возрастает в два раза. Ни у одного вещества подобного роста теплоемкости не зафиксировано.
Во льду та энергия, которая подводится к нему для нагревания, расходуется в большей части на рост скорости движения молекул (кинетическую энергию). Существенный рост после плавления теплоемкости свидетельствует о том, что в воде происходят иные энергоемкие процессы, для которых нужно подводимое тепло. Именно они и являются причиной повышенной теплоемкости. Данное явление характерно для всего диапазона температур, при котором вода имеет жидкое агрегатное состояние.
Как только она превращается в пар, аномалия пропадает. В настоящее время многие ученые занимаются анализом свойств переохлажденной воды. Оно заключается в ее возможности сохранять жидкое состояние ниже точки кристаллизации 0°С.
Переохладить воду вполне можно в тонких капиллярах, а также в неполярной среде в качестве мельчайших капелек. Возникает закономерный вопрос о том, что наблюдается с аномалией плотности в подобной ситуации. По мере переохлаждения плотность воды существенно снижается, она стремится к плотности льда при понижении температурного значения.

Причины появления
Когда спрашивают: «Назовите аномалии воды и охарактеризуйте их причины», необходимо связывать их с перестройкой структуры. Расположение частиц в структуре любого вещества определяется особенностями взаимного расположения в ней частиц (атомов, ионов, молекул). Между молекулами воды действуют водородные силы, которые выводят данную жидкость из зависимости между температурами кипения и плавления, характерной для иных веществ, находящихся в жидком агрегатном состоянии.
Появляются они между молекулами данного неорганического соединения благодаря особенностям распределения плотности электронов. Атомы водорода обладают определенным положительным зарядом, а кислорода — отрицательным. В итоге молекула воды имеет форму правильного тетраэдра. Подобное строение характеризуется валентным углом 109,5°. Самым выгодным расположением является размещение по одной линии кислорода и водорода, имеющих разный заряд, следовательно, водородная связь характеризуется электростатической природой.
Итак, необычные (аномальные) свойства воды являются следствием особенного электронного строения ее молекулы.

«Память» воды
Есть такое мнение, что вода обладает памятью, может накапливать и переносить энергию, питая тело виртуальной информацией. Длительное время данной проблемой занимался японский ученый Масару Эмото. Результаты своих исследований доктор Эмото опубликовал в книге «Послания воды». Ученым были проведены эксперименты, в рамках которых он сначала замораживал при 5 градусах каплю воды, а потом анализировал структуру кристаллов под микроскопом. Для фиксации получаемых результатов он использовал микроскоп, в который была встроена фотокамера.
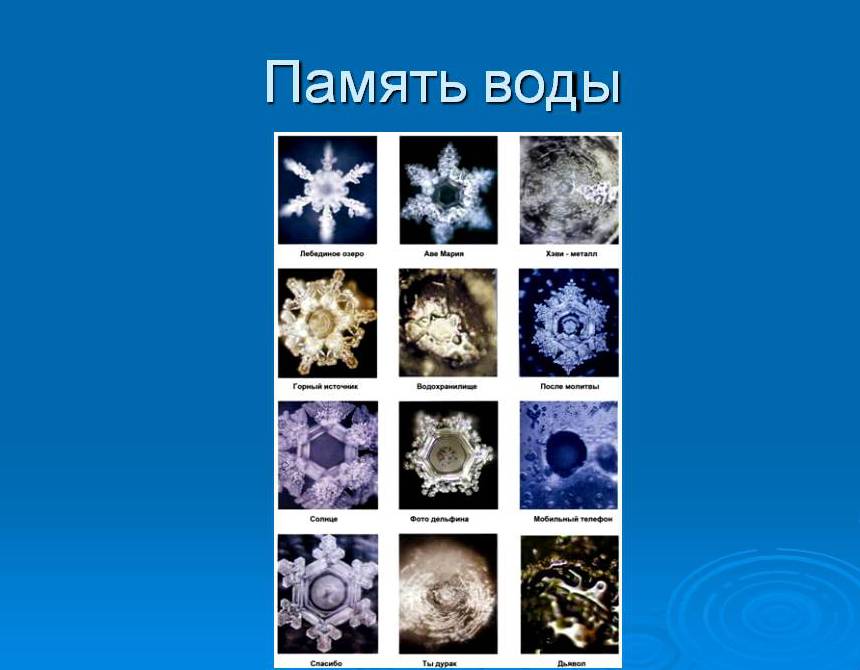
В рамках эксперимента Масау Эмото воздействовал на воду разными способами, потом заново ее замораживал, вел фотосъемку. Ему удалось получить зависимость между формой кристаллов льда и музыкой, которую “слушала” вода. Удивительно, но самые гармоничные снежинки ученый зафиксировал при использовании классической и народной музыки.
Использование современной музыки, по мнению Масау, “загрязняет” воду, поэтому им были зафиксированы кристаллы неправильной формы. Интересным фактом является и выявление японским ученым зависимости между формой кристаллов и человеческой энергией.

Вода – это самое удивительное вещество, которое содержится в большом количестве на нашей планете. Сложно представить себе какие-либо сферы деятельности современного человека, в которых бы она не принимала активное участие. Многогранность данного вещества определяется аномалиями, причиной которых стало тетраэдрическое строение воды.
Источник
12.08 2009, 15:52 РИА «Новости»
Аномальные свойства воды, определяющие, в том числе и наличие жизни на Земле — её переменная плотность, высокая теплоемкость и большое поверхностное натяжение, объясняются двумя типами структур, в которые самоорганизуются молекулы жидкости, уверены авторы нового исследования, опубликованного в журнале Proceedings of the National Academy of Sciences.
Ученым давно были известны 66 необъяснимых свойств воды, отличающих её от большинства других химических веществ, встречающихся в жидком состоянии. Так, в отличие от всех известных жидкостей, плотность которых монотонно увеличивается с понижением температуры, плотность воды максимальна при 4 градусах Цельсия, а при дальнейшем понижении температуры вновь начинает убывать. Это уникальное свойство воды делает возможной жизнь в реках и озерах — в противном случае эти относительно мелкие водоемы неизбежно промерзали бы до дна в зимний период и были бы лишены всех живых организмов, за исключением, может быть, простейших бактерий экстремофилов.
Вода обладает огромной теплоемкостью — благодаря этому теплые океанические течения согревают многие северные регионы планеты, принося тепло из южных широт.

Аномально высокое поверхностное натяжение жидкой воды не только позволяет некоторым насекомым спокойно ходить по её поверхности, но и благодаря капиллярным силам обеспечивает поступление питательных веществ к кронам гигантских деревьев, достигающих нескольких десятков метров в высоту.
Объяснить эти свойства на основании лишь строения и химических параметров молекул воды ученые до последнего времени не могли. Секрет крылся в структуре, в которую самоорганизуются молекулы жидкой воды. Он долгое время оставался неразгаданным, так как изучить эту структуру теми же методами, что применяются для изучения строения твердых тел, практически невозможно.
Команда Андерса Нильсона (Anders Nilsson), ведущего специалиста Стенфордского центра синхротронного излучения (Stanford Synchrotron Radiation Lightsource), сумела преодолеть эти трудности благодаря новейшим методам изучения строения жидкостей с использованием мощного рентгеновского излучения, получаемого с помощью больших ускорителей элементарных частиц, называемых синхротронами. Один из использованных в работе синхротронов находится в Японии, а второй в США.
Ученые выяснили, что существовавшие до сих пор представления о молекулярной структуре воды были неверными — оказалось, что её молекулы формируют не одну структуру, а одновременно два типа структур, сосуществующих в жидкости вне зависимости от температуры. Один тип структуры формируется в виде сгустков примерно по 100 молекул, структура которых напоминает структуру льда. Второй тип структуры, окружающей сгустки, гораздо менее упорядочен.
Увеличение температуры вплоть до точки кипения воды приводит к некоторому искажению структуры сгустков и уменьшению их количества и доминированию разупорядоченной структуры.
«Этот процесс можно представить как танцевальный клуб, где часть людей сидит за столиками, отражая упорядоченную компоненту воды, а часть находясь в толпе, непрерывно перемещается в танце, отражая разупорядоченную. Увеличение температуры воды в этом случае можно сравнить с всеобщим поднятием настроения и ускорением музыки, когда люди начинают вставать из-за столов и присоединяться к танцующим, а часть пустующих столов и вовсе убирается для высвобождения места. Охлаждение — обратный процесс, когда танцпол заполняется столами, и за них присаживаются утомленные танцами гости клуба. При этом при одной и той же “температуре” танцующие и сидящие люди постоянно меняются местами — некоторые присаживаются отдохнуть а некоторые наоборот идут танцевать, тогда как общее соотношение танцующих и сидящих остается прежним» — пояснил результаты работы Нильсон, слова которого приводит пресс-служба Стенфордского центра линейных ускорителей в США.

Это, в частности, объясняет нелинейную зависимость плотности воды от температуры — упорядоченные скопления молекул имеют меньшую плотность, чем неупорядоченные, и она мало меняется с изменением температуры, которую можно сравнить с постоянным размером столов, не зависящим от настроения собравшихся или громкости музыки в ресторане.
Закажите консультацию специалиста компании Гейзер
Остались вопросы? Мы всегда готовы предоставить консультацию по всем вопросам очистки воды!
Заказать консультацию
Источник
Люди привыкли к воде и считают ее обычным веществом. Они часто воспринимают ее как нечто само собой разумеющееся до тех пор, пока засуха не начнет угрожать посевам и запасам питьевой воды, или сильное наводнение не создаст угрозу жизни и имуществу. Многие не осознают, что структура воды и ее аномальные свойства обеспечивают существование жизни на Земле.
Один из ранних греческих философов, Фалес Милетский (640-546 гг. до н. э.), исследовал универсальный характер воды. Он считал ее основным элементом, из которого рождается все. Обилие воды было очевидным, но Фалес заметил, что она является единственным веществом, естественным образом присутствующим на Земле одновременно в трех разных состояниях: твердом, жидком и газообразном. В холодный зимний день снег и лед покрывают поля, рядом течет река, а над головой плывут облака.
Формы материи
Все вещества существуют в трех различных состояниях, которые зависят от температуры и давления. Твердые тела обладают определенной формой и имеют кристаллическую внутреннюю структуру. По этому определению вещество, подобное стеклу, будет считаться высоковязкой жидкостью, поскольку оно не обладает кристаллическим строением. Твердые тела склонны противостоять внешним воздействием. Они могут быть преобразованы в жидкость путем нагрева. Температура замерзания воды при давлении в 1 атмосферу равна 0 °С, ниже которой она существует в виде льда.
Жидкость, в отличие от твердого тела, не обладает твердостью и не имеет определенной формы. У нее есть объем, и она принимает форму сосуда, в котором хранится. Внешнее воздействие вынуждает ее течь. Вода представляет собой жидкость между температурами замерзания и кипения (100 °С). Жидкости могут переходить в газообразную фазу при нагреве выше точки кипения.
Газ не имеет ни формы, ни определенного объема. Он принимает форму и занимает объем сосуда, в котором находится. Газ расширяется и сжимается с изменением температуры и давления и способен легко диффундировать в другие газы.

Точки кипения и замерзания
Аномальными свойствами воды являются ее необычно высокие температуры кипения и замерзания по сравнению с другими соединениями с аналогичной молекулярной структурой. Другие подобные вещества в обычных условиях являются газами. Ожидается, что вода с ее более низкой молекулярной массой, чем аналогичные соединения, должна иметь более низкие температуры кипения и замерзания. Однако из-за полярной природы ее молекулы и водородных связей температура ее кипения равна 100 °C, а замерзания – 0 °C. Для сравнения, соответствующие значения у сероводорода H2S равны -60 °C и -84 °C, у селеноводорода H2Se этот показатель составляет -42 °C и -64 °C и у теллуроводорода -2 °C и -49 °C.
Твердая фаза
Как правило, с понижением температуры вещества становятся более плотными, и вода не является исключением. Ее плотность при 25 °C составляет 0,997 г/мл и увеличивается с до максимальной (1 г/мл) при T = 4 °C. В метрической системе измерения килограмм определяется как масса 1 л воды с максимальной плотностью. Между 4 °C и точкой замерзания 0 °C происходит удивительная вещь, которая наблюдается у очень небольшого числа веществ. Вода постепенно расширяется, становясь менее плотной. Плотность льда при 0 °C составляет около 0,917 г/мл. Молекулы воды образуют кристаллы в форме тетраэдра (четырехсторонней фигуры, каждая грань которой представляет собой равносторонний треугольник). Поскольку плотность твердой фазы меньше, чем жидкой, лед плавает. При замораживании объем воды увеличивается на 1%.
Очень важно, что лед расширяется и плавает на поверхности. Из-за этого зимой лопаются водопроводы и появляются выбоины на дорогах. Замерзание и таяние воды в значительной степени ответственно за разрушение скал и образование почв. Кроме того, если бы озера и потоки замерзали снизу вверх, то водная жизнь вообще перестала бы существовать, а климатические и погодные условия резко изменились.

Теплоемкость
Еще одним аномальным свойством воды является ее чрезвычайно высокая способность поглощать тепло без значительного повышения температуры. Например, летнее солнце на пляже нагревает песок до такой степени, что становится невозможно по нему ходить. Вода при этом остается прохладной. Оба вещества поглощают равное количество тепловой энергии, но температура песка выше. Пустой железный котелок, висящий над огнем, быстро раскалится докрасна, но если он заполнен водой, то его нагрев происходит постепенно. Высокая теплоемкость воды делает ее хорошей охлаждающей жидкостью в конденсаторах и автомобильных радиаторах, предотвращающих двигатели от перегрева. Ее значение в 5 раз превышает теплоемкость песка и примерно в 10 раз – железа.
Умеренный климат в прибрежных районах является результатом поглощения в течение дня огромного количества солнечной тепловой энергии водой и медленного высвобождения ее ночью. Внутренние районы вдали от побережья обычно испытывают гораздо более высокие экстремальные температуры. Огромные океаны на Земле (около 75% площади поверхности) отвечают за смягчение климата на нашей планете, поддерживая существование жизни.
Теплота плавления и испарения
С теплоемкостью связана теплота фазового перехода. Это количество тепловой энергии, поглощаемой или высвобождаемой веществом, которое изменяется в фазе (от жидкого до твердого состояния, или наоборот, и от жидкого до газообразного, или наоборот) без изменения температуры. Необычайно высокие значения удельной теплоты плавления (332,4 кДж/кг) и испарения (2256,2 кДж/кг) – очередные аномальные физические свойства воды. При замерзании выделяется такое же количество тепла, которое поглощается в процессе плавления.

Практическим примером использования удельной теплоты плавления воды является использование льда для охлаждения напитков в изолированном кулере. В процессе таяния лед поглощает тепловую энергию напитков, сохраняя их прохладными. Емкость с водой в теплице в холодную зимнюю ночь смягчит температуру в помещении из-за тепла, выделяемого при замерзании. Конденсация пара высвобождает то же количество тепла, которое поглощается в процессе испарения. Удельная теплота испарения в 5 раз превышает теплоту, необходимую для повышения температуры от 0 до 100 °C. Аномальное свойство воды хранить большое количество накопленной тепловой энергии делает паровое отопление эффективным. В процессе конденсации пар высвобождает накопленную тепловую энергию. Дневная гроза в жаркий летний день – еще один пример высвобождения тепловой энергии в верхних слоях атмосферы при конденсации горячего влажного воздуха. Даже ураган является примером влияния перераспределения огромного количества тепловой энергии, поглощенной тропическими океанами.
Системы испарительного охлаждения работают наоборот. Вода в процессе испарения поглощает тепловую энергию из воздуха, охлаждая его.
Универсальный растворитель
Растворитель способен растворять другое вещество с образованием гомогенной смеси (раствора) на молекулярном уровне. Еще одним аномальным свойством воды в химии благодаря ее полярной природе является ее способность растворять другие полярные соединения – соли, спирты, карбоксильные соединения и т. д. В воде растворяется больше веществ, чем в любом другом растворителе. В ней можно найти более половины известных химических элементов, некоторые в высоких концентрациях, а другие – только в следовых количествах. Например, концентрация насыщения хлорида натрия составляет около 36 г на 100 мл, а карбоната кальция – около 0,0015 г. Способность воды растворять вещество зависит от его химического состава, силы химических связей элементов, температуры и рН.
Неполярные соединения, в том числе большинство углеводородов, растворяются в низких или следовых количествах. Например, масла, как правило, плавают на поверхности воды.

Поверхностное натяжение
К аномальным свойствам воды относят и ее самое высокое (после ртути) поверхностное натяжение по сравнению с любой другой жидкостью. Это сила притяжения молекул, расположенных под поверхностью и тех, которые находятся на границе раздела жидкость-воздух. Она удерживает воду от растекания. Полярные соединения, как правило, имеют гораздо более высокое поверхностное натяжение, чем неполярные. И вода не является исключением. При 20 °С данный показатель равен 0,07286 Н/м (у этилового спирта – 0,0228 Н/м).
Без внешнего воздействия капля H2O принимает форму сферы, поскольку эта фигура обладает наименьшей площадью поверхности на единицу объема. Капли дождя являются крошечными пулями, которые при длительном воздействии разрушают горные породы. По этой же причине объекты, более тяжелые, чем вода, могут удерживаться на ее поверхности. Насекомые способны ходить по ней, а лезвие бритвы – плавать.
Водородная связь определяет аномальное свойство воды смачивать большинство поверхностей. Такие вещества считаются гидрофильными. Вода способна подниматься по стенкам стакана и других емкостей. Другие вещества, такие как масла, жиры, воск и синтетика (полипропилен и т. д.), не намокают. Они являются гидрофобными. Мембранные фильтровальные картриджи с размером пор менее 1 мкм изготавливают из гидрофобных полимеров с помощью смачивающих агентов, снижающих поверхностное натяжение воды, чтобы последняя могла проникнуть и оставаться в них. Это явление называется капиллярным эффектом. Он отвечает за движение воды в почве и по корням растений и крови по кровеносным сосудам.

Аномальные свойства воды и их значение для жизни
H2O является неотъемлемым компонентом существования всего живого. Это объясняет недавний интерес к обнаружению воды в других частях Вселенной. Все известные биохимические процессы происходят в водной среде. Большинство живых существ содержат 70–80% H2O по весу.
Кроме того, вода играет значительную роль в процессе фотосинтеза. Растения используют лучистую энергию солнца для превращения воды и углекислого газа в углеводы: 6CO2 + 6H2O + 672 ккал → C6H12O6 + 6O2. Фотосинтез – самая основная и важная химическая реакция на Земле. Он поставляет питательные вещества, прямо или косвенно, всем живым организмам и является основным источником атмосферного кислорода.
Аномальные свойства воды и их причины
Способность элементов формировать соединения зависит от способности их атомов отдавать или принимать электроны. Элементы первого типа становятся положительно заряженными ионами (катионами), а второго – отрицательно заряженными анионами.
Способность элемента взаимодействовать с другими элементами для образования соединений называется валентностью. Она соответствует количеству полученных или отданных электронов. Для неорганических соединений алгебраическая сумма валентных чисел элементов равна нулю. Электростатическое притяжение противоположно заряженных ионов с образованием соединения называется ионной связью.
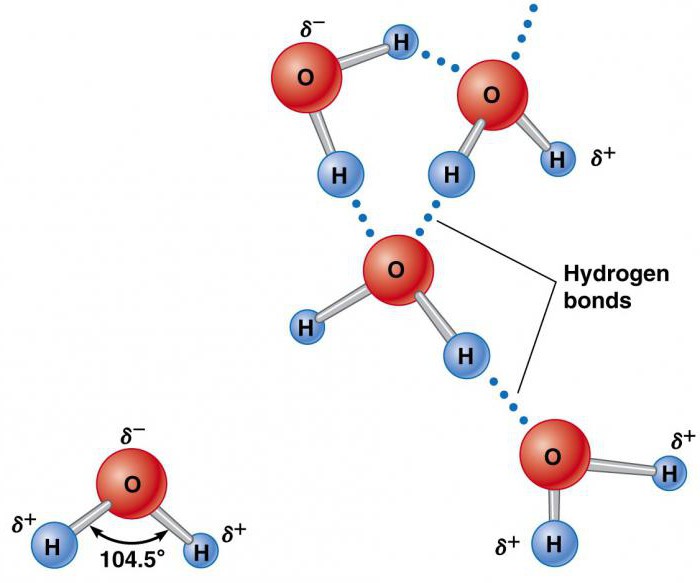
Элементы, которые образуют воду (водород и кислород), существуют отдельно в молекулах H2 и O2, содержащих по два атома. Они удерживаются вместе благодаря обмену электронной парой в химической связи, называемой ковалентной. Она намного сильнее ионной. Два атома, удерживаемые вместе ковалентной связью, образуют намного более устойчивую молекулу, чем ее составные части. В ней водород объединяется кислородом посредством общих электронных пар. Это уникальное распределение электронов в образованном химическом соединении заставляет атомы H располагаться по отношению к O под углом 104,5°.
Аномальные физические свойства воды объясняются ее структурой и химической связью.
Атом кислорода оказывает относительно сильное воздействие на общую пару электронов, в результате чего атомы водорода становятся электроположительными, а атом кислорода – электроотрицательной областью. Поскольку положительно и отрицательно заряженные участки распределены неравномерно по отношению к центральной точке, молекула воды является полярной.
Такая ее природа заставляет ее становиться электростатически привлекательной для других молекул H2O, а также ионов и контактных поверхностей с заряженными участками. Электроположительные атомы водорода притягиваются к электроотрицательным атомам кислорода соседних молекул воды. Это явление называется водородной связью. Ее прочность составляет всего около 10% ковалентной, но она отвечает за большинство аномальных физических свойств воды. К ним относятся высокие температуры замерзания и кипения, теплоемкость, удельная теплота плавления и испарения, растворимость и поверхностное натяжение.
Водородная связь отвечает за поддержание целостности молекулы H2O во время химических реакций. В то время как другие соединения подвергаются ионизации, сама вода сохраняет свою химическую целостность. Лишь относительно небольшое число молекул ионизируется в водород и гидроксильные ионы. Поэтому H2O является относительно плохим проводником электрического тока. Специфическое сопротивление теоретически чистой воды составляет 18,3 МОм∙см, в то время как питьевая имеет удельное сопротивление менее 10 000 Ом∙см. Таким образом можно легко проверить чистоту H2O.
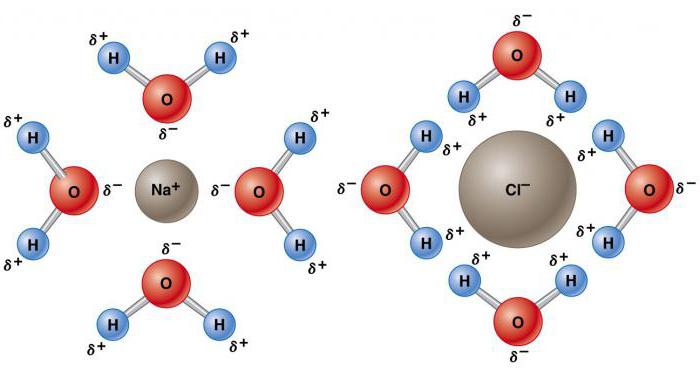
Аномальные свойства воды объясняются наличием водородных связей, из-за которых имеет место низкая плотность льда. Вдоль них при замерзании располагаются молекулы, что приводит к расширению вещества. По этой причине лед плавает на поверхности воды. Повышенное давление снижает температуру плавления. Давление, создаваемое лезвием конька, топит лед, создавая слой, обеспечивающий изящное скольжение. Даже при чрезвычайно низких температурах высокое давление ослабляет кристаллическую решетку. Это является причиной того, что огромные ледяные массы, такие как ледники, постепенно движутся.
Дипольный момент
Полярная природа молекулы воды заставляет ее ориентироваться в электрическом или магнитном поле. Электроотрицательный атом кислорода выстраивается к положительному полюсу, а электроположительные атомы водорода – в направлении отрицательного. Вода имеет исключительно большой дипольный момент, представляющий собой произведение расстояния между зарядами, умноженное на величину заряда.
Диэлектрическая проницаемость является еще одним свойством, связанным с дипольным моментом. Молекулы воды путем выравнивания в электрическом поле стремятся нейтрализовать его и создать устойчивость к передаче электростатического заряда. Диэлектрическая проницаемость вещества определяется ε в уравнении F = Q1∙Q2/ε∙r2, где F – сила между двумя зарядами Q, разделенная расстоянием r в среде.
По мере увеличения диэлектрической проницаемости сила между зарядами уменьшается. Высокая диэлектрическая постоянная уменьшает силу притяжения ионов, что объясняет аномальные химические свойства воды растворять самые разнообразные вещества.
Заключение
Для людей вода – это обычное вещество, которое часто принимается как должное. Несмотря на то что аномальные свойств воды объясняются на атомном уровне, ее значение действительно велико. Очевидно, что она необходима для существования жизни на Земле. Аномальные свойства воды, кратко говоря, позволяют ей служить медиатором химических и биохимических процессов, формировать нашу природную среду и участвовать в создании климата и погоды.
Источник
