Какая связь называется водородной как она определяет физические свойства
ГДЗ по классам
2 класс
- Математика
3 класс
- Математика
4 класс
- Математика
5 класс
- Математика
- Русский язык
- Английский язык
6 класс
- Математика
- Русский язык
- Английский язык
7 класс
- Русский язык
- Английский язык
- Алгебра
- Геометрия
- Физика
8 класс
- Русский язык
- Английский язык
- Алгебра
- Геометрия
- Физика
- Химия
9 класс
- Русский язык
- Английский язык
- Алгебра
- Геометрия
- Физика
- Химия
10 класс
- Геометрия
- Химия
11 класс
- Геометрия
ГДЗ и решебники
вип уровня
- 2 класс
- Математика
- 3 класс
- Математика
- 4 класс
- Математика
- 5 класс
- Математика
- Русский язык
- Английский язык
- 6 класс
- Математика
- Русский язык
- Английский язык
- 7 класс
- Русский язык
- Английский язык
- Алгебра
- Геометрия
- Физика
- 8 класс
- Русский язык
- Английский язык
- Алгебра
- Геометрия
- Физика
- Химия
- 9 класс
- Русский язык
- Английский язык
- Алгебра
- Геометрия
- Физика
- Химия
- 10 класс
- Геометрия
- Химия
- 11 класс
- Геометрия
- ГДЗ
- 9 класс
- Химия
- О. С. Габриелян, 2014г.
- Вопрос 2, Параграф 20
Назад к содержанию
Условие
Какая связь называется водородной? Как она определяет физические свойства воды?
Решение 1

Другие задачи из этого учебника
- 1
- 2
- 3
- 4
- 5
- 6
- 7
Поиск в решебнике
Популярные решебники
ГДЗ по Химии за 9 класс Габриелян О.С.
Издатель: О. С. Габриелян, 2014г.
Источник
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 29 января 2020; проверки требует 1 правка.
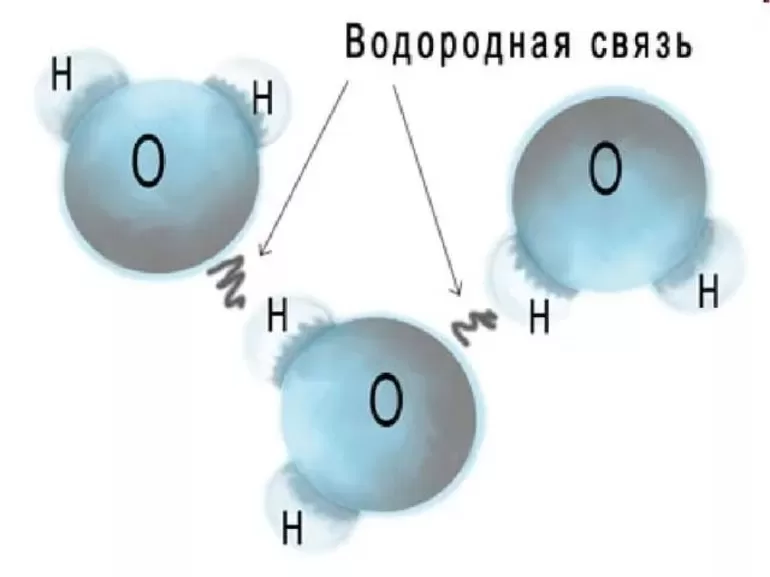
Пример межмолекулярных водородных связей
Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать N, O или F. Водородные связи могут быть межмолекулярными или внутримолекулярными.[1]
Природа[править | править код]
Часто водородную связь рассматривают как электростатическое взаимодействие, усиленное небольшим размером водорода, которое разрешает близость
взаимодействующих диполей. Тогда об этом говорят как о разновидности донорно-акцепторной связи, невалентном взаимодействии между атомом водорода H, ковалентно связанным с атомом A группы A-H молекулы RA-H и электроотрицательным атомом B другой молекулы (или функциональной группы той же молекулы) BR’. Результатом таких взаимодействий являются комплексы RA-H···BR′ различной степени стабильности, в которых атом водорода выступает в роли «моста», связывающего фрагменты RA и BR′.
Особенностями водородной связи, по которым её выделяют в отдельный вид, является её не очень высокая прочность[2], её распространенность и важность, особенно в органических соединениях[3], а также некоторые побочные эффекты, связанные с малыми размерами и отсутствием дополнительных электронов у водорода.
В настоящее время в рамках теории молекулярных орбиталей водородная связь рассматривается как частный случай ковалентной с делокализацией электронной плотности по цепи атомов и образованием трёхцентровых четырёхэлектронных связей (например, -H···[F-H···F]-).
История[править | править код]
В книге The Nature of Chemical Bond and the Structure of Molecules and Crystals Лайнуса Полинга, впервые изданной в 1939 году, первое упоминание водородной связи приписывается Муру и Винмиллу. Они использовали водородную связь, чтобы обосновать факт, что гидроксид триметиламмония является более слабым основанием, чем гидроксид тетраметиламмония.[4] Описание водородных связей в воде было сделано в 1920 году Латимером и Родебушем[5].
Свойства[править | править код]
Энергия водородной связи значительно меньше энергии обычной ковалентной связи (не превышает 40 кДж/моль). Однако этой энергии достаточно, чтобы вызвать ассоциацию молекул, то есть их объединение в димеры или полимеры. Именно ассоциация молекул служит причиной аномально высоких температур плавления и кипения таких веществ, как фтороводород, вода, аммиак.
Связь этого типа, хотя и слабее ионной и ковалентной связей, играет очень важную роль во внутри- и межмолекулярных взаимодействиях. Водородные связи во многом обусловливают физические свойства воды и многих органических жидкостей (спирты, карбоновые кислоты, амиды карбоновых кислот, сложные эфиры).
Прочность водородной связи (энтальпия образования комплекса) зависит от полярности комплекса и колеблется от ~ 6 кДж/моль для комплексов молекул галогеноводородов с инертными газами до 160 кДж/моль для ион-молекулярных комплексов (AHB)±; так, для комплекса (H2O•H•OH2)+, образованного H2O и H3O+ — 132 кДж/моль в газовой фазе.
В воде[править | править код]
Механизм Гротгуса[править | править код]
Аномально высокая теплоёмкость воды, а также теплопроводность многоатомных спиртов обеспечивается многочисленными водородными связями. Одна молекула воды может образовать до четырёх классических водородных связей с соседями (с учётом бифуркатных H-связей до 5—6).
Водородные связи повышают температуру кипения, вязкость и поверхностное натяжение жидкостей. Водородные связи ответственны за многие другие уникальные свойства воды.
Водные кластеры[править | править код]
Водородная связь между молекулами воды обозначена чёрными пунктирными линиями. Жёлтые линии обозначают ковалентную связь, которая удерживает вместе атомы кислорода (красный) и водорода (серый).
Согласно современным представлениям, наличие водородных связей между молекулами воды приводит к возникновению так называемых водных кластеров или комплексов. Простейшим примером такого кластера может служить димер воды:
Энергия водородной связи в димере воды составляет 0,2 эВ (≈ 5 ккал/моль), что всего на порядок больше, чем характерная энергия теплового движения при температуре 300 К. В то же время энергия ковалентной связи O-H в 200 раз больше тепловой энергии. Таким образом, водородные связи относительно слабы и неустойчивы: предполагается, что они могут легко возникать и исчезать в результате тепловых флуктуаций. Это, в частности, приводит к тому, что вода должна рассматриваться не как «простая», а как «связанная жидкость»: вода представляется как сеть молекул , соединённых водородными связями[6].
В нуклеиновых кислотах и белках[править | править код]
Водородная связь в значительной мере определяет свойства и таких биологически важных веществ, как белки и нуклеиновые кислоты. В частности, элементы вторичной структуры (например, α-спирали, β-складки) и третичной структуры в молекулах белков, РНК и ДНК стабилизированы водородными связями. В этих макромолекулах водородные связи сцепляют части той же самой макромолекулы, заставляя её сворачиваться в определенную форму. Например, двойная спиральная структура ДНК определяется в значительной степени наличием водородных связей, сцепляющих пары нуклеотидов, которые связывают одну комплементарную нить с другой.
В полимерах[править | править код]
Многие полимеры усилены водородными связями в их главных цепях. Среди синтетических полимеров самый известный пример — нейлон, где водородные связи играют главную роль в кристаллизации материала. Водородные связи также важны в структуре полученных искусственно полимеров (например, целлюлозы) и в многих различных формах в природе, таких как древесина, хлопок и лён.
См. также[править | править код]
- Химическая связь
- Фолдинг белка
Примечания[править | править код]
- ↑ Определение по IUPAC
- ↑ Энергия связи H···N = 8 кДж/моль, связи H···O — около 21 кДж/моль, связи H···F около 36 кДж/моль [1]. Для сравнения, энергия ковалентной связи — 400—900 кДж/моль [2]
- ↑ Например, водородными связями обусловлена форма молекулы ДНК
- ↑ T. S. Moore and T. F. Winmill. The state of amines in aqueous solution (англ.) // J. Chem. Soc.. — 1912. — Vol. 101. — P. 1635-1676. — doi:10.1039/CT9120101635.
- ↑ Wendell M. Latimer, Worth H. Rodebush. POLARITY AND IONIZATION FROM THE STANDPOINT OF THE LEWIS THEORY OF VALENCE. (англ.) // J. Am. Chem. Soc.. — 1920. — Vol. 42. — P. 1419–1433. — doi:10.1021/ja01452a015.
- ↑ Dominik Marx. Proton Transfer 200 Years after von Grotthuss: Insights fromAb Initio Simulations (англ.) // ChemPhysChem. — 2006. — Vol. 7. — P. 1848—1870. — doi:10.1002/cphc.200600128.
Литература[править | править код]
- Химическая Энциклопедия. Советская Энциклопедия. — М., 1988.
- В. В. Москва. Водородная связь в органической химии. Соросовский образовательный журнал, 11999,N 2, с.58-64 [3]
- Пиментел Дж., О. Мак-Клеллан. Водородная связь, пер. с англ.. — М., 1964.
- Эпштейн Л.М, Шубина Е.С. Многоликая водородная связь // «Природа». — 2003. — № 1.
- Водородная связь. Сб. ст.. — М., 1964.
- Pauling L. The chemical bond. — N. Y., 1967.
Ссылки[править | править код]
- Водородная связь — статья из энциклопедии «Кругосвет»
- Водородная связь / Иогансен А. В. // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
Источник
Как известно, атомы, имеющие большую электроотрицательность, имеют тенденцию притягивать к себе электроны менее электроотрицательного партнера, давая ему низкий положительный заряд (σ+). В случае с водородом этот заряд позволяет ему взаимодействовать с другим атомом. У второго атома должны присутствовать неподеленные электронные пары, которые позволят ему взаимодействовать с водородом. Механизм образования связи схож с ковалентной и может быть рассмотрен в качестве ее варианта.
Водородная связь
Это связь, образующаяся между атомом водорода, который уже связан с атомом, имеющим высокую электроотрицательность, и другим электроотрицательным атомом.
Можно представить структуру обсуждаемого явления так: сравнительно большие электроотрицательные атомы — это двое взрослых, которые держат за руки малыша-водорода. Наиболее распространенные кандидаты на роль «родителей» — это фтор, кислород и азот.
Свойства и типы водородных связей
Ковалентная и водородная связь сильно различаются по силе. Водородная значительно слабее, однако ее энергия и стабильность выше, чем у слабых межмолекулярных взаимодействий, таких как силы Ван-дер-Ваальса. Образование и разрушение водородной связи не требуют значительных затрат энергии, и она является достаточно стабильной при нормальных условиях. Подобная гибкость, обуславливает ее широкое распространение в молекулах, используемых живыми организмами, – «сборка» и «разборка» таких молекул легко осуществляется силами естественных энзимов. Можно выделить два подтипа обсуждаемой связи:
- внутримолекулярная – образуется между атомами одной молекулы;
- межмолекулярная – между атомами двух молекул.
Чтобы лучше понять, что к чему, давайте рассмотрим каждую из них.
Водородная связь: примеры
Две цепи ДНК, соединенные между собой при помощи большого количества водородных связей, — один из самых очевидных примеров внутримолекулярной водородной связи в биомолекулах. В процессе копирования, записи и восстановления генетической информации связи между цепями разрываются и соединяются множество раз на ограниченном участке молекулы.
Примерами веществ, между которыми образуются водородные связи могут служить спирты. Водородные связи, образующиеся между отдельными молекулами спиртов, обеспечивают им высокие точки кипения и плавления. Молекулы спиртов «держатся» друг за друга при помощи водородных связей, образуя более устойчивую структуру. Больше водородных связей – больше энергии необходимо для доведения вещества до кипения.
Обсуждаемые связи могут образовываться и между неорганическими молекулами, например, между молекулами воды. Рассмотрим этот случай подробнее.
Водородные связи в воде
Для начала давайте вспомним, как выглядит молекула воды. Она представляет собой атом кислорода, связанный с двумя атомами водорода и имеющий две неподеленные электронные пары – H2O. Каждый из атомов водорода может образовать связь с еще одной молекулой, из-за чего вода приобретает некоторые интересные свойства.
В числе прочего такая организация, позволяет воде иметь более высокую температуру кипения. Механизм достижения подобной стабильности по сути такой же, как и в спиртах. При температурах, превышающих ноль по шкале Цельсия, но ниже температуры кипения, молекулы воды образуют структуры, подобные изображенной на рисунке выше, но они представляют собой отдельные конгломерации, а не целостную структуру. При низкой температуре вода образует лед, в котором водородные связи присутствуют в полном объеме, образуя решетку. Ячейки решетки крупнее, чем молекула воды, что обеспечивает еще одно интересное свойство – более низкую плотность в твердом агрегатном состоянии.
Вода является отличным растворителем.
Полярные молекулы воды легко реорганизуются вокруг положительно или отрицательно заряженных ионов, поворачиваясь к ним соответствующей стороной. Особенно хорошо в воде растворяются другие водородосодержащие соединения, способные к образованию водородных связей с молекулами воды и самими собой. Поэтому спирты, а также аммиак и некоторые другие соединения способны растворяться в воде в колоссальных объемах.
Источник
Характерные особенности
Этот тип связи возникает в молекулах, когда их атом водорода, поляризованный положительно, взаимодействует с атомом другой молекулы, имеющим заряд отрицательный. Расстояние между атомами-участниками процесса должно оказаться меньше, чем сумма их радиусов. Выделяют два вида H-связей:
- Межмолекулярная. Возникает между различными молекулами веществ: для этого необходимо присутствие водорода и одного из элементов с хорошей способностью притягивать электроны других атомов. Высокая электроотрицательность фтора (F), кислорода (O), азота (N), хлора (Cl) и серы (S) служит этому надёжной поддержкой. Общие пары взаимодействующих электронов смещаются к атомам отрицательно заряженных элементов, а положительные электрические заряды водорода концентрируются в малых объёмах. Протоны взаимодействуют с электронными парами соседних атомов, что приводит к их обобществлению.
- Внутримолекулярная. Образуется в пределах одной молекулы, для чего в ней наряду с положительно заряженными атомами водорода должны присутствовать отрицательно поляризованные группы. Явление обнаруживается в природе у многоатомных спиртов, белков, углеводов и ряда других органических соединений.
Энергия H-связи обладает низкими прочностными характеристиками: она в несколько раз ниже, чем у остальных подобных взаимодействий. Это позволяет ей существовать промежуточным звеном между основными химическими связями (ковалентной, ионной и металлической) и силами притяжения и отталкивания Ван-дер-Ваальса, стремящимися удержать частицы в твёрдом или жидком состоянии. Кристаллические решётки с молекулами в узлах — характерная особенность веществ с водородной связью. Примеры можно привести различные:
- вода H2O в виде льда;
- кристаллы йода I;
- хлор Cl;
- бром Br;
- диоксид углерода CO2 в форме «сухого льда»;
- твёрдый аммиак NH3;
- конденсированная органика (метан CH4, бензол C6H6, фенол C6H5OH, нафталин C10H8, различные белки).
Механизм образования водородной связи считается смешанным — одновременно электростатическим и донорно-акцепторным. Решающая роль в этом принадлежит повышению электроотрицательности одного атома (A), позволяющей оттягивать в свою сторону электронную пару другого атома (H), принимающего участие в этом взаимодействии. В результате:
- первый атом приобретает частично отрицательный заряд (d-);
- второй участник заряжается положительно (d+);
- происходит поляризация химической связи (Аd-) — (Hd+).
Образовавшиеся атомы водорода, заряд которых частично положителен, обладают способностями притягивать другие молекулы, содержащие электроотрицательные группы. Эти электростатические взаимодействия и обуславливают появление Н-связей, для формирования которых необходимы три обязательных элемента:
- атом-донор протона;
- атом-акцептор протона;
- атом водорода Н.
Такое донорство в обычных условиях никогда не осуществляется на все 100%. Атом-донор остается химически связанным с водородом. Графически это обозначается в виде линии из точек, указывающей, что сила взаимодействия слабее ковалентной связи. Схема записи структуры выглядит следующим образом: Б ··· Нd+ – Аd-.
Только три химических элемента полностью проявляют донорские способности, и их атомы поставляют протоны для образования Н-связей: азот (N), кислород (O) и фтор (F). В атомах-акцепторах недостатка не наблюдается. Низкомолекулярным соединениям H-связь придаёт способность в обычных условиях иметь жидкое агрегатное состояние, как это происходит у этанола (C2H5OH), метанола (CH3OH) и воды (H2O), или становиться сжижающимися при охлаждении газами — аммиаком (NH3) и гидрофторидом (HF).
Проявление в неорганической химии
Определение «водородная связь» появилось в 1920 году. Его применили учёные Латимер и Родебуш для объяснения сущности аномалий, наблюдавшихся при кипении воды, предельных одноатомных спиртов и жидкого фтороводорода. При сопоставлении точек кипения в ряду водородсодержащих родственных соединений Н2O (вода), Н2S (сероводород), Н2Se (селеноводород) и Н2Te (теллуроводород) обнаружилось, что первый участник этого списка (H2O) переходит из жидкости в пар гораздо раньше, чем можно было бы ожидать, следуя закономерности, которой подчиняются остальные члены. Истинное значение точки кипения воды оказалось на 200° C выше ожидаемого.
Это справедливо и для другого ряда — NH3 (аммиак), PH3 (фосфин), H3As (арсин), Н3Sb (стибин), где фактическая (-33 °C) температура кипения аммиака на 80 градусов превышает ожидаемую. Если считать, что молекулы в жидкости удерживаются исключительно Ван-дер-Ваальсовыми силами, разрушающимися при переходе в газообразную фазу, то эти скачки не должны наблюдаться, а объяснить их невозможно.
Неожиданные повышения температур кипения привели к выводам о присутствии дополнительно связывающих молекулы сил, изменяющих физические свойства. Водородной связи принадлежит роль в создании аномальных температур кипения спиртов, если их сравнивать с аналогами без гидроксильных групп (-ОН). В перечне заслуг H-связей не только изменение точек кипения веществ, но и упрочнение их кристаллических решёток, вызывающее повышение температур плавления, поверхностного натяжения и вязкости.
Например, борная кислота с формулой H3BO3 имеет слоистую триклинную кристаллическую решётку, где каждая из молекул посредством H-связей крепится к трём другим. В результате образуются плоские слои, которые за счёт межмолекулярных связей создают кристаллическую структуру — «паркет» из шестиугольников.
При помощи инфракрасной спектроскопии сегодня можно достоверно выявить любой тип межмолекулярного взаимодействия: группы с Н-связями заметно отличаются по спектральным характеристикам от остальных случаев. Исследования структуры вещества помогают измерить дистанцию между водородом и атомом-акцептором, сравнить её с суммой радиусов и, если первое значение не превышает второе, доказать существование явления.
Понятие водных кластеров
Земля — чемпион по содержанию воды среди других планет Солнечной системы. Моря и океаны, реки и озёра, средние глубины которых достигают 6 тыс. метров, занимают 70% земной поверхности, а в областях полюсов сосредоточились огромные запасы влаги в виде снегов и льдов.
Трудно переоценить влияние воды на возникновение и существование жизни на нашей планете. Это связано с особенностями, нехарактерными для соединений, считающихся её близкими аналогами. Только вода находится в жидком и твёрдом состоянии при условиях, в которых водородные соединения серы или селена с большей атомной массой становятся газообразными.
Присутствие H-связей в молекулах воды обуславливает образование водных кластеров или комплексов, а димеры воды служат их простейшими примерами. Энергия их водородных связей ненамного больше энергии броуновского движения при нормальных условиях, но сильно отличается от мощности ковалентных связей в гидроксильных группах, а они в 200 раз превышают тепловые показатели. Вода из простой жидкости превращается в сложную, «связанную» сетью H-связей, хотя они относительно слабы и неустойчивы, самопроизвольно возникают и исчезают при температурных изменениях.
Кристаллическая структура льда имеет объёмную сетку из этих связей, и молекулы H2O расположены так, чтобы атомы водорода одних молекул оказывались направленными к атомам кислорода соседей. В ледяном кристалле между молекулами обязательно присутствуют пустоты, их объёмы немного превышают размеры отдельных молекул воды. Именно благодаря таким «карманам» плотность льда меньше, чем у его жидкой фазы, а гигантские айсберги остаются дрейфовать на поверхности, в то время как замерзание большинства других веществ существенно увеличивает их плотность.
Водородные связи сообщают воде уникальную характеристику, обеспечивающую существование разнообразных форм жизни в областях, где окружающие температуры опускаются ниже нуля. Если на минуту представить, что лёд начнёт тонуть в воде, то моря зимой рано или поздно промёрзнут до самого дна, и рыбы будут обречены на вымирание. Люди могли бы растапливать лёд для получения живительной влаги, но это потребует больших энергозатрат.
Ещё одно проявление H-связей — голубая окраска чистой воды в её толще. Колебание одной молекулы воды вызывает движение соседних частиц, соединенных с ней водородными связями. Красные лучи из состава солнечного спектра будут расходоваться на поддержание этих колебаний, поскольку больше всего соответствуют им энергетически. Происходит фильтрация красных лучей — их энергия поглощается и рассеивается в виде тепла колеблющимися молекулами.
Начинает проступать голубой участок спектра, уравновешивающий отсутствие красного. Вода самостоятельно окрасится в волшебный небесный цвет. Для этого необходимо, чтобы солнечные лучи прошли через двухметровую толщу чистой воды и потеряли достаточное количество красного спектра.
Значение для органических соединений
Многие органические вещества не могут растворяться в воде. Но если это происходит, то процесс не обходится без активного участия H-связей. Кислород и азот, главные доноры протонов, часто играют роли акцепторов. Органические соединения, содержащие O и N, легко растворяются в воде: здесь кислород и азот выступают в качестве атомов-акцепторов, а атомом-донором является кислород из молекул воды. Возникающие H-связи перемещают органическое вещество в раствор, «растаскивая» его на молекулы.
Просматривается эмпирическая закономерность: органическое соединение будет легко растворяться в воде, если в составе его молекул на каждый атом кислорода приходится не более 3 атомов углерода. Например, бензол C6H6 в воде растворяется плохо, но замена одной группы (-СН) на (-N) даёт пиридин С5Н5N, смешивающийся с водой в любых пропорциях.
Для неводных растворов, в которых растворителями служат органические вещества, тоже характерны H-связи. В них водород частично положительно поляризован, а поблизости обнаруживается молекула с сильным акцептором — чаще всего это бывает кислород. Жирные кислоты приобретают полезную способность растворяться в хлороформе HCCl3, а растворённый в ацетоне ацетилен получил важное техническое применение. Горючий газ C2H2 под давлением чувствителен к сотрясениям и взрывоопасен, но его растворение в ацетоне C3H6O позволяет безопасно хранить и транспортировать любые объёмы.
Трудно переоценить роль H-связей в прочных полимерных и биополимерных структурах. Целлюлоза (клетчатка древесины) в строении молекулы располагает гидроксильные группы по бокам полимерной структуры, в которой чередуются циклические фрагменты. Невысокая энергия единичной Н-связи, умноженная на количество по всей длине молекулярной цепи, вызывает в итоге мощное притяжение. Из-за этого целлюлозу можно растворить только в высокополярных растворителях — дигидроксотетрааммиакате меди, известном как реактив Швейцера.
Карбонильные (=C=O) и аминогруппы (-NH2) в расположенных рядом полимерных цепочках капрона и нейлона тоже образуют связи этого типа и увеличивают механическую прочность веществ, поскольку в полиамидных структурах создаются кристаллические фрагменты. Аналогично ведут себя полиуретаны и белки: витки белковых спиралей закрепляются всё теми же H-связями, возникающими при взаимодействии функциональных групп.
Полимерная макромолекула ДНК — хранилище запасов информации о живом организме, зашифрованной в чередующихся фрагментарных циклах. Их карбонильные и аминогруппы имеют четыре типа азотистых оснований (аденин A, гуанин G, тимин T, цитозин C) и располагаются в форме боковых ответвлений по длине молекулы. От порядка их чередования зависят индивидуальные особенности всего живого на планете. Взаимодействия пар в составе аминогруппы и атома азота дают начало множеству Н-связей, которые удерживают 2 молекулы ДНК в виде классической двойной спирали.
Источник
