Какая существует связь между структурой воды и ее свойствами

Вода является источником жизни для всех живых организмов.
Молекула воды имеет уникальное строение. В ней удивительным образом сочетаются прочность и устойчивость кристаллической структуры (льда), и подвижность жидкого вещества.
В статье мы подробно рассмотрим особенности строения молекулы воды в различных агрегатных состояниях: жидком, твердом, газообразном.
Какое строение имеет молекула воды
Долгое время химики считали воду простым соединением, не вступающим в сложные реакции.
Состав воды как сложного вещества был установлен Лавуазье в 1783 г.
Одна молекула воды состоит из трех атомов: двух атомов водорода и одного атома кислорода, которые соединены между собой ковалентной связью. Химическая формула: H₂O
Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость. Они определяют химические и физические свойства соединений.

Молекула воды, картинка № 1
По форме молекула воды напоминает равнобедренный треугольник, в основании которого находятся два атома водорода.Связь между атомом кислорода и атомами водорода полярная, т.к. кислород притягивает электроны сильнее, чем водород.
Межъядерные расстояния О—Н близки к 0,1 нм, расстояние между ядрами атомов водорода равно 0,15 нм, угол между связями Н—О—Н равен 104,5°.
Молекула воды имеет два положительных и два отрицательных полюса и поэтому в большинстве случаев ведёт себя как диполь (т.е. на одной стороне – положительный заряд, на другой – отрицательный)
Значения эффективных зарядов на атомах составляет ±0,17 от заряда электрона.
Водородная связь
В жидкой воде происходит ассоциация молекул, т. е. соединение их в более сложные агрегаты за счёт особой химической связи, которая называется водородной.
Особенностями водородной связи, по которым её выделяют в отдельный вид, является её не очень высокая прочность.
Водородная связь также играет важную роль в процессах растворения, поскольку растворимость зависит и от способности соединения давать водородные связи с растворителем. В результате содержащие ОН-группы такие вещества, как сахар, глюкоза, спирты, карбоновые кислоты, как правило, хорошо растворимы в воде.

На картинке № 2 показано образование димера воды с одной водородной связью.
Димер — это две молекулы Н2О, соединенные водородной связью. Связь между молекулами воды водородная.
Каждая молекула способна образовать четыре водородные связи: две между неподеленными электронными парами её атома кислорода и атомами водорода соседних молекул и ещё две – между атомами водорода и атомами кислорода двух других молекул.
Энергия водородной связи может изменяться от 17 до 33 кДж/моль.
Строение молекулы в различных агрегатных состояниях
Вода может быть в нескольких состояниях:
- Жидком. Это ее преимущественное состояние в нормальных условиях. Жидкая вода образует многочисленные реки, ручьи, озёра, Мировой океан.
- Твердом – это лед, а его кристаллы часто образуют иней или снег.
- Газообразном — водяной пар.
Существуют также и переходные состояния жидкости, которые возникают при замерзании или испарении.
Примечательно, что различные формы воды могут одновременно находиться рядом и даже взаимодействовать, например реки с ледниками, айсберги с морской водой, облака на небе с водяным паром.
Строение молекулы воды, водородная связь способствует расположению молекул воды. Рассмотрим особенности каждого агрегатного состояния по отдельности.

Лед
Представляет собой твердое состояние воды.
Молекулы воды образуют слои, причём каждая молекула связана с тремя молекулами в своём слое и с одной молекулой соседнего слоя. Расстояние между атомами кислорода ближайших молекул равно 0,276 нм.
Атом кислорода связан с четырьмя атомами водорода: с двумя, расположенными на расстоянии 0,096 — 0,102 нм посредством валентных связей, и с двумя другими, находящимися на расстоянии 0,174 — 0,180 нм посредством водородных связей.

Жидкая вода
В отличие от структуры льда структура жидкой воды исследована ещё недостаточно.
Предполагается, что жидкая вода по своему строению представляет нечто среднее между кристаллами льда и паром.
В результате изучения молекулы воды с помощью инфракрасных и рентгеновых лучей было видно, что при температуре близкой к точке замерзания, молекулы жидкой воды собираются в небольшие группы, практически так, как в кристаллах.
При температуре близкой к точке кипения они располагаются более свободно.
Водяной пар
Это газообразное агрегатное состояние воды.
При данном состоянии молекула воды не имеет структуры и состоит преимущественно из мономерных молекул воды, которые находятся на расстояние относительно друг друга.
Из чего состоит вода
При обычных условиях вода выглядит как прозрачная жидкость. У нее отсутствуют вкус и запах. При небольшой толщине слоя не наблюдается даже цвета.
Вода является отличным растворителем. В природе в ней постоянно находятся растворенные газы и соли. При соединении атомов кислорода с водородом получается молекула воды. Поскольку более сильными являются водородные соединения, то, когда происходит их разрыв, они прикрепляются к иным веществам, помогая тем растворяться.
Из-за своего малого размера каждую молекулу растворенного вещества окружают очень много молекул воды. Благодаря этому в ней присутствуют отрицательные и положительные ионы.
Чистая вода является еще и хорошим изолятором с концентрацией протонов и гидроксильных ионов в количестве 10-7 моль/л, это позволяет ей проводить электричество. Именно по ее электропроводности можно оценивать чистоту жидкости.
При взаимодействии с другими веществами состав воды не изменяется, что играет особую роль в жизни любого живого организма. Ведь очень важно, чтобы жидкостные растворы, через которые в организм поступают полезные вещества, не изменялись.
Кроме того, вода хорошо поглощает инфракрасное и микроволновое излучение, а также способна хранить в себе память о веществах, которые были в ней растворены.
Элементы
Проходя гидрологический цикл: испарение, конденсацию и выпадение в виде осадков вода может дополняться разными химическими элементами, которые можно разделить на 6 категорий. Рассмотрим информацию в таблице № 1.
Таблица № 1 «Элементы, которые могут входить в состав воды».
| Ионы | Na, K, Mg, Ca, анионы: Cl, HCO3 и SO4. Эти компоненты находятся в воде в наибольшем, по сравнению с другими, количестве. |
| Растворенные газы | Кислород, азот, сероводород, углекислый газ и прочие. Количество каждого газа в воде напрямую зависит от ее температуры. |
| Биогенные элементы | Главными из них являются фосфор и азот, которые поступают в жидкость из осадков |
| Микроэлементы | Их насчитывается около 30 видов: бром, селен, медь, цинк и т. д. Показатели их в составе воды очень малы и колеблются от 0,1 до микрограмма на 1 литр. |
| Органические вещества | Спирты, углеводы, альдегиды, фенолы, пептиды и прочее. |
| Токсины | Тяжелые металлы и продукты нефтепереработки. |
В настоящий момент доступны специальные методы очистки, которые эффективно борются с вредными химическими соединениями.
Вода также может содержать в себе магний и катионы кальция. В зависимости от этого ее подразделяют на мягкую и жесткую.
По изотопам водорода в молекуле воды можно говорить о легкой воде, тяжелой и сверхтяжелой воде.
Подводим итоги
Вода необходима для жизни всего живого на Земле. Она участвует в мировом круговороте воды в природе. Благодаря испарению с поверхности водоемов, почвы, растений образуются облака. Затем они выпадают в виде дождя, снега, града, питая собой подземные воды и родники. Родниковые воды по рекам попадает в море.
Таким образом, количество воды на Земле не изменяется, она только меняет свои формы — это и есть круговорот воды в природе.
Уникальное строение молекулы воды помогает ей трансформироваться в три агрегатных состояния.
При замерзании воды ее молекулы собираются в небольшие группы. При испарении находится на расстоянии относительно друг друга. Жидкая вода по своему строению представляет нечто среднее между кристаллами льда и паром.
Список литературы
- Химия и микробиология воды. Учебное пособие В. В. Котов, Г.А. Нетесова
- Конспект лекций ГИДРОГЕОХИМИЯ. Киреева Т.А., МГУ им. М.В. Ломоносова, 2016
Источник
1. Один атом кислорода в воде соединен ковалентными связями с парой атомов водорода. Поэтому каждый атом водорода приобретает частично положительный заряд, а атом кислорода частично отрицательный.
2. Между отрицательно заряженным атомом кислорода одной молекулы воды и положительно заряженным атомом водорода другой молекулы имеется водородная связь. Потому молекулы воды и связаны друг с другом.
3. Водородные связи легко разрушаются — они в 20 раз слабее ковалентных связей. Поэтому молекулы воды подвижны в клетке и организме.
4. Водородные связи также обусловливают высокую температуру кипения воды, теплоемкость
(способность поглощать тепло при минимальном колебании собственной температуры).
Роль воды в живой системе — клетке
1. Молекула воды — это диполь, так как в области атомов водорода преобладает заряд положительный, а в области атома кислорода выше плотность отрицательного заряда.
2. Угол связи H-O-H в молекуле воды составляет 104,5 градуса, поэтому положительный и отрицательный заряды сосредоточены на разных концах молекулы. И именно поэтому вода — прекрасный растворитель полярных веществ.
3. Вода вообще является универсальным растворителем благодаря своей способности образовывать гидраты.
4. Вода способна на ориентирование в электрическом поле, она может присоединиться к различным молекулам и участкам молекул, несущим заряд, — при этом образуются гидраты. Если силы притяжения внутри молекулы воды меньше, чем силы притяжения молекул воды к молекулам иного вещества, это вещество растворятся в воде.
5. Поэтому выделяют гидрофильные вещества — они хорошо растворимы в воде: соли, щелочи, кислоты. Данные вещества диссоциируют на заряженные частицы — катионы и анионы. Молекулы воды взаимодействуют с ними.
6. Кроме полярных соединений к гидрофильным веществам относятся также сахара, аминокислоты, спирты — неполярные соединения, в составе которых имеются полярные группы (OH, различные радикалы).
7. Гидрофобные вещества — с трудом или вовсе не растворяются в воде. К ним относятся жиры, жироподобные вещества, бензин, парафин, каучук. Жироподобные вещества находятся, например, внутри клеточных мембран, ограничивая исход растворенных веществ из клетки в окружающую среду и проникновение обратно.
8. Вода — участник многих реакций в клетке, ведь большинство реакций идут как раз в водном растворе. Белки, липиды, углеводы и другие органические вещества расщепляются в результате работы ферментов и взаимодействия с водой до более простых веществ в результате реакций гидролиза.
9. В связи с высокой теплоемкостью вода отлично поддерживает тепловое равновесие в клетке, и при сильном повышении температуры среды вода нагревается медленно, но долго сохраняет тепло. Организмы защищены водой от резких колебаний температуры окружающей среды, поэтому процессы обмена веществ могут происходить в стабильных условиях.
10. Вода имеет относительно высокую для жидкостей теплопроводность. Тепло равномерно распределяется по всему объему воды в клетке, препятствуя перегреванию в отдельных точках.
11. Испарение
воды обеспечивает охлаждение именно всей поверхности клетки, так как на разрыв водородных связей тратится энергия. Таким образом, вода участвует в терморегуляции.
12. Вода — источник кислорода, который растения выделяют в атмосферу.
13. Вода — источник водорода, который используется для синтеза органических веществ растениями.
14. Вода — среда для транспорта веществ
в организме. Она обеспечивает ток лимфы и крови, восходящие и нисходящие токи растворов по древесине и лубу у растений. В клетках вещества, растворенные в воде, транспортируются через клеточные мембраны. Транспортные функции воды обеспечиваются ее низкой вязкостью и высокой подвижностью.
15. В клетке различают воду свободную (ее 90 процентов) и связанную (10 процентов). Связанная вода участвует в образовании макромолекул и никогда не теряется живой клеткой. Вода определяет объем и тургор клеток и тканей. Тургор
— напряженное состояние плазматической мембраны, вызванное давлением воды внутри клетки.
16. Вода характеризуется высоким поверхностным натяжением — этим обеспечивается сцепление ее молекул. Благодаря такому свойству молекулы воды передвигаются по проводящим тканям растений, а также некоторые животные двигаются по поверхности воды. Например, клоп-водомерка при передвижении использует именно поверхностное натяжение воды. На первой и третьей паре ног у него есть специальные волоски, которые не продавливают слой воды, а держат жука на поверхности.
17. При замерзании воды ее объем возрастает, а плотность уменьшается, поэтому вода в виде льда всплывает на поверхность водоема. Максимальную плотность вода имеет при температуре 4 градуса, а при 0 она имеет меньшую плотность. Зимой часть воды в реках превращается в более легкий лед, который всплывает на поверхность и создает защиту для речных обитателей, препятствуя промерзанию толщи воды. При этом более теплая и плотная вода (с температурой не ниже 4 градусов) концентрируется под покровом льда, создавая условия для выживания водных животных. Поздней осенью, при понижении температуры ниже 4 градусов в клетках растений образуются кристаллы льда и они погибают. Чтобы выжить, многие растения накапливают в тканях белки и сахара, благодаря чему вода с растворенными в ней органическими веществами не замерзает, и растения благополучно переносят холода.
Источник
Самое важное, уникальное по свойствам и составу вещество нашей планеты – это, конечно, вода. Ведь именно благодаря ей на Земле жизнь есть, в то время как на других известных сегодня объектах Солнечной системы ее нет. Твердая, жидкая, в виде пара – она нужна и важна любая. Вода и ее свойства составляют предмет изучения целой научной дисциплины – гидрологии.
Количество воды на планете
Если рассматривать показатель количества данного оксида во всех агрегатных состояниях, то его на планете около 75% от общей массы. При этом следует учитывать связанную воду в органических соединениях, живых существах, минералах и прочих элементах.

Если учитывать только жидкое и твердое состояние воды, показатель падет до 70,8%. Рассмотрим, как распределяются эти проценты, где содержится рассматриваемое вещество.
- Соленой воды в океанах и морях, солончаковых озерах на Земле 360 млн км2.
- Пресная вода распределена неравномерно: ее в ледниках Гренландии, Арктики, Антарктиды заковано во льды 16,3 млн км2.
- В пресных реках, болотах и озерах сосредоточено 5,3 млн км2 оксида водорода.
- Подземные воды составляют 100 млн м3.
Именно поэтому космонавтам из далекого космического пространства видно Землю в форме шара голубого цвета с редкими вкраплениями суши. Вода и ее свойства, знание особенностей строения являются важными элементами науки. К тому же, в последнее время человечество начинает испытывать явную нехватку пресной воды. Может быть, такие знания помогут в решении данной проблемы.
Состав воды и строение молекулы
Если рассмотреть эти показатели, то сразу станут понятны и свойства, которые проявляет это удивительное вещество. Так, молекула воды состоит из двух атомов водорода и одного атома кислорода, поэтому имеет эмпирическую формулу Н2О. Кроме того, при построении самой молекулы большую роль играют электроны обоих элементов. Посмотрим, что собой представляют структура воды и ее свойства.
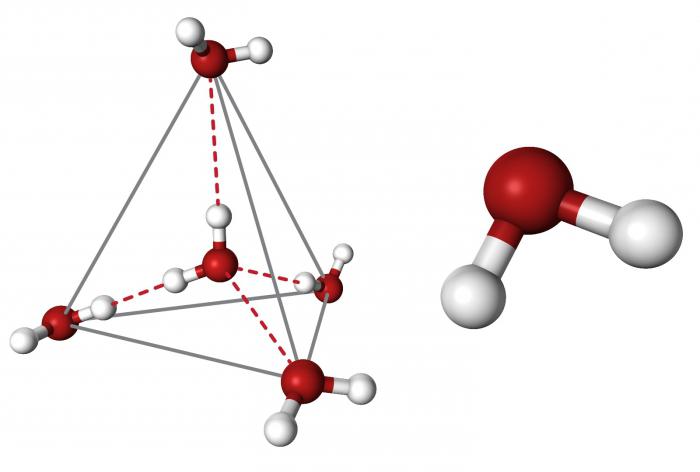
Очевидно, что каждая молекула ориентирована вокруг другой, и все вместе они формируют общую кристаллическую решетку. Интересно то, что оксид построен в форме тетраэдра – атом кислорода в центре, а две пары электронов его и два атома водорода вокруг асимметрично. Если провести через центры ядер атомов линии и соединить их, то получится именно тетраэдрическая геометрическая форма.
Угол между центром атома кислорода и ядрами водородов составляет 104,5 0С. Длина связи О-Н = 0,0957 нм. Наличие электронных пар кислорода, а также его большее в сравнении с водородами сродство к электрону обеспечивают формирование в молекуле отрицательно заряженного поля. В противовес ему ядра водородов образуют положительно заряженную часть соединения. Таким образом, выходит, что молекула воды – диполь. Это определяет то, какой может быть вода, и ее физические свойства также зависят от строения молекулы. Для живых существ эти особенности играют жизненно важную роль.
Основные физические свойства
К таковым принято относить кристаллическую решетку, температуры кипения и плавления, особенные индивидуальные характеристики. Все их и рассмотрим.
- Строение кристаллической решетки оксида водорода зависит от агрегатного состояния. Оно может быть твердым – лед, жидким – основная вода при обычных условиях, газообразным – пар при повышении температуры воды свыше 100 0С. Красивые узорные кристаллы формирует лед. Решетка в целом рыхлая, но соединение очень прочное, плотность низкая. Видеть ее можно на примере снежинок или морозных узоров на стеклах. У обычной воды решетка не имеет постоянной формы, она изменяется и переходит из одного состояния в другое.
- Молекула воды в космическом пространстве имеет правильную форму шара. Однако под действием земной силы тяжести она искажается и в жидком состоянии принимает форму сосуда.
- То, что по структуре оксид водорода – диполь, обуславливает следующие свойства: высокая теплопроводность и теплоемкость, которая прослеживается в быстром нагревании и долгом остывании вещества, способность ориентировать вокруг себя как ионы, так и отдельные электроны, соединения. Это делает воду универсальным растворителем (как полярным, так и нейтральным).
- Состав воды и строение молекулы объясняют способность этого соединения образовывать множественные водородные связи, в том числе с другими соединениями, имеющими неподеленные электронные пары (аммиак, спирт и прочие).
- Температура кипения жидкой воды – 1000С, кристаллизация наступает при +40С. Ниже этого показателя – лед. Если же увеличивать давление, то температура кипения воды резко возрастет. Так, при высоких атмосферах в ней можно растопить свинец, но она при этом даже не закипит (свыше 3000С).
- Свойства воды весьма значимы для живых существ. Например, одно из самых важных – поверхностное натяжение. Это формирование тончайшей защитной пленки на поверхности оксида водорода. Речь идет о воде в жидком состоянии. Эту пленку разорвать механическим воздействием очень сложно. Учеными установлено, что понадобится сила, равная весу в 100 тонн. Как ее заметить? Пленка очевидна, когда вода капает из крана медленно. Видно, что она словно в какой-то оболочке, которая растягивается до определенного предела и веса и отрывается в виде круглой капельки, слегка искаженной силой тяжести. Благодаря поверхностному натяжению многие предметы могут находиться на поверхности воды. Насекомые, имеющие особые приспособления, могут свободно передвигаться по ней.
- Вода и ее свойства аномальны и уникальны. По органолептическим показателям данное соединение – бесцветная жидкость без вкуса и запаха. То, что мы называем вкусом воды, – это растворенные в ней минералы и другие компоненты.
- Электропроводность оксида водорода в жидком состоянии зависит от того, сколько и каких солей в нем растворены. Дистиллированная вода, не содержащая никаких примесей, электрический ток не проводит.
Лед – это особое состояние воды. В структуре этого ее состояния молекулы связаны друг с другом водородными связями и формируют красивую кристаллическую решетку. Но она достаточно неустойчива и легко может расколоться, растаять, то есть деформироваться. Между молекулами сохраняется множество пустот, размеры которых превышают размеры самих частиц. Благодаря этому плотность льда меньше, чем жидкого оксида водорода.

Это имеет большое значение для рек, озер и прочих пресных водоемов. Ведь в зимний период вода в них не замерзает полностью, а лишь покрывается плотной коркой более легкого льда, всплывающего наверх. Если бы данное свойство не было характерно для твердого состояния оксида водорода, то водоемы промерзали бы насквозь. Жизнь под водой была бы невозможна.
Кроме того, твердое состояние воды имеет большое значение как источник огромного количества питьевых пресных запасов. Это ледники.
Особенным свойством воды можно назвать явление тройной точки. Это такое состояние, при котором лед, пар и жидкость могут существовать одновременно. Для этого требуются такие условия, как:
- высокое давление – 610 Па;
- температура 0,010С.
Показатель прозрачности воды варьируется в зависимости от посторонних примесей. Жидкость может быть полностью прозрачной, опалесцентной, мутной. Поглощаются волны желтого и красного цветов, глубоко проникают лучи фиолетовые.

Химические свойства
Вода и ее свойства – важный инструмент в понимании многих процессов жизнедеятельности. Поэтому они изучены очень хорошо. Так, гидрохимию интересуют вода и ее химические свойства. Среди них можно назвать следующие:
- Жесткость. Это такое свойство, которое объясняется наличием солей кальция и магния, их ионов в растворе. Подразделяется на постоянную (соли названных металлов: хлоридов, сульфатов, сульфитов, нитратов), временную (гидрокарбонаты), которая устраняется кипячением. В России воду перед использованием смягчают химическим путем для лучшего качества.
- Минерализация. Свойство, основанное на дипольном моменте оксида водорода. Благодаря его наличию молекулы способны присоединять к себе множество других веществ, ионов и удерживать их. Так формируются ассоциаты, клатраты и прочие объединения.
- Окислительно-восстановительные свойства. Как универсальный растворитель, катализатор, ассоциат, вода способна взаимодействовать с множеством простых и сложных соединений. С одними она выступает в роли окислителя, с другими – наоборот. Как восстановитель реагирует с галогенами, солями, некоторыми менее активными металлами, с многими органическими веществами. Последние превращения изучает органическая химия. Вода и ее свойства, в частности, химические, показывают, насколько она универсальна и уникальна. Как окислитель она вступает в реакции с активными металлами, некоторыми бинарными солями, многими органическими соединениями, углеродом, метаном. Вообще химические реакции с участием данного вещества нуждаются в подборе определенных условий. Именно от них и будет зависеть исход реакции.
- Биохимические свойства. Вода является неотъемлемой частью всех биохимических процессов организма, являясь растворителем, катализатором и средой.
- Взаимодействие с газами с образованием клатратов. Обычная жидкая вода может поглощать даже неактивные химически газы и располагать их внутри полостей между молекулами внутренней структуры. Такие соединения принято называть клатратами.
- Со многими металлами оксид водорода формирует кристаллогидраты, в которые он включен в неизменном виде. Например, медный купорос (CuSO4*5H2O), а также обычные гидраты (NaOH*H2O и другие).
- Для воды характерны реакции соединения, при которых происходит образование новых классов веществ (кислот, щелочей, оснований). Они не являются окислительно-восстановительными.
- Электролиз. Под действием электрического тока молекула разлагается на составные газы – водород и кислород. Один из способов получения их в лаборатории и промышленности.
С точки зрения теории Льюиса вода – это слабая кислота и слабое основание одновременно (амфолит). То есть можно сказать о некоей амфотерности в химических свойствах.

Вода и ее полезные свойства для живых существ
Сложно переоценить то значение, которое имеет оксид водорода для всего живого. Ведь вода и есть сам источник жизни. Известно, что без нее человек не смог бы прожить и недели. Вода, ее свойства и значение просто колоссальны.
- Это универсальный, то есть способный растворять и органические, и неорганические соединения, растворитель, действующий в живых системах. Именно поэтому вода – источник и среда для протекания всех каталитических биохимических преобразований, с формированием сложных жизненно важных комплексных соединений.
- Способность образовывать водородные связи делает данное вещество универсальным в выдерживании температур без изменения агрегатного состояния. Если бы это было не так, то при малейшем снижении градусов она превращалась бы в лед внутри живых существ, вызывая гибель клеток.
- Для человека вода – источник всех основных бытовых благ и нужд: приготовление пищи, стирка, уборка, принятие ванны, купание и плавание и прочее.
- Промышленные заводы (химические, текстильные, машиностроительные, пищевые, нефтеперерабатывающие и другие) не сумели бы осуществлять свою работу без участия оксида водорода.
- Издревле считалось, что вода – это источник здоровья. Она применялась и применяется сегодня как лечебное вещество.
- Растения используют ее как основной источник питания, за счет чего они продуцируют кислород – газ, благодаря которому существует жизнь на нашей планете.
Можно назвать еще десятки причин того, почему вода – это самое широко распространенное, важное и необходимое вещество для всех живых и искусственно созданных человеком объектов. Мы привели только самые очевидные, главные.

Гидрологический цикл воды
Иными словами, это ее круговорот в природе. Очень важный процесс, позволяющий постоянно пополнять исчезающие запасы воды. Как он происходит?
Основных участников трое: подземные (или грунтовые) воды, поверхностные воды и Мировой океан. Важна также и атмосфера, конденсирующая и выдающая осадки. Также активными участниками процесса являются растения (в основном деревья), способные поглощать огромное количество воды в сутки.
Итак, процесс происходит следующим образом. Грунтовые воды заполняют подземные капилляры и стекаются к поверхности и Мировому океану. Затем поверхностные воды поглощаются растениями и транспирируются в окружающую среду. Также происходит испарение с огромных площадей океанов, морей, рек, озер и прочих водоемов. Попав в атмосферу, вода что делает? Конденсируется и проливается обратно в виде осадков (дождь, снег, град).
Если бы не происходили эти процессы, то запасы воды, особенно пресной, давно бы уже закончились. Именно поэтому охране и нормальному гидрологическому циклу уделяется людьми большое внимание.
Понятие о тяжелой воде
В природе оксид водорода существует в виде смеси изотопологов. Это связано с тем, что водород формирует три вида изотопа: протий 1Н, дейтерий 2Н, тритий 3Н. Кислород, в свою очередь, также не отстает и образует три устойчивые формы: 16О, 17О, 18О. Именно благодаря этому существует не просто обычная протиевая вода состава Н2О (1Н и 16О), но еще и дейтериевая, и тритиевая.

При этом устойчива по структуре и форме именно дейтериевая (2Н), которая включается в состав практически всех природных вод, но в малом количестве. Именно ее называют тяжелой. Она несколько отличается от обычной или легкой по всем показателям.
Тяжелая вода и ее свойства характеризуются несколькими пунктами.
- Кристаллизуется при температуре 3,82 0С.
- Кипение наблюдается при 101,42 0С.
- Плотность составляет 1,1059 г/см3.
- Как растворитель в несколько раз хуже легкой воды.
- Имеет химическую формулу D2O.
При проведении опытов, показывающих влияние подобной воды на живые системы, было установлено, что жить в ней способны лишь некоторые виды бактерий. Для приспособления и акклиматизации колониям потребовалось время. Но, приспособившись, они полностью восстановили все жизненно важные функции (размножение, питание). Кроме того, стали очень устойчивы к воздействию радиоактивного излучения. Опыты на лягушках и рыбах положительного результата не дали.
Современные области применения дейтерия и образованной им тяжелой воды – атомная и ядерная энергетика. Получить в лабораторных условиях такую воду можно при помощи электролиза обычной – она образуется как побочный продукт. Сам дейтерий формируется при многократных перегонках водорода в специальных устройствах. Применение его основано на способности замедлять нейтронные синтезы и протонные реакции. Именно тяжелая вода и изотопы водорода – основа для создания ядерной и водородной бомбы.
Опыты на применении дейтериевой воды людьми в небольших количествах показали, что задерживается она недолго – полный вывод наблюдается через две недели. Употреблять ее в качестве источника влаги для жизни нельзя, однако техническое значение просто огромно.
Талая вода и ее применение
Свойства такой воды издревле были определены людьми как целебные. Давно было замечено, что при таянии снега животные стараются напиться водой из образовавшихся лужиц. Позже были тщательно исследованы ее структура и биологическое воздействие на организм человека.

Талая вода, ее признаки и свойства находятся посередине между обычной легкой и льдом. Изнутри она образована не просто молекулами, а набором кластеров, сформированных кристаллами и газом. То есть внутри пустот между структурными частями кристалла находятся водород и кислород. По общему виду строение талой воды сходно со строением льда – сохраняется структурность. Физические свойства такого оксида водорода незначительно меняются в сравнении с обычным. Однако биологическое воздействие на организм отличное.
При замораживании воды первой фракцией превращается в лед более тяжелая часть – это дейтериевые изотопы, соли и примеси. Поэтому эту сердцевину следует удалять. А вот остальная часть – чистая, структурированная и полезная вода. Каково воздействие на организм? Учеными Донецкого НИИ были названы следующие виды улучшений:
- Ускорение восстановительных процессов.
- Укрепление иммунитета.
- У детей после ингаляций такой водой происходит восстановление и излечение простудных заболеваний, проходит кашель, насморк и прочее.
- Улучшается дыхание, состояние гортани и слизистых оболочек.
- Общее самочувствие человека, активность повышаются.
Сегодня существует ряд сторонников лечения именно талой водой, которые пишут свои положительные отзывы. Однако есть ученые, в том числе медики, которые эти взгляды не поддерживают. Они считают, что вреда от такой воды не будет, но и пользы мало.
Энергетика
Почему свойства воды могут изменяться и восстанавливаться при переходе в разные агрегатные состояния? Ответ на этот вопрос следующий: у данного соединения существует своя информационная память, которая записывает все изменения и приводит к восстановлению структуры и свойств в нужное время. Биоэнергетическое поле, через которое проходит часть воды (та, что поступает из космоса), несет в себе мощный заряд энергии. Эту закономерность часто используют при лечении. Однако с медицинской точки зрения не каждая вода способна оказать благоприятный эффект, в том числе и информационный.
Структурированная вода – что это?
Это такая вода, которая имеет несколько иное строение молекул, расположение кристаллических решеток (такое, которое наблюдается у льда), но это все же жидкость (талая также относится к этому типу). В этом случае состав воды и ее свойства с научной точки зрения не отличаются от тех, что характерны для обычного оксида водорода. Поэтому структурированная вода не может иметь такого широкого лечебного эффекта, который ей приписывают эзотерики и сторонники нетрадиционной медицины.
Источник
