Какая особенность строения металлов определяет их физические свойства

Физические свойства металлов отличают их от неметаллов. Все металлы, кроме ртути, – твёрдые кристаллические вещества, являющиеся восстановителями в окислительно-восстановительных реакциях.

Положение в таблице Менделеева
Металлы занимают I-II группы и побочные подгруппы III-VIII групп. Металлические свойства, т.е. способность отдавать валентные электроны или окисляться, увеличиваются сверху вниз по мере увеличения количества энергетических уровней. Слева направо металлические свойства ослабевают, поэтому наиболее активные металлы находятся в I-II группах, главных подгруппах. Это щелочные и щелочноземельные металлы.
Определить степень активности металлов можно по электрохимическому ряду напряжений. Металлы, стоящие до водорода, наиболее активны. После водорода стоят слабоактивные металлы, не вступающие в реакцию с большинством веществ.

Рис. 1. Электрохимический ряд напряжений металлов.
Строение
Вне зависимости от активности все металлы имеют общее строение. Атомы в простом металле расположены не хаотично, как в аморфных веществах, а упорядоченно – в виде кристаллической решётки. Удерживает атомы в одном положении металлическая связь.
Такой вид связи осуществляется за счёт положительно заряженных ионов, находящихся в узлах кристаллической ячейки (единицы решётки), и отрицательно заряженных свободных электронов, которые образуют так называемый электронный газ. Электроны отделились от атомов, превратив их в ионы, и стали перемещаться в решётке хаотично, скрепляя ионы вместе. Без электронов решётка бы распалась за счёт отторжения одинаково заряженных ионов.
Различают три типа кристаллической решётки. Кубическая объемно-центрированная состоит из 9 ионов и характерна хрому, железу, вольфраму. Кубическая гранецентрированная включает 14 ионов и свойственная свинцу, алюминию, серебру. Из 17 ионов состоит гексагональная плотноупакованная решётка цинка, титана, магния.
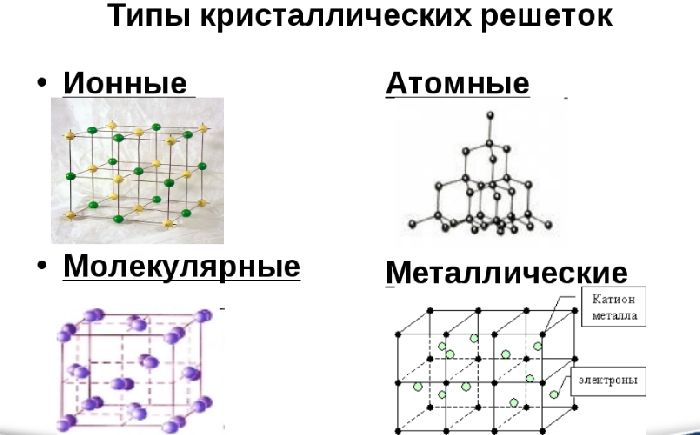
Рис. 2. Виды кристаллических решёток.
Свойства
Строение кристаллической решётки определяет основные физические и химические свойства металлов. Металлы блестят, плавятся, проводят тепло и электричество. Промышленность и металлургия нашли применение физическим свойствам металлов в изготовлении деталей, фольги, корпусов машин, зеркал, бытовой и промышленной химии. Особенности металлов и их использование представлены в таблице физических свойств металлов.
Свойства | Особенности | Примеры | Применение |
Металлический блеск | Способность отражать солнечный свет | Наиболее блестящими металлами являются Hg, Ag, Pd | Изготовление зеркал |
Плотность | Лёгкие – имеют плотность меньше 5 г/см3 | Na, K, Ba, Mg, Al. Самый лёгкий металл – литий с плотностью 0,533 г/см3 | Изготовление облицовки, деталей самолётов |
Тяжёлые – имеют плотность больше 5 г/см3 | Sn, Fe, Zn, Au, Pb, Hg. Самый тяжёлый – осмий с плотностью 22,5 г/см3 | Использование в сплавах | |
Пластичность | Способность изменять форму без разрушений (можно раскатать в тонкую фольгу) | Наиболее пластичные – Au, Cu, Ag. Хрупкие – Zn, Sn, Bi, Mn | Формовка, сгибание труб, изготовление проволоки |
Твёрдость | Мягкие – режутся ножом | Na, K, In | Изготовление мыла, стекла, удобрений |
Твёрдые – сравнимы по твёрдости с алмазом | Самый твёрдый – хром, режет стекло | Изготовление несущих конструкций | |
Температура плавления | Легкоплавкие – температура плавления ниже 1000°С | Hg (38,9°С), Ga (29,78°С), Cs (28,5°С), Zn (419,5°C) | Производство радиотехники, жести |
Тугоплавкие – температура плавления выше 1000°С | Cr (1890°С), Mo (2620°С), V (1900°С). Наиболее тугоплавкий – вольфрам (3420°С) | Изготовление ламп накаливания | |
Теплопроводность | Способность передавать тепло другим телам | Лучше всего проводят ток и тепло Ag, Cu, Au, Al | Приготовление пищи в металлической посуде |
Электропроводность | Способность проводить электрический ток за счёт свободных электронов | Передача электричества по проводам |
Рис. 3. Примеры применения металлов.
Что мы узнали?
Из урока 9 класса узнали о физических свойствах металлов. Кратко рассмотрели положение металлов в периодической таблице и особенности строения кристаллической решётки. Благодаря строению металлы обладают пластичностью, твёрдостью, способностью плавиться, проводить электрический ток и тепло. Свойства металлов неоднородны. Различают лёгкие и тяжёлые металлы, лёгкоплавкие и тугоплавкие, мягкие и твёрдые. Физические свойства используются для изготовления сплавов, электрических проводов, посуды, мыла, стекла, конструкций различной формы.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
-

Лидия Маслова
10/10
Оценка доклада
Средняя оценка: 4.2. Всего получено оценок: 137.
Источник
Металлы – твёрдые элементы, сплавы которых широко применяются в промышленности, строительстве и повседневной жизни. Пластичность, твёрдость, тепло- и электропроводность, а также способность к плавке и ковке обусловлены строением металлов.

Строение
Электронное строение атома металла включает:
- положительно заряженное ядро;
- отрицательно заряженные электроны.
Ядро состоит из протонов и нейтронов. Количество протонов, заряд ядра и число электронов соответствуют порядковому номеру металла в периодической таблице.
Электроны в металлических атомах расположены намного дальше от ядра, чем электроны неметаллов. Этим объясняется лёгкость отделения валентных электронов, поэтому металлы всегда являются восстановителями в химических реакциях.
Атомы всех металлов, за исключением ртути, образуют кристаллические решётки. Кристаллическая решётка состоит из повторяющихся комплексов атомов – элементарных кристаллических ячеек, которые бывают трёх видов. Их отличия описаны в таблице строения металлов.
Вид решётки | Характеристика | Примеры |
Кубическая объёмно-центрированная (ОЦК) | Восемь ионов находятся по углам условного куба, один – в середине | Fe, Cr, Mo, W, V |
Кубическая гранецентрированная | Ионы располагаются в углах куба и в центре каждой грани. Центр куба свободен | Cu, Ag, Ni, Pb, Al |
Гексагональная плотноупакованная | Шестигранная призма. В углах и в центре между ними находятся ионы. Посередине призмы лежат ионы, образующие треугольник | Zn, Ti, Mg, Co, Zr |
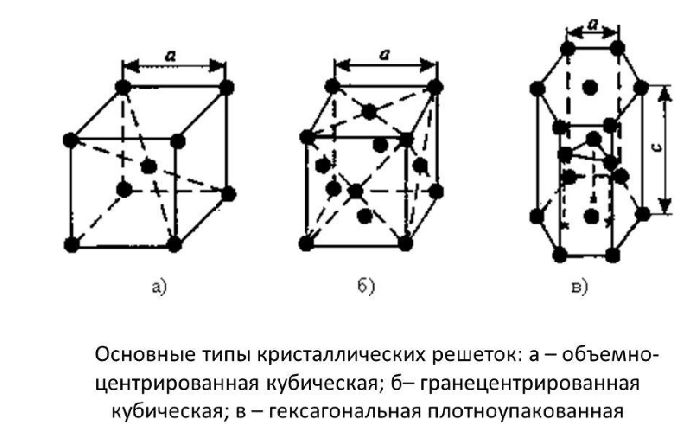
Рис. 1. Виды решёток металлов.
Физические свойства
Металлы отличаются от неметаллов характерными физическими свойствами:
- имеют металлический блеск;
- проводят электрический ток и тепло;
- не имеют запаха;
- обладают серебристо-серым цветом (исключение – медь и золото).
Благодаря пластичности и плавке металлы могут образовывать сплавы – смеси химических элементов. Большую часть сплавов составляют металлы, остальное – случайные примеси и специально вводимые вещества. Сплавы отличаются высокой прочностью, упругостью, хрупкостью. Широко применяются сплавы на основе железа (чёрные металлы) и алюминия (цветные металлы).
Высокую электропроводность обуславливают свободные электроны, перемещающиеся по кристаллической решётке под действием электрических полей. При нагревании электропроводность уменьшается.
Виды
Классификация металлов приведена в таблице.
Признак | Вид | Пример |
Температура кипения | Легкоплавкие (Т<1000°С) | K, Al, Zn |
Тугоплавкие (Т>1000°С) | Au, Cu, Ni | |
Плотность | Лёгкие (ρ<5 г/см3) | Li |
Тяжёлые (ρ>5 г/см3) | Os | |
Твёрдость | Мягкие – режутся ножом | Na, Rb, Cs |
Твёрдые – используются для резки | Cr |
В химии по структуре орбиталей атома металла различают s-, p-, d-, f-металлы.
Химические свойства
Металлы являются восстановителями и вступают в реакцию с неметаллами, образуя оксиды, гидроксиды, соли. Самыми активными являются щелочные и щелочноземельные металлы, расположенные в I и II группах таблицы Менделеева. Благородные металлы (Au, Ag, Pt) малоактивны и не взаимодействуют с кислородом и водой.
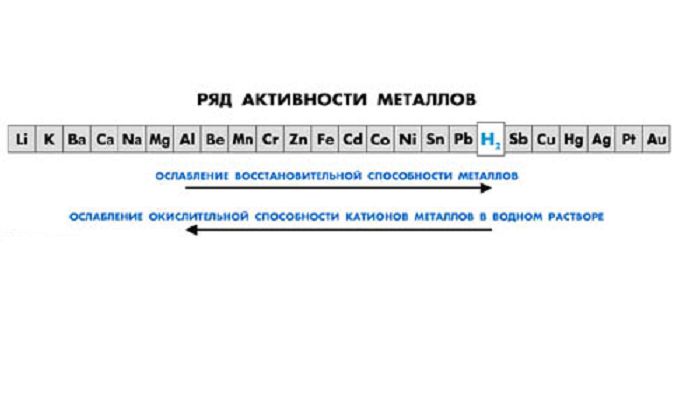
Рис. 2. Шкала активности металлов.
Особенности химического взаимодействия металлов с другими элементами описаны в таблице.
Взаимодействие | Продукты | Уравнение |
С кислородом | Оксиды | 2Mg + O2 → 2MgO |
С серой | Сульфиды | Zn + S → ZnS |
С азотом | Нитриды | 6Li + N2 → 2Li3N |
С фосфором | Фосфиды | 3Ca + 2P → Ca3P2 |
С галогенами | Галогениды | 2Na + Cl2 → 2NaCl |
С водой | Гидроксиды | 2Na + 2H2O → 2NaOH + H2 |
С кислотами | Соли | 2Al + 3H2SO4 → Al2(SO4)3 + 3H2 |
С солями (замещают менее активные металлы) | Соль | 2Fe + Cu2SO4 → Fe2SO4 + 2Cu |
Золото растворяется в царской водке (смеси соляной и азотной кислот), серебро – в концентрированной азотной и горячей серной кислотах.

Рис. 3. Золото.
Что мы узнали?
Рассмотрели особенности строения атомов металлов, физические и химические свойства. Металлы состоят из элементарных кристаллических ячеек, отличающихся конфигурацией. Элементы обладают металлическим блеском, электропроводностью, пластичностью, твёрдостью. Металлы – восстановители. Наиболее активные находятся в I и II группах таблицы Менделеева. Металлы реагируют с кислородом, водой, кислотами, галогенами и неметаллами.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
-

Hoyr Hftx
10/10

Александр Котков
10/10

Сергей Ефремов
6/10
Оценка доклада
Средняя оценка: 4.7. Всего получено оценок: 199.
Источник
Общие физические свойства металлов
Благодаря наличию свободных электронов (“электронного газа”) в кристаллической решетке все металлы проявляют следующие характерные общие свойства:
1) Пластичность – способность легко менять форму, вытягиваться в проволоку, прокатываться в тонкие листы.
2) Металлический блеск и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл светом.
3) Электропроводность. Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение “электронного газа”.
4) Теплопроводность. Обусловлена высокой подвижностью свободных электронов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность – у висмута и ртути.
5) Твердость. Самый твердый – хром (режет стекло); самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
6) Плотность. Она тем меньше, чем меньше атомная масса металла и больше радиус атома. Самый легкий – литий (ρ=0,53 г/см3); самый тяжелый – осмий (ρ=22,6 г/см3). Металлы, имеющие плотность менее 5 г/см3 считаются “легкими металлами”.
7) Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (т.пл. = -39°C), самый тугоплавкий металл – вольфрам (t°пл. = 3390°C). Металлы с t°пл. выше 1000°C считаются тугоплавкими, ниже – низкоплавкими.
Общие химические свойства металлов
Сильные восстановители: Me0 – nē → Men+
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительных реакциях в водных растворах.
1. РЕАКЦИИ МЕТАЛЛОВ С НЕМЕТАЛЛАМИ
1) С кислородом:
2Mg + O2 → 2MgO
2) С серой:
Hg + S → HgS
3) С галогенами:
Ni + Cl2 –t°→ NiCl2
4) С азотом:
3Ca + N2 –t°→ Ca3N2
5) С фосфором:
3Ca + 2P –t°→ Ca3P2
6) С водородом (реагируют только щелочные и щелочноземельные металлы):
2Li + H2 → 2LiH
Ca + H2 → CaH2
2. РЕАКЦИИ МЕТАЛЛОВ С КИСЛОТАМИ
1) Металлы, стоящие в электрохимическом ряду напряжений до H восстанавливают кислоты-неокислители до водорода:
Mg + 2HCl → MgCl2 + H2
2Al+ 6HCl → 2AlCl3 + 3H2
6Na + 2H3PO4 → 2Na3PO4 + 3H2
2) С кислотами-окислителями:
При взаимодействии азотной кислоты любой концентрации и концентрированной серной с металлами водород никогда не выделяется!
Zn + 2H2SO4(К) → ZnSO4 + SO2 + 2H2O
4Zn + 5H2SO4(К) → 4ZnSO4 + H2S + 4H2O
3Zn + 4H2SO4(К) → 3ZnSO4 + S + 4H2O
2H2SO4(к) + Сu → Сu SO4 + SO2 + 2H2O
10HNO3 + 4Mg → 4Mg(NO3)2 + NH4NO3 + 3H2O
4HNO3(к) + Сu → Сu (NO3)2 + 2NO2 + 2H2O
3. ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С ВОДОЙ
1) Активные (щелочные и щелочноземельные металлы) образуют растворимое основание (щелочь) и водород:
2Na + 2H2O → 2NaOH + H2
Ca+ 2H2O → Ca(OH)2 + H2
2) Металлы средней активности окисляются водой при нагревании до оксида:
Zn + H2O –t°→ ZnO + H2
3) Неактивные (Au, Ag, Pt) – не реагируют.
4. ВЫТЕСНЕНИЕ БОЛЕЕ АКТИВНЫМИ МЕТАЛЛАМИ МЕНЕЕ АКТИВНЫХ МЕТАЛЛОВ ИЗ РАСТВОРОВ ИХ СОЛЕЙ:
Cu + HgCl2 → Hg+ CuCl2
Fe+ CuSO4 → Cu+ FeSO4
В промышленности часто используют не чистые металлы, а их смеси — сплавы, в которых полезные свойства одного металла дополняются полезными свойствами другого. Так, медь обладает невысокой твердостью и малопригодна для изготовления деталей машин, сплавы же меди с цинком (латунь) являются уже достаточно твердыми и широко используются в машиностроении. Алюминий обладает высокой пластичностью и достаточной легкостью (малой плотностью), но слишком мягок. На его основе готовят сплав с магнием, медью и марганцем – дуралюмин (дюраль), который, не теряя полезных свойств алюминия, приобретает высокую твердость и становится пригодным в авиастроении. Сплавы железа с углеродом (и добавками других металлов) – это широко известные чугун и сталь.
Металлы в свободном виде являются восстановителями. Однако реакционная способность некоторых металлов невелика из-за того, что они покрыты поверхностной оксидной пленкой, в разной степени устойчивой к действию таких химических реактивов, как вода, растворы кислот и щелочей.
Например, свинец всегда покрыт оксидной пленкой, для его перехода в раствор требуется не только воздействие реактива (например, разбавленной азотной кислоты), но и нагревание. Оксидная пленка на алюминии препятствует его реакции с водой, но под действием кислот и щелочей разрушается. Рыхлая оксидная пленка (ржавчина), образующаяся на поверхности железа во влажном воздухе, не мешает дальнейшему окислению железа.
Под действием концентрированных кислот на металлах образуется устойчивая оксидная пленка. Это явление называется пассивацией. Так, в концентрированной серной кислоте пассивируются (и после этого не реагируют с кислотой) такие металлы, как Ве, Вi, Со, Fе, Мg и Nb, а в концентрированной азотной кислоте – металлы А1, Ве, Вi, Со, Сг, Fе, Nb, Ni, РЬ, Тh и U.
При взаимодействии с окислителями в кислых растворах большинство металлов переходит в катионы, заряд которых определяется устойчивой степенью окисления данного элемента в соединениях (Nа+, Са2+,А13+,Fе2+ и Fе3+)
Восстановительная активность металлов в кислом растворе передается рядом напряжений. Большинство металлов переводится в раствор соляной и разбавленной серной кислотами, но Сu, Аg и Нg – только серной (концентрированной) и азотной кислотами, а Рt и Аи – «царской водкой».
ОПРЕДЕЛЕНИЕ
Неметаллы – химические элементы, атомы которых принимают электроны для завершения внешнего энергетического уровня, образуя при этом отрицательно заряженные ионы.
Электронная конфигурация валентных электронов неметаллов в общем виде — ns2np1−5 Исключение составляют водород (1s1) и гелий (1s2), которые тоже рассматривают как неметаллы.
Неметаллы обычно обладают большим спектром степеней окисления в своих соединениях. Большее число электронов на внешнем энергетическом уровне по сравнению с металлами определяет их большую способность к присоединению электронов и проявлению высокой окислительной активности.
Если в Периодической системе мысленно провести диагональ от бериллия к астату, то в правом верхнем углу таблицы будут находиться элементы-неметаллы. Среди неметаллов есть s-элемент – водород; р-элементы бор; углерод, кремний; азот, фосфор, мышьяк, кислород, сера, селен, теллур, галогены и астат. Элементы VIII группы – инертные (благородные) газы, которые имеют полностью завершенный внешний энергетический уровень и их нельзя отнести ни к металлам, ни к неметаллам.
Неметаллы обладают высокими значениями сродства к электрону , электроотрицательность и окислительно-восстановительный потенциал.
Химические свойства неметаллов
Основные химические свойства неметаллов (общие для всех) – это:
— взаимодействие с металлами
2Na + Cl2 = 2NaCl
Fe + S = FeS
6Li + N2 = 2Li3N
2Ca + O2 = 2CaO
— взаимодействие с другими неметаллами
3H2+ N2 = 2NH3
H2+ Br2 = 2HBr
S + O2 = SO2
4P + 5O2 = 2P2O5
2F2+ O2 = 2OF2
S + 3F2 = SF6,
C + 2Cl2 = CCl4
Каждый неметалл обладает специфическими химическими свойствами, характерными только для него, которые подробно рассматривают при изучении каждого неметалла в отдельности.
Физические свойства неметаллов
Фтор, хлор, кислород, азот, водород и инертные газы представляют собой газообразные вещества, йод, астат, сера, селен, теллур, фосфор, мышьяк, углерод, кремний, бор –твёрдые вещества; бром -жидкость.
Неметаллы находятся в земной коре (в большинстве своем кислород и кремний — 76 % от массы земной коры а также As, Se, I, Te, но в очень езначительных количествах), в воздухе (азот и кислород), в составе растительной массы (98,5 % — углерод, водород, кислород, сера, фосфор и азот), а также в основе массы человека (97,6 % — — углерод, водород, кислород, сера, фосфор и азот). Водород и гелий – входят в состав космических объектов, включая Солнце. Чаще всего в природе неметаллы встречаются в виде соединений.
Источник
Урок химии :Особенности строения атомов металлов. Физические свойства металлов.
Цели урока:
Образовательная – рассмотреть положение металлов в системе элементов Д.И. Менделеева, познакомить обучающихся с основными физическими свойствами металлов, выяснить, чем они обусловлены; выявить закономерности проявления металлами физических свойств; ввести понятие о сплавах и их свойствах.
Развивающая – развивать теоретическое мышление обучающихся и их умение прогнозировать физические свойства металлов на основе их строения атома.
Воспитательная – способствовать развитию познавательного интереса обучающихся к изучению химии
Задачи урока:
Обучающиеся должны изучить положение металлов в Периодической системе элементов,
Выяснить особенности строения их атомов и кристаллов; физические свойства металлов; отличие свойств металлов от свойств их сплавов.
Уметь применять полученные знания при выполнении заданий, упражнений по данной теме.
Тип урока: урок изучения нового материала.
Оборудование:
коллекция металлов и сплавов; таблицы “Виды химической связи”, “Типы кристаллических решеток” и “Общие физические свойства металлов”,
две стеклянные пластинки и вода для проведения опыта.
Ход урока
I. Организационный момент
(преподаватель знакомит обучающихся с темой урока, записанной на доске, планом проведения урока).
II. Новый материал
Преподаватель задает вопросы обучающимся :
1. Как изменяются в периодах периодической системы свойства химических элементов?
2. Как изменяются свойства химических элементов в главных подгруппах?
3. Где располагаются металлы в периодической системе?
Обучающиеся делают выводы:
– Металлами называют химические элементы и простые вещества.
– Металлы занимают левую нижнюю часть периодической системы. А, следовательно, их атомы имеют большие радиусы и, как правило, небольшое количество валентных электронов. Для их ионизации требуется относительно небольшая энергия. Возникающие положительные ионы металла удерживаются все вместе за счет притяжения ко всем свободно движущимся в металле электронам.
Преподаватель демонстрирует таблицу “Виды химической связи”, задает вопрос : в чем сходство и различия между металлической связью и ковалентной? ?(сходство с ковалентной: валентные электроны находятся в общем пользовании, но в случае ковалентной в общем пользовании только двух атомов, а в случае металлической связи эти электроны связывают все атомы куска металла, создают “электронный газ”.)
В чем сходство и различия между металлической и ионной связью? ( с ионной связью металлическая сходна наличием ионов, но в металлической положительные ионы удерживаются “электронным газом”, а в ионной – положительными ионами)
Преподаватель демонстрирует таблицу “Типы кристаллических решеток”:
Благодаря притяжению всех свободных электронов всеми положительными ионами металлическая связь очень прочна, поэтому для металлов характерны кристаллические решетки с плотной упаковкой ионов: гексагональная (цинк, магний), кубическая гранецентрированная (медь, серебро, алюминий) и менее плотная – кубическая объемноцентрированная (железо, натрий, барий).
Преподаватель: И так, металл – это вид атомов, способных легко отдавать при химических реакциях электроны, входить в состав химических соединений в виде положительно заряженных ионов, а также образовывать простые вещества с характерными для металлов физическими свойствами.
Рассмотрите образцы металлов и назовите, какими общими физическими свойствами они обладают?
Обучающиеся называют: электропроводность, теплопроводность, металлический блеск, твердость, пластичность.
Преподаватель: Как можно объяснить наличие общих физических свойств у такого большого числа разнообразных простых веществ?
Обучающиеся делают вывод: причина в особенностях металлической связи, структуре кристаллов металлического типа.
Преподаватель: демонстрирует таблицу “Общие физические свойства металлов”
Преподаватель: Действительно, электрическая проводимость металлов объясняется движением свободных электронов. Почему при нагревании электрическая проводимость металлов уменьшается? Чем обусловлена теплопроводность, и как она изменяется при нагревании? (отвечать на вопросы помогает таблица).
Пластичность – способность изменять свою форму при ударе, прокатываться в тонкие листы, вытягиваться в проволоку.
В чем причина пластичности металлов?
В этом нам поможет разобраться следующий опыт: две стеклянные пластинки смачиваем водой и прижимаем друг к другу. Они легко скользят друг по другу, но их трудно разъединить. Прослойка воды имитирует свободные электроны, а значит причина пластичности – также особое строение кристаллической решетки.
Металлический блеск также обусловлен особым строением металлов (благодаря свободным электронам металлы хорошо отражают световые лучи).
Преподаватель: Да, металлы обладают общими физическими свойствами, которые обусловлены их особым строением, но у разных металлов степень проявления каждого свойства различна. Так, лучшей электропроводностью обладает серебро, на втором месте – медь, а на третьем – золото.
Такие различия в проявлении физических свойств связаны с тем, как плотно упакованы ионы в кристаллической решетке металла, каковы их размеры и сколько валентных электронов у каждого атома обобществляется. Например, чем большее число атомов металла находиться в единице объема металла, тем большей плотностью он будет обладать. Наиболее плотная упаковка ионов в кристаллах гексагонального вида. Однако плотность вещества зависит не только от вида кристаллической решетки, но и от массы составляющих его ионов и от их радиусов. Поэтому наименьшей плотностью обладают щелочные металлы. Самый тяжелый из всех металлов – осмий.
Если металлы образуют кристаллы одного вида (например, щелочные металлы), то возрастание плотности по ряду от лития до цезия объясняется увеличением их атомных масс и масс образуемых ионов, т.к. массы возрастают в большей степени, чем атомные радиусы. Если металлы образуют кристаллы разного вида, то закономерность более сложная, и ее описанием занимается больше физика, чем химия.
В зависимости от плотности металлы принято делить на легкие (их плотность менее 5 г/см3) и тяжелые (их плотность более 5 г/см3). Так у алюминия плотность – 2, 7 г/см3- металл легкий.
Пластичность металлов также зависит от вида кристалла и от количества связывающих электронов, от размеров ионов.
Самый пластичный – золото. Кусочек золота величиной со спичечную головку можно расплющить в просвечивающий голубовато-зеленым светом лист площадью 50 квадратных метров. Образец золота весом 1г можно протянуть в проволоку длиной 2 км. Исстари на Руси выделывали “сусальное золото”: сначала его прокатывали в вальцах до толщины листа писчей бумаги, затем укладывали между тонкими пленками, снятыми со слепой кишки коровы и прокатывали на наковальне деревянными молоточками. Повторяя эту операцию неоднократно, получали листочки золота толщиной всего в десятую долю микрона, т.е. 500 атомов. “Сусальное золото” шло на покрытие деревянных предметов, кожи и т.п.
Самые хрупкие металлы V, VI, VII групп. У них от 5 до 7 валентных электронов, следовательно, очень крепкая связь ионов между собой, что препятствует их скольжению друг относительно друга, снижает пластичность. Этим же объясняется их тугоплавкость и твердость.
Чем меньше количество свободных электронов, чем больше размеры ионов, чем слабее связи ионов, тем мягче металлы. Самые мягкие – щелочные металлы, самый твердый – хром.
Температуры плавления металлов изменяются в очень широких пределах: от минус 39°С до 3410 у вольфрама. Ртуть единственный жидкий при обычных условиях металл.
Следует еще раз обратить внимание , что степень проявления физических свойств у разных металлов зависит не только от количества валентных электронов, но и от вида кристаллической решетки, размеров атомов и ионов, т.е. причины проявления металлами физических свойств многообразны.
Самостоятельная работа обучающихся:
1.Заполните таблицу: «Физические свойства металлов»
используя таблицу приложения: «Справочные данные о физических свойствах металлов»
Свойство металла
Примеры металлов, у которых свойство наиболее выражено
Область применения
Пластичность
Электропроводность
Теплопроводность
Металлический блеск
Твёрдость
Ковкость
2. Запишите признаки, по которым можно различить пластины, изготовленные:
а) из алюминия и меди
б) из свинца и алюминия
в) из серебра и графита
III. Закрепление нового материла
1. Где в Периодической системе Д.И. Менделеева располагаются металлы?
2. В чем существенное отличие в строении атомов металлов от неметаллов?
3. Перечислите общие физические свойства металлов.
4. Почему металлы обладают сходными физическими свойствами?
5. Назовите самый пластичный металл, самый электропроводный, самый твердый.
6. От чего зависит степень проявления каждого из физических свойств у разных металлов?
7. Почему возможно образование сплавов?
8. Почему сплавы отличаются по свойствам от исходных металлов? Приведите примеры.
IV. Домашнее задание п 7.1 стр113 №1,2.4 учебник О.С.Габриелян, И.Г.Остроумов
Ответить на вопросы:
В чем различие между металлической, ковалентной и ионной химическими связями?
Почему соединения с ковалентной связью не проводят электрического тока, а соединения с металлической связью ток проводят?
Приложение
«Справочные данные о физических свойствах металлов»
Название
металла
Удельный
вес, г 1см3
Температура плавления, °С
Коэффициент линейного расширения, α 10-6
Удельная теплоемкость С, кал/г-град
Теплопроводность λ,
Кал/см сек-град
Удельное электросопротивление при 20°,Ом мм/м
Алюминий
2,7
660
23,9
0,21
0,48
0,029
Ванадий
6,0
1720
12,3
0,11
–
–
Вольфрам
19,3
3377
45,0
0,34
0,38
0,053
Железо
7,86
1539
11,9
0,11
0,14
0,10
Кобальт
8,9
1480
12,7
0,10
0,16
0,097
Магний
1,74
651
26,0
0,25
0,37
0,044
Марганец
7,2
1260
23,0
0,12
0,05
Медь
8,92
1083
26,7
0,09
0,92
0,044
Молибден
10,2
2622
5,2
0,065
0,35
0,054
Никель
8,9
1455
13,7
0,11
0,14
0,070
Олово
7,31
232
22,4
0,055
0,16
0,113
Свинец
11,3
327
29,3
0,031
0,084
0,208
Титан
4,5
1660
7,14
0,11
0,048
Хром
7,1
1800
8,4
0,111
0,131
Цинк
7,14
420
32,6
0,91
0,27
0,061
Используемая литература
ГабриелянО.С.,ОстроумовИ.Г.Химиядляпрофессийи специальностейтехнического профиля:учебникдлястуд.учрежденийсред.проф.образования.—М., 2014.
ГабриелянО.С.,Остроумов И.Г.,СладковС.А.,ДорофееваН.М.Практикум:учеб.пособие длястуд.учрежденийсред.проф.образования.—М., 2014.
ГабриелянО.С.,ОстроумовИ.Г.,СладковС.А. Химия:пособиедляподготовкикЕГЭ:учеб.пособиедлястуд.учрежденийсред.проф.образования.—М., 2014.
ГабриелянО.С.,ЛысоваГ.Г.Химия.Тесты,задачииупражнения:учеб.пособиедлястуд. учрежденийсред.проф.образования.—М., 2014.
ЕрохинЮ.М. Химия:Задачии упражнения: учеб.пособиедлястуд.учрежденийсред. проф.образования.—М., 2014.
Источник
