Какая масса воды содержится в растворе

ПОДГОТОВКА К ЭКЗАМЕНУ
«Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей»
Алгоритмы решения задач:
Пример 1. Вычисление массовой доли растворенного вещества
Определите массовую долю нитрата калия в растворе, полученном растворением 50 г нитрата калия в 200 г воды.
Дано: m(KNO3 ) = 50 г, m(Н2О) = 200 г. | Решение ω(в-ва) = m(в-ва) / m(р-ра)*100 (%). m(р-ра) = m(в-ва) + m(Н2 О) = = 50 (г) + 200 (г) = 250 г. ω(KNO3 ) = = 50 (г) / 250 (г) * 100 (%) = 20 %. Ответ. ω(KNO3) = 20 %. |
ω(KNO3 ) – ? |
Пример 2. Вычисление массы растворенного вещества
Вычислите массу гидроксида калия в растворе объемом 600 мл и плотностью 1,082 г/мл, если массовая доля гидроксида калия составляет 10 %.
Дано: V(р-ра) = 600 мл, ρ = 1,082 г/мл, ω(KОН) = 10 %, или 0,1. | Решение m(в-ва) = ω(в-ва)*m(р-ра). m(р-ра) = ρ*V(р-ра) = = 1,082 (г/мл)*600 (мл) = 649,2 г. m(KОН) = 649,2 (г)*0,1 = 64,92 г. Ответ. m(KОН) = 64,92 г. |
m(KОН) – ? |
Пример 3. Смешивание растворов с разными концентрациями одного вещества Смешали 300 г раствора с массовой долей хлорида натрия 20 % и 500 г раствора того же вещества с массовой долей 40 %. Вычислите массовую долю хлорида натрия в полученном растворе.
Дано: m1 = 300 г, ω1 = 20 %, или 0,2, m2 = 500 г, ω2 = 40 %, или 0,4. | Решение m1 *ω1 + m2 *ω2 = m3 *ω3 , где m1 , m2 , m3 – массы растворов. 300 (г)*0,2 + 500 (г)*0,4 = = 800 (г)*ω3 , 60 (г) + 200 (г) = 800 (г)*ω3 , 260 (г) = 800 (г)*ω3 , ω3 = 260 (г) / 800 (г) = 0,325, или 32,5 %. Ответ. ω3 (NaCl) = 32,5 %. |
ω3 – ? |
Пример 4. Разбавление водой
ω2 = 0, т.к. в воде не содержится вещество, находящееся в первом растворе.
Какую массу воды надо добавить к раствору гидроксида натрия массой 150 г с массовой долей 10 %, чтобы получить раствор с массовой долей 2 %?
Дано: m1 = 150 г, ω1 = 10 %, или 0,1, ω2 = 0, ω3 = 2 %, или 0,02. | Решение m1 *ω1 + m2 *ω2 = m3 *ω3 . 150 (г)*0,1 + m2 *0 = = (150 (г) + m2 )*0,02, 15 (г) + 0 = 3 (г) + 0,02m2 , 0,02m2 = 12 г, m2 = 12 (г) / 0,02 = 600 г. Ответ. m(Н2О) = 600 г. |
m2 – ? |
Пример 5. Концентрирование (добавление твердого вещества)
ω2 = 100 %, или 1, т.к. добавляемое вещество чистое.
Какую массу хлорида бария надо добавить к раствору хлорида бария массой 150 г с массовой долей 10 %, чтобы получить раствор с массовой долей 25 %?
Дано: m1 = 150 г, ω1 = 10 %, или 0,1, ω2 = 100 %, или 1, ω3 = 25 %, или 0,25. | Решение m1 *ω1 + m2 *ω2 = m3 *ω3 . 150 (г)*0,1 + m2 *1 = = (150 (г) + m2 )*0,25, 15 (г) + 1*m2 = 37,5 (г) + 0,25m2 , 0,75m2 = 22,5 г, m2 = 22,5 (г) / 0,75 = 30 г. Ответ. m(BaCl2 ) = 30 г. |
m2 – ? |
Пример 6. Упаривание раствора (частичное выпаривание воды)
Вычислите массовую долю хлорида натрия в растворе, если из 200 г 30 %-го раствора испарилось 50 г воды.
Дано: m1 = 200 г, ω1 = 30 %, или 0,3, m2 = 50 г, ω2 = 0. | Решение m1 *ω1 + m2 *ω2 = m3 *ω3 . 200 (г)*0,3 + 50 (г)*0 = = 150 (г)*ω3 , 60 (г) = 150 (г)*ω3 , ω3 = 60 (г) / 150 (г) = 0,4, или 40 %. Ответ. ω3 (NaCl) = 40 % |
ω3 – ? |
ПРИМЕРЫ ЗАДАЧ
1. Какая масса карбоната натрия (в граммах) потребуется для приготовления 0,5 л 13%-го раствора плотностью 1,13 г/мл?
а) 73,45; б) 50; в) 72; г) 75.
2. Из раствора хлорида бария массой 100 г с массовой долей соли 3 % выпарили 25 г воды и до- бавили в него 15 г соли. Массовая доля соли (в %) в полученном растворе равна:
а) 12; б) 15; в) 18; г) 20.
3. Смешали 120 г раствора серной кислоты с массовой до лей 20 % и 40 г 50%-го раствора того же вещества. Определите массовую долю кислоты (в %) в полученном растворе.
а) 25; б) 27,5; в) 27; г) 29,5.
4. Какая масса азотной кислоты (в граммах) содержится в 1 л ее 20%-го раствора с плотностью 1,05 г/мл?
а) 105; б) 63; в) 210; г) 176.
5. Какая масса соли (в граммах) вводится в организм человека при вливании 353 г 0,85%-го физиологического раствора?
а) 3; б) 6; в) 4; г) 2 г.
6. К 180 г 8%-го раствора хлорида натрия добавили 20 г NaCl. Найдите массовую долю (в %) хлорида натрия в образовавшемся растворе.
а) 17,2; б) 17,4; в) 18; г) 12,7.
7. К раствору хлорида кальция массой 140 г с массовой долей соли 5 % добавили 10 г этой же соли. Определите массовую долю (в %) хлорида кальция в полученном растворе.
а) 13,1; б) 14; в) 11,3; г) 25.
8. Какую массу соли (в граммах) надо добавить к 60 г раствора с массовой долей этой соли 10 %, чтобы получить раствор с массовой долей 40 %?
а) 15; б) 22; в) 17; г) 30.
9. Смешали 200 г 15%-го раствора нитрата хрома(III) и 300 г 20%-го раствора той же соли. Вычислите массовую долю (в %) ни- трата хрома(III) в полученном растворе.
а) 24; б) 18; в) 17,9; г) 18,1.
10. Из 150 г раствора хлорида натрия с массовой долей 5 % выпарили 10 г воды и добавили 5 г той же соли. Вычислите массовую долю (в %) соли в полученном растворе.
а) 8,4; б) 8,6; в) 9; г) 11,2.
11. Смешали 200 г 5%-го и 400 г 12,5%-го растворов серной кислоты. Найдите массу кислоты в полученном растворе (в граммах).
а) 60; б) 98; в) 49; г) 58.
12. При растворении 16 г гидроксида натрия получили 10%- й раствор. Определите массу (в граммах) взятой для этого воды.
а) 126; б) 144; в) 151; г) 164.
13. К 200 г 10%-го раствора ни- трата калия добавили некоторую порцию нитрата калия и получи- ли 20%-й раствор. Найдите массу (в граммах) добавленной порции твердого вещества. а) 2,5; б) 5; в) 25; г) 15.
14. Найдите массу воды (в граммах), которую нужно добавить к 300 г 8%-го раствора сульфата натрия для получения 5%-го раствора.
а) 90; б) 45; в) 18; г) 180.
15. Какая масса раствора (в граммах) получится при упаривании 200 г 5%-го раствора гидроксида калия до 20%-го раствора?
а) 10; б) 45; в) 100; г) 50.
16. 92 мл 10%-го раствора серной кислоты (плотность 1,066 г/мл) полностью нейтрализовали 40%-м раствором гидроксида натрия. Найдите массу затраченного на нейтрализацию раствора гидроксида натрия (в граммах).
а) 10; б) 55; в) 20; г) 30.
17. Определите, какую массу гидроксида калия (в граммах) нужно добавить к 150 г 20%-го раствора гидроксида калия для получения 40%-го раствора.
а) 5; б) 50; в) 56; г) 78.
18. К 200 г 8%-го раствора хлорида натрия добавили 50 г воды. Вычислите массовую долю (в %) соли в образовавшемся растворе.
а) 6,4; б) 6,5; в) 6,1; г) 6,2.
19. Определите массу воды (в граммах), которую надо добавить к 20 г 70%-го раствора уксусной кислоты для получения 5%-го раствора уксуса.
а) 260; б) 130; в) 26; г) 258.
20. Определите массу сахара (в граммах), необходимую для приготовления 0,5 кг 45%-го раствора.
а) 245; б) 225; в) 345; г) 500.
21. Вычислите массовую долю соляной кислоты (в %) в растворе, полученном при растворении 11,2 л (н.у.) хлороводорода в 1 л воды.
а) 1,3; б) 1,6; в) 1,8; г) 3,6.
22. Вычислите массу 40%-го раствора уксусной кислоты (в граммах), которую необходимо добавить к 500 г воды для получения 15%-го раствора.
а) 29; б) 32; в) 48; г) 300.
23. Массовая доля соли в морской воде составляет 3,5 %. Найдите массу соли (в граммах), которая останется после выпаривания 5 кг морской воды.
а) 175; б) 170; в) 167; г) 163.
24. Смешали 250 г раствора гидроксида натрия с массовой долей 16 % и 300 мл раствора (ρ = 1,2 г/мл) с массовой долей того же вещества 20 %. Рассчитайте массу гидроксида натрия (в граммах) в полученном растворе:
а) 120; б) 112; в) 11; г) 115.
25. Какова масса поваренной соли (в граммах), которую следует растворить в 250 г раствора этой соли с массовой долей 10 % для получения раствора с массовой долей 18 %?
а) 22; б) 42,4; в) 24,4; г) 44.
26. К 50 г раствора хлорида кальция с массовой долей 3,5 % добавили 5 г этой же соли и 20 г воды. Определите массовую долю (в %) соли в полученном растворе.
а) 6; б) 7; в) 8; г) 9.
27. Какая масса серной кисло ты (в граммах) содержится в 0,6 л ее 40%-го раствора с плотностью 1,3 г/мл?
а) 63; б) 26; в) 60; г) 312.
28. Найдите массу хлорида натрия (в граммах), который необходимо растворить в 50 г воды для приготовления раствора с массовой долей соли 20 %.
а) 20; б) 12,5; в) 5; г) 24.
29. К 350 г водного раствора этанола с массовой долей 20 % добавили 120 мл спирта (плотность 0,8 г/мл). Рассчитайте массу спирта (в граммах) в полученном растворе.
а) 167; б) 156; в) 166; г) 170.
30. Из 50 г раствора хлорида натрия с массовой долей 2 % выпарили 10 г воды и добавили 5 г этой же соли. Определите массовую долю соли (в %) в полученном растворе.
а) 6,3; б) 13,3; в) 8,9; г) 9,4
Ответы. 1–а, 2–г, 3–б, 4–в, 5–а, 6–а, 7–в, 8–г, 9–б, 10–б, 11–а, 12–б, 13–в, 14–г, 15–г, 16–в, 17–б, 18–а, 19–а, 20–б, 21–в, 22–г, 23–а, 24–б, 25–в, 26–г, 27–г, 28–б, 29–в, 30–б.
Источник
Разбор заданий А26. Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей; вычисление массовой доли вещества в растворе.
 Массовой долей называют отношение массы данного компонента m(X) к массе всего раствора М(р-ра). Массовую долю обозначают символом ω (омега) и выражают в долях единицы или в процентах:
Массовой долей называют отношение массы данного компонента m(X) к массе всего раствора М(р-ра). Массовую долю обозначают символом ω (омега) и выражают в долях единицы или в процентах:
ω(Х) = m(Х)/М(р-ра) (в долях единицы);
ω(Х) = m(Х)• 100/М(р-ра) (в процентах).
Молярной концентрацией называют количество растворенного вещества в 1 л раствора. Ее обозначают символом с(Х) и измеряют в моль/л:
с(Х) = n(X)/V = m(X)/M(X) • V.
В этой формуле n(Х) — количество вещества Х, содержащегося в растворе, M(X) — молярная масса вещества Х.

Рассмотрим несколько типовых задач.
- Определить массу бромида натрия, содержащегося в 300 г 15%-ного раствора.
Решение.
Массу бромида натрия определим по формуле: m(NaBr) = ω • М(р-ра)/100;
m(NaBr) = 15•300/100 = 45 г.
Ответ: 45 г.
2. Масса нитрата калия, которую нужно растворить в 200 г воды для получения 8%-ного раствора, равна ______ г. (Ответ округлите до целого числа.)
Решение.
Пусть m(KNO3) = x г, тогда М(р-ра) = (200 + х) г.
Массовая доля нитрата калия в растворе:
ω(KNO3) = х/(200 + х) = 0,08;
х = 16 + 0,08х;
0,92х = 16;
х = 17,4.
После округления х = 17 г.
Ответ: 17 г.
3. Масса хлорида кальция, которую нужно добавить к 400 г 5%-ного раствора этой же соли, чтобы удвоить ее массовую долю, равна______ г. (Ответ запишите с точностью до десятых.)
Решение.
Масса CaCl2 в исходном растворе равна:
m(CaCl2) = ω • М(р-ра);
m(CaCl2) = 0,05 • 400 = 20 г.
Массовая доля CaCl2 в конечном растворе равна ω 1 = 0,05 • 2 = 0,1.
Пусть масса CaCl2, которую нужно добавить в исходный раствор, равна х г.
Тогда масса конечного раствора М1(р-ра) = (400 + х) г.
Массовая доля CaCl2 в конечном растворе:
Решив это уравнение, получим х = 22,2 г.
Ответ: 22,2 г.
4. Масса спирта, которую нужно испарить из 120 г 2%-ного спиртового раствора йода, чтобы повысить его концентрацию до 5%, равна _____________ г. (Ответ запишите с точностью до десятых.)
Решение.
Определим массу йода в исходном растворе:
m(I2) = ω • М(р-ра);
m(I2) = 0,02•120 = 2,4 г,
После выпаривания масса раствора стала равна:
М1(р-ра) = m(I2)/ω 1
М1(р-ра) =2,4/0,05 = 48 г.
По разности масс растворов находим массу испарившегося спирта: 120-48 = 72 г.
Ответ: 72 г.
5. Масса воды, которую нужно добавить к 200 г 20%-ного раствора бромида натрия, чтобы получить 5%-ный раствор, равна_________ г. (Ответ округлите до целого числа.)
Решение.
Определим массу бромида натрия в исходном растворе:
m(NaBr) = ω • М(р-ра);
m(NaBr) = 0,2 • 200 = 40 г.
Пусть масса воды, которую нужно добавить для разбавления раствора, равна x г, тогда по условию задачи:
Отсюда получим x = 600 г.
Ответ: 600 г.
6. Массовая доля сульфата натрия в растворе, полученном при смешении 200 г 5%-ного и 400 г 10%-ного растворов Na2SO4, равна _____________ %. (Ответ округлите до десятых.)
Решение.
Определим массу сульфата натрия в первом исходном растворе:
m1(Na2SO4) = 0,05 • 200 = 10 г.
Определим массу сульфата натрия во втором исходном растворе:
m2(Na2SO4) = 0,1 • 400 = 40 г.
Определим массу сульфата натрия в конечном растворе: m(Na2SO4) = 10 + 40 = 50 г.
Определим массу конечного раствора:М(р-ра) = 200 + 400 = 600 г.
Определим массовую долю Na2SO4 в конечном растворе: 50/600 = 8,3%
Ответ: 8,3%.
В дополнение к решению задач на растворы:
“Правилом креста” называют диагональную схему правила смешения для случаев с двумя растворами.
Слева на концах отрезков записывают исходные массовые доли растворов (обычно слева вверху-большая), на пересечении отрезков — заданная, а справа на их концах записываются разности между исходными и заданной массовыми долями. Получаемые массовые части показывают в каком отношении надо слить исходные растворы.
Например: Определите, сколько нужно взять растворов соли 60%-й и 10%-й концентраций для приготовления 300 г раствора 25%-й концентрации.
Масса одной части: 300/50 = 6 г.
Тогда
m1 = 6•15 = 90 г, .
m2 = 6•35 = 210 г.
Нужно смешать 90 г 60% раствора и 210 г 10% раствора.
Источник
himikus27
Рада приветствовать всех читателей на канале о подготовке к ЕГЭ по химии. На канале Вы можете найти полезную инфографику, теорию, интересные задачи, тренировочные варианты, разборы задач для подготовки к ЕГЭ по химии. Воспользуйтесь путеводителем по каналу!
Очень часто при решении задач №27 их КИМов ЕГЭ по химии приходится встречаться со случаями приготовления растворов с определенной массовой долей растворенного вещества, смешением двух растворов разной концентрации или разбавлением раствора водой, упаривания раствора. Для решения подобных задач через формулу для массовой доли, часто необходимо провести объёмный арифметический расчет. Такие задачи на экзамене могут привести к ступору, увеличить вероятность математических ошибок. В подобных случаях незаменимым становится правило смешения («конверта Пирсона» или, что то же самое, правило креста). Оказалось, что многие дети с этим методом не знакомы, большинство учителей не уделяют ему внимание. Этот метод поможет решить задачи, которые дают как олимпиадные в 8-9 классах на химии, даже детям с очень слабым математическим аппаратом.
№27 Определите массу 14 %-го раствора соли, при добавлении к которому 10 г воды образуется раствор с массовой долей 8%. Ответ укажите в граммах с точностью до десятых.________________________________(ЕГЭ 2020. Основной период)
Если хочется больше пояснений, смотрим видео.
Ребята решали эту задачу тремя способами. Но смогли решить, у нас в регионе, только 56% от всех участников экзамена. В первом случае, за Х взяли массу раствора, за У массу вещества(см. картинку ниже). Составили систему уравнений, выразив массовые доли вещества в исходном и конечном растворах. Второй способ был более логичен, за Х взяли массу раствора, массу вещества выразили через массовую долю исходного раствора 0,14Х. Составили выражение для массовой доли конечного раствора. И только единицы воспользовались правилом креста.
При расчетах записывают одну над другой массовые доли растворенного вещества в исходных растворах, справа между ними – его массовую долю в растворе, который нужно приготовить, и вычитают по диагонали из большего меньшее значение. Разности их вычитаний показывают массовые доли для первого и второго растворов, необходимые для приготовления нужного раствора.
ЕГЭ по химии 2020
Даже не вооружённым глазом видно, какой из способов оказался более экономичным по времени и по силам на него затраченных. А на экзамене каждая минута дорога.
Я считаю, что ребята должны владеть всеми способами для решения этих задач. И подготовила подборку из 10 задач, которые легче решаются по правилу креста .
1.200 г горячего 30 %-го раствора соли охладили до комнатной температуры. Сколько граммов соли выпадет в осадок, если насыщенный при комнатной температуре раствор содержит 20 % соли по массе? Осадок представляет собой безводную соль.Ответ дайте в граммах и округлите до ближайшего целого числа.( Ответ: 25г)
2.При охлаждении 400 г горячего 50 %-го раствора нитрата калия выпал осадок, не содержащий кристаллизационной воды. Чему равна масса осадка, если раствор над осадком содержал 34 % нитрата калия по массе? Ответ дайте в граммах и округлите до ближайшего целого числа.(Ответ: 97г)
3.Вычислите массу 5 %-го раствора вещества, который надо добавить к 120 г 30 %-го раствора, чтобы получить 15 %-й раствор. Ответ дайте в граммах с точностью до целых. (Ответ: 180г)
4.Сколько граммов 63 %-го раствора азотной кислоты надо добавить к 244 г воды, чтобы получить 10 %-й раствор? Ответ округлите до ближайшего целого числа.(Ответ: 46 г)
5.Вычислите массу воды, которую нужно добавить к 50 г 20 %-го раствора соляной кислоты, чтобы уменьшить её концентрацию до 10 %. Ответ укажите в граммах с точностью до целых. (Ответ: 50 г)
6.Сколько граммов семиводного кристаллогидрата потребуется для приготовления 200 г 12 %-го раствора сульфата магния? Ответ приведите с точностью до десятых. (Ответ: 49,2 г)
7.Вычислите массу гидроксида калия, который необходимо растворить в 150 г воды для получения раствора с массовой долей щёлочи 25 %. (Ответ: 50г)
8.Сколько граммов 65 %-го раствора азотной кислоты надо смешать с 270 г 10 %-го раствора этого вещества, чтобы получить 20 %-й раствор? Ответ выразите в виде целого числа. (Ответ: 60г)
9.Вычислите массу воды, которую надо добавить к 200 г 63 %-й азотной кислоты, чтобы получить 15 %-ю кислоту. Ответ дайте в граммах с точностью до целых. (Ответ: 640г)
10.Вычислите массу 15 %-го раствора вещества, который можно получить разбавлением 200 г 36 %-го раствора. Ответ дайте в граммах с точностью до целых. (Ответ: 480г)
Задачи, представленные ниже, легче решать через формулу для массовой доли вещества.
1.Растворяя соль в горячей воде, приготовили 300 г 40 %-го раствора. При охлаждении раствора из него выпало 50 г осадка безводной соли. Вычислите массовую долю соли в растворе над осадком. Ответ дайте в процентах с точностью до целых. (Ответ: 28%)
2.В 200 г воды растворили 85,8 г кристаллической соды (десятиводного карбоната натрия). Чему равна массовая доля карбоната натрия в полученном растворе? Ответ дайте в процентах и округлите до ближайшего целого числа. (Ответ: 11%)
3.Раствор массой 220 г, содержащий 21,0 % растворенной соли, упарили на водяной бане, в результате его масса уменьшилась на 45 г. Чему равна массовая доля соли в новом растворе? Ответ дайте в процентах и округлите до десятых. (Ответ: 26,4 %)
4.К 75 г раствора с массовой долей соли 14 % добавили 10 г той же соли и 10 мл воды. Вычислите массовую долю соли в полученном растворе. Ответ дайте в процентах с точностью до десятых. (Ответ: 21,6%)
5.Раствор массой 120 г, содержащий 17,0 % растворенной соли, оставили на некоторое время на открытом воздухе. За это время его масса уменьшилась на 16 г. Чему равна массовая доля соли в новом растворе? Ответ дайте в процентах и округлите до десятых. (Ответ: 19,6%)
В следующей статье разберём решение нескольких задач из этой подборки, а также готовится статья по 30-31 заданиям из реального ЕГЭ по химии 2020. Не пропустите. Буду рада вашим замечаниям, мои внимательные читатели, а также оценкам и комментариям, они помогают развитию канала.
Твой репетитор по химии ???? Намёткина Светлана Александровна
Источник
Задача 427.
Вычислить мольные доли спирта и воды в 96%-ном (по массе) растворе этилового спирта.
Решение:
Мольная доля (Ni) – отношение количества растворённого вещества (или растворителя) к сумме количеств всех
веществ, находящихся в растворе. В системе, состоящей из спирта и воды, мольная доля воды (N1) равна
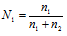 , а мольная доля спирта
, а мольная доля спирта  , где n1 – количество спирта; n2 – количество воды.
, где n1 – количество спирта; n2 – количество воды.
Рассчитаем массу спирта и воды, содержащихся в 1 литре раствора, при условии, что их плотности равны единице из пропорций:
а) масса спирта:

б) масса воды:

Находим количество веществ по формуле: 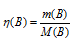 , где m(В) и М(В) – масса и количество вещества.
, где m(В) и М(В) – масса и количество вещества.
Тогда

Теперь рассчитаем мольные доли веществ:

Ответ: 0,904; 0,096.
Задача 428.
В 1кг воды растворено 666г КОН; плотность раствора равна 1,395 г/мл. Найти: а) массовую долю КОН; б) молярность; в) моляльность; г) мольные доли щелочи и воды.
Решение:
а) Массовая доля – процентное отношение массы растворённого вещества к общей массе раствора определяется по формуле:

где – массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
– массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
m(р-ра) = m(H2O) + m(KOH) = 1000 + 666 = 1666 г.
Тогда

б) Молярная(объёмно-молярная) концентрация показывает число молей растворённого вещества, содержащихся в 1 литре раствора.
Найдём массу КОН, приходящуюся на 100 мл раствора по формуле: формуле: m = p V, где p – плотность раствора, V – объём раствора.
Тогда
m(KOH) = 1,395 .1000 = 1395 г.
Отсюда

Теперь рассчитаем молярность раствора:

в) Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000г растворителя.
Находим, сколько граммов HNO3 приходится на 1000г воды, составив пропорцию:

Теперь рассчитаем моляльность раствора:

г) Мольная доля (Ni) – отношение количества растворённого вещества (или растворителя) к сумме количеств всех веществ, находящихся в растворе. В системе, состоящей из спирта и воды, мольная доля воды (N1) равна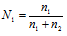 а мольная доля спирта
а мольная доля спирта  , где n1 – количество щёлочи; n2 – количество воды.
, где n1 – количество щёлочи; n2 – количество воды.
В 100г данного раствора содержится 40г КОН 60г Н2О.
Откуда

Тогда

Ответ: а) 40%; б) 9,95 моль/л; в) 11,88 моль/кг; г) 0,176; 0,824.
Задача 429.
Плотность 15%-ного (по массе) раствора H2SO4 равна 1,105 г/мл. Вычислить: а) нормальность; б) молярность; в) моляльность раствора.
Решение:
Найдём массу раствора по формуле: m = p V, где p – плотность раствора, V – объём раствора.
Тогда
m(H2SO4) = 1,105 . 1000 = 1105 г.
Массу H2SO4, содержащуюся в 1000 мл раствора, находим из пропорции:

Определим молярную массу эквивалента H2SO4 из соотношения:
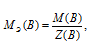
МЭ(В) – молярная масса эквивалента кислоты, г/моль; М(В) – молярная масса кислоты; Z(В) – эквивалентное число; Z(кислоты) равно числу ионов H+ в H2SO4 → 2.
Отсюда

а) Молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворённого вещества, содержащегося в 1 литре раствора.
Тогда

б) Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000г растворителя.
Теперь рассчитаем моляльность раствора:

в) Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000г растворителя.
Находим, сколько граммов H2SO4 содержится в 1000г воды, составив пропорцию:

а) Массу , содержащуюся в растворе, вычислим по формуле:
Теперь рассчитаем моляльность раствора:

Ответ: а) 3,38н; б) 1,69 моль/л; 1,80 моль/кг.
Задача 430.
Плотность 9%-ного (по массе) раствора сахарозы С12Н22О11 равна 1,035 г/мл. Вычислить: а) концентрацию сахарозы в г/л; б) молярность; в) моляльность раствора.
Решение:
М(С12Н22О11) = 342г/моль. Найдём массу раствора по формуле: m = p V, где p – плотность раствора, V – объём раствора.
Тогда
m(С12Н22О11) =1,035 . 1000 = 1035 г.
а) Массу С12Н22О11, содержащуюся в растворе, вычислим по формуле:

где – массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
– массовая доля растворённого вещества; m(в-ва) – масса растворённого вещества; m(р-ра) – масса раствора.
Тогда

Концентрация вещества в г/л показывает число граммов (единиц массы), содержащихся в 1л раствора. Следовательно, концентрация сахарозы составляет 93,15г/л.
б) Молярная(объёмно-молярная) концентрация (СМ) показывает число молей растворённого вещества, содержащихся в 1 литре раствора.
Тогда

в) Моляльная концентрация (или моляльность) показывает число молей растворённого вещества, содержащихся в 1000г растворителя.
Находим, сколько граммов С12Н22О11 содержится в 1000 г воды, составив пропорцию:

Теперь рассчитаем моляльность раствора:

Ответ: а) 93,15 г/л; б) 0,27 моль/л; в) 0,29 моль/кг.
Источник
