Какая масса углерода содержится в 110
Сохраните:
Ответы и задания для 6,7,8,9,10,11 класса 43-го турнира Ломоносова по химии 2020-2021 учебный год, официальная дата проведения турнира в онлайне: 04.10.2020 (4 октября 2020 год).
P.S свои ответы пишите в комментариях ниже, тем самым поможете другим ребятам, а они вам.
Ссылка для скачивания заданий для 6-11 класса: скачать задания
43 турнир М.В. Ломоносова по химии задания и ответы 6-11 класс 2020:
1)Рассчитайте молекулярную массу вещества, имеющего формулу Ca(HCO3)2. Атомные массы считайте целыми числами.
Ответ: 162
2)Рассчитайте, сколько протонов содержится в ядрах всех атомов, входящих в состав молекулы серной кислоты (H2SO4).
Ответ: 50
3)Школьник нашел моток проволоки из белого металла. Он предположил, что это оловянная проволока, тем более ему как раз требовалось олово для пайки. Но как убедиться в этом? К счастью недавно он как раз изучал в школе закон Архимеда, поэтому сразу сообразил, что нужно делать. Он взвесил проволоку и получил величину 841,3 г. Затем он полностью погрузил проволоку в воду и снова взвесил ее, на этот раз весы показали 726,3 г. Школьник произвел необходимые расчеты и убедился, что проволока действительно изготовлена из олова.
Определите по этим данным плотность олова. Приведите свой расчет.
Ответ: 7,3 г/см
Если бы проволока такой же массы (841,3 г) была изготовлена из алюминия, плотность которого 2,7 г см3, то сколько бы она весила в воде?
Ответ: 530,3
4)Водород взаимодействует с парами йода образуя газообразный иодоводород HI. В реакцию в замкнутом сосуде ввели некоторые количества H2 и I2. Через некоторое время состав смеси (в % по молям) стал таким: 30% HI, 10% H2 и 60% I2.
Определите мольное соотношение водорода и йода в первоначальной смеси.
Для реакции взяли такую же смесь водорода и паров йода, как в вопросе 1. Через некоторое время в смеси обнаружено 0,4 моль HI. Определите количества (в моль) водорода и йода, которые в этот момент остаются в сосуде, если известно, что количество водорода уменьшилось в ходе реакции на 50%.
5)Вещества А, Б, В и Г вступают в следующие реакции (многоточие означает, что в реакции образуются и другие продукты): А+K2CO3 + H2O = 2Б Б+HCl =А+….. А+2Mg =В+….. В+O2 =А А+В= 2Г. Определите вещества А, Б, В и Г, если известно, что они все содержат один и тот же элемент, причем его содержание в веществе А составляет 27,27%.
Ответ: A – CO2, Б – KHCO3, В – C, Г – CO
6)В лаборатории имеется пять колб с водными растворами различных веществ. Они подписаны: №1 хлорид аммония, №2 — соляная кислота, №3 — гидроксид калия, №4 — хлорид алюминия, №5 — карбонат натрия. Однако все этикетки перепутаны таким образом, что ни один из растворов не подписан правильно.
При сливании раствора №1 с раствором №4 выделяется газ, который окрашивает влажную индикаторную бумажку в синий цвет. При сливании растворов №2 и №3 выпадает осадок. А при сливании раствора №2 с раствором №5 никаких изменений не происходит.
- Укажите правильные надписи для колб №№ 1–5. Приведите необходимые рассуждения.
- Напишите уравнения реакций, упомянутых в условии.
- Какие еще реакции можно провести между указанными веществами? Напишите их уравнения.
Ответ: №1 карбонат натрия, №2 гидроксид калия, №3 хлорид аллюминия, №4 хлорид аммония, №5 соляная кислота. 2_NH4Cl + Na2CO3 = H2O + CO2 + 2_NaCl + 2_NH3 AlCl3+ 3_KOH = Al(OH)3 + 3_KCl KOH+ HCl= H2O+ KCl
7)Смесь, состоящую из металла А и не которого оксида Б, прокалили и получили смесь продуктов В и Г. При растворении смеси В и Г в избытке соляной кислоты была получена соль Д и выделился горючий газ Е с плотностью по водороду 16. К раствору, содержащему соль Д массой 4,75 г, добавили избыток раствора гидроксида натрия, выпавший при этом осадок отделили, высушили и прокалили, при этом было получено 2,0 г продукта Ж.
- Определите вещества А–Ж.
- Приведите необходимые расчеты
Ответ: А – магний Б – оксид кремния (IV) В – силицид магния Г – оксид магния Д – хлорид магния Е – силан Ж – оксид магния.
Mg+SiO2=Mg2Si+MgOMgO+2HCl=MgCl2+H2OMg2Si+4HCl=SiH4+2MgCl2MgCl2+2NaOH=Mg(OH)2+2NaClMg(OH)2=MgO+H2O
8)Смесь пропана и пропена пропустили в темноте через сосуд, содержащий раствор брома в четыреххлористом углероде. После пропускания газовой смеси масса сосуда увеличилась на 1,26 г. Газ, который не поглотился раствором брома, собрали и сожгли в кислороде. Продукты сгорания последовательно пропустили через трубки, содержащие избыток безводного оксида фосфора(V) и избыток сухого гидроксида калия. Масса первой трубки увеличилась на 2,52 г, а масса второй — на 5,28 г.
- Определите количество пропана в исходной смеси (в моль).
- Определите количество пропена в исходной смеси (в моль).
- Приведите необходимые расчеты.
9)Органическое вещество Х имеет следующий элементный состав: 61,31% C; 5,11% H; 23,36% O; и 10,22% N и молекулярную массу менее 180. Вещество Х можно получить из бензола в четыре стадии. Ниже приведены реагенты и условия, которые требуются на каждой стадии, но в произвольном порядке, не соответствующем реальной последовательности реакций.
- HNO3, H2SO4
- Zn, HCl
- C2H4, H3PO4
- KMnO4, H2SO4 (водный раствор)
В реакции, приведенной под номером 1, образуется два изомерных продукта, в реальных синтезах требуется их разделение. В качестве решения вы можете выбрать любой из изомеров.
- Определите вещество Х
- Расставьте стадии его получения в правильном порядке
- Определите промежуточные вещества, которые получаются на каждой стадии (запишите их названия).
04.10.2020 XLIII Турнир Ломоносова задания и ответы по всем предметам:
04.10.2020 XLIII Турнир Ломоносова задания и ответы
Источник
Задача 106.
При сгорании 4,3г углеводорода образовалось 13,2г СО2. Плотность пара углеводорода по водороду равна 43. Вывести молекулярную формулу вещества.
Решение:
Находим массу углерода, содержащуюся в образце углеводорода из пропорции:
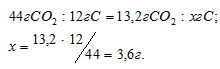
Теперь определим массу водорода, содержащуюся в образце углеводорода:
4,3 – 3,6 = 0,7г.
Обозначим числа атомов углерода и водорода в простейшей формуле углеводорода соответственно через атомные массы углерода и водорода равны соответственно 12 и 1. Поэтому массы углерода и водорода в составе углеводорода будут относиться как 12x : 1у. По условию задачи отношение масс углерода и водорода в образце углеводорода составляет: Следовательно, значения х и у можно найти из пропорции:
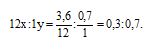
Чтобы выразить полученное отношение целыми числами, разделим оба его члена на наименьший из них:
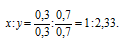
а затем умножим оба члена последнего отношения на 3, получим:
x : y = (1 . 3) : (2,33 . 3) = 3 : 7
Простейшая формула соединения будет иметь вид: С3Н7, которой отвечает молекулярная масса, равная 43. истинную молекулярную массу углеводорода находим исходя из его плотности по водороду:
M(СxНy) = D .M(H2) = 43 . 2 =86г/моль.
Находим коэффициент (n), показывающий во сколько раз истинная молекулярная масса вещества больше вычисленной:
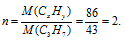
Теперь найденные значения x и y умножаем на 2, получаем: n(СxНy) = C6H14.
Истинная формула вещества будет иметь вид: C6H14.
Ответ: C6H14.
Задача 107.
При полном сгорании навески органического бромсодержащего вещества массой 1,88г получено 0,88г СО2 и 0,3г Н2O. После превращения всего брома, содержавшегося в навеске, в бромид серебра, получено 3,76г AgВr. Плотность паров вещества по водороду равна 94. Определить молекулярную формулу исследуемого вещества.
Решение:
Молекулярные массы углекислого газа, воды и бромида серебра соответственно равны 44, 18 и 187,8. Массы углерода, водорода брома, входящих в состав бромосодержащего органического вещества находим по массам образовавшихся углекислого газа, воды и бромида серебра. При этом учтём, что в одном моле СО2 содержится 12 г углерода, в одном моле Н2О – 2 г водорода, а в одном моле AgBr – 79,9 г брома. Находим массы углерода, водорода и брома, содержащихся СО2, Н2О и AgBr из пропорций:
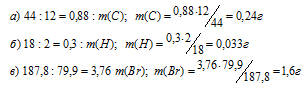
Таким образом, в сгоревшем образце бромосодержащего углеводорода содержится 0,24г углерода, 0,033г водорода и 1,6г брома. Так как сумма масс этих элементов равна массе навески сгоревшего вещества (1,88г), то кислорода в нём не содержится.
Обозначим числа атомов углерода, водорода и брома в простейшей формуле бромосодержащего углеводорода соответственно через Атомные массы углерода, водорода и брома равны соответственно 12, 1 и 79,9. Следовательно, значения можно найти из пропорции:
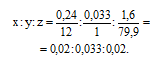
Чтобы выразить полученное отношение целыми числами, разделим все три его члена на наименьший из них:
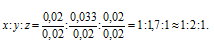
Простейшая формула соединения будет иметь вид: СН2Br, которой отвечает молекулярная масса, равная 93. Истинную молекулярную массу вещества находим исходя из его плотности по водороду:
M(СxНyBrz) = D . M(H2) = 94 . 2 =188г/моль.
Находим коэффициент (n), показывающий во сколько раз истинная молекулярная масса вещества больше вычисленной:
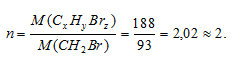
Теперь найденные значения x, y и z умножаем на 2, получаем: n(СxНyBrz) = С2Н4Br2).
Истинная формула вещества будет иметь вид: С2Н4Br2.
Ответ: С2Н4Br2.
Задача 108.
При взрыве смеси, полученной из одного объема некоторого газа и двух объемов кислорода, образуются два объема СО2 и один объем N2. Найти молекулярную формулу газа.
Решение:
Обозначим один объём газа через и запишем схему уравнения реакции с учётом данных задачи, получим:
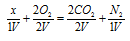
Из схемы вытекает, что газ, подвергшийся взрыву, состоит из двух атомов углерода (две молекулы СО2) и двух атомов азота (одна молекула N2). Формула будет иметь вид: С2N2. Уравнение реакции будет иметь вид:
С2N2 + 2O2 = 2CO2 + N2 .
Ответ: С2N2.
Задача 109.
Найти молекулярную формулу соединения бора с водородом, если масса 1ч чл этого газа равна массе 1 л азота, а содержание бора в веществе составляет 78,2% (масс.).
Решение:
Известно, что один моль любого газа при нормальных условиях занимает объём 22,4 л. Молекулярная масса азота равна 28.
Так как массы соединения бора с водородом и азота равны, то можно вычислить массу 1 л этого соединения из пропорции:
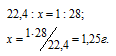
Здесь x – соединение водорода с бором.
Содержание водорода в веществе равно 21,8% (100 – 78,2 = 21,8).
Обозначим числа атомов бора и водорода в простейшей формуле исследуемого вещества соответственно через x и y. Атомные массы бора и водорода соответственно равны 10,8 и 1. Поэтому массы бора и водорода в веществе относятся как 10,8x : 1. По условию задачи отношение масс бора и водорода в исследуемом веществе равно 78,2 : 21,8. Следовательно, значения x и у можно найти из пропорции:
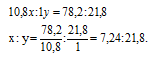
Чтобы выразить полученное отношение целыми числами, разделим оба его члена на наименьший из них:
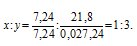
Простейшая формула соединения будет иметь вид: BH3. В обычных условиях существует гидрид бора состава B2H6.
Ответ: B2H6.
Задача 110.
Вычислить массу азота, содержащегося в 1 кг: а) калийной селитры KNO3; б) аммиачной селитры NH4NO3; в) аммофоса (NH4)2HPO4.
Решение:
а) M(KNO3) = 101,09 г/моль. Массу азота, входящую в состав 1 кг калийной селитры находим из пропорции:
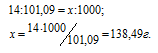
б) М(NH4NO3) = 80 г/моль. В молекуле аммиачной селитры содержится два атома азота. Массу азота, входящую в состав 1 кг аммиачной селитры находим из пропорции:
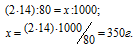
в) М[(NH4)2HPO4] = 132 г/моль. В молекуле аммофоса содержится два атома азота. Массу азота, входящую в состав 1 кг аммофоса находим из пропорции:
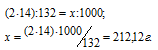
Ответ: а) 138,49 г; б) 350 г; в) 212,12 г.
Источник
Ar(O) -? Ответ: Ar(O)=16
2. Вычислить относительную молекулярную массу Н2О
Дано: Решение:
Н2О Mr(H2O)= 2*Ar(H)+Ar(O)
Найти: Mr(H2O)
Ar(H)=1 Ar(O)=16
Mr(H2O)=2*1+16=18
Ответ: Mr(H2O)= 18
3. Вычислить относительную молекулярную массу воды, если mm(H2O)=2,99*10-23г, ma(C)= 1,99*10-23г.
Дано: Решение:
mm(H2O)=2,99*10-23г Mr(H2O)=mm(H2O): 1/12ma(С)
ma(C)= 1,99*10-23г. Mr(H2O)= 2,99*10-23г: 1/12*1,99*10-23г=18
Mr(H2O)
Ответ: Mr(H2O)=18
4. На весах отвесили 500г сульфата цинка 500 г. сульфата цинка. Какому количеству вещества это соответствует?
Дано: Решение:
m(ZnSO4)=500г n=m/M M(ZnSO4)=[ Mr(ZnSO4)]
n(ZnSO4)-? Mr(ZnSO4)=Ar(Zn)+Ar(S)+4*Ar(O)=61+32+4*16=161
M(ZnSO4)=161 г/моль
n(ZnSO4)=500г:161 г/моль=3,1 моль
Ответ: n(ZnSO4)=3,1моль
5. Сколько молекул содержится в Н2О массой 45г. Какова масса 1 молекулы Н2О?
Дано: Решение:
m(H2O)=54г N=n*NA
1)Находим n(вещества) массой 54г. воды
N(H2O) – ? N=m/M=54г:18г/моль=3моль
mm(H2O) – ?
2)Находим число молекул
N=3моль*6,02*1023моль-1=18,06*1023молекул
3)Находим массу 1 молекулы Н2О. Зная что 1 моль Н2О
содержит 6,02*1023молекул, их масса 18г, тогда масса
1 молекулы будет равна: mm(H2O)=18г/6,02*1023моль-1= 2,99*10-23г
2 способ: N=n*NA= m/M; m=M*N/NA
mm(X)=M(X)*N/NA; N=1, т. к. для 1 молекулы, тогда
mm(Н2О)=18г/моль*1/ 6,02*1023моль-1=2,99*10-23г.
Ответ: N=18,06*1023молекул
mm(H2O)= 2,99*10-23г
6.Определите массовые доли химических элементов в Н3РО4
Дано:
Н3РО4 ω(x)=X*Ar(x) / Mr(в-ва)
Mr(Н3РО4)=98
ω(н)=3*Ar(H)/Mr(Н3РО4)=3*1/98=0,0306 или 3,06%
ω(н)-? ω(P)=Ar(P)/ Mr(Н3РО4)=31/98=0,3163 или 31,63%
ω(P)-? ω(O)=4*Ar(O)/Mr(Н3РО4)=64/98=0,6531 или 65,31%
ω(O)-? Ответ: ω(н)= 3,06% ω(P)= 31,63% ω(O)= 65,31%
7.Массовая доля кислорода в оксиде трехвалентного металла равна 47,06%. Определите этот элемент и составьте формулу оксида.
Дано: Решение:
Ме2О3
ω(о)=47,06% Мr(Ме2О3)=2*Ar(Me)+48
ω(Me)=100-47,06=52,94%
Ме-? 48мас. част. – 47,06%
2*Ar(Me) – 52,94% 2* Ar(Me) = 48*52,94/47,06=54
Ar(Me)=54/2=27 – это алюминий
Ответ: Al
8. Массовая доля кристаллизационной воды в железном купоросе составляет 45,3%.
Определите число молекул воды в формуле железного купороса (FeSO4*nH2O)
дано: Решение:
FeSO4*nH2O 1) ωбез в(FeSO4)=100-45,3=54,7%
ω(Н2О)=45,3% 2)Mr(FeSO4)=152
152 мас ч соответствует 54,7%
Хмас. ч. —————– 45,3%
N-?
Х=152*45,3/ 54,7=126
Мr(nH2O)=126
3) n(H2O)=Mr(nH2O)/Mr(H2O)=126/18=7
Ответ: FeSO4*7H2O
9. Вычислите, какая масса углерода содержится в 90г этана С2Н6.
Дано: Решение:
m(C2H6) = 90г.
M(C2H6)=2*12+1*6=30г/моль
m(C)-? N(C2H6)=m/M=90г/30г/моль=3моль
1моль С2Н6 содержит 2 моль С, т. е. n(C)=2*n(С2Н6)=2*3=6 моль m(C)=n*M=6моль*12г/моль=72г.
Ответ: m(С)=72 г.
10. Вычислите, в какой массе оксида фосфора (III)Р2О3 содержится 6,2 г фосфора.
Дано: Решение:
Р2О3
M(Р2О3) = 110г/моль
m(P)=6,2г. n(P)/n(Р2О3)=2/1 n(Р2О3)=n(P)/2
n(P)=m/M=6,2/31=0,2моль
m(Р2О3) – ? n(Р2О3)=0,2/2=0,1моль
m(Р2О3)=n*M=0,1*110=11г.
Ответ: m(Р2О3)=11г.
11. Вычислите сколько молекул содержится в 36г. Н2О. В каком объеме метана (н. у.)столько же молекул.
Дано: Решение:
m(H2O)=36г. N=n*NA
N(H2O)-? n(H2O)=m/M=36/18=2моль
V(CH4)-? N(H2O)=6,02*1023моль-1*2моль=12,04*1023молекл
N(CH4)=12,04*1023молекул
n(CH4)=N/NA=12,04*1023/6,02*1023=2моль
V=n*Vm=2*22,4л/моль=44,8 л.
Ответ: N(H2O)= 12,04*1023молекл,
V(CH4)=44,8л.
12. Сколько молей атомов углерода в 15г. СН3СООН?
Дано: Решение:
m(СН3СООН) = 15г. n=m/M
n(C)=?
n(СН3СООН)=m(СН3СООН)/M(СН3СООН)=15г/60г/моль=0,25моль
1моль СН3СООН содержит 2 атома С, поэтому:
n(C)=2*n(СН3СООН)=2*0,25 моль=0,5 моль
Ответ: n(C)=0,5моль
13. Чему равно общее число атомов в 3г. этана?
Дано: Решение:
m(C2H6)=3г. n=m/M N=n*NA
N(атомов)-? Найдем n(C2H6)= m/M=3/30=0,1моль
N(C2H6)=0,1*6,02*1023моль-1=6,02*1022
молекула С2Н6 содержит всего 8 атомов (2С и 4Н) поэтому:
N(атомов)=8*6,02*1022=48,16*1022
Ответ: N(атомов)=48,16 *1022
Задачи для самостоятельного решения:
1. Найти относительную атомную массу кислорода, если один атом кислорода имеет массу 2,7*10-23г.
2. Вычислите относительную молекулярную массу веществ состава:
а)СО2 б)НNO3 в)СuSO4 г)Cu(OH)2
3.Рассчитайте массу 2 моль оксида меди (II); 0,5 моль серной кислоты; 0,1 моль хлорида натрия; 0,1 моль кислорода.
4.На одну чашку весов поместили 0,5 моль оксида меди (II). Какое количество оксида железа (III)необходимо поместить на другую чашку весов, чтобы они были в равновесии?
5.Какое вещество содержит больше составных частиц: бор массой 1г. или медь массой 1г? ответ подтвердите расчетами.
6. Какой должна быть масса магния, чтобы она содержала столько же атомов, сколько их содержится в веществе железа массой 28 г.?
7. Сколько молекул воды содержится в воде объемом 1 мл?
8. Какое вещество содержит больше молекул: вода массой 1г. или сероводород массой 1г? Ответ подтвердите расчетами.
9. Одинаковое ли число молекул в 1 л воды и в 1 л серной кислоты, плотность которой 1831 кг/м3? Ответ подтвердите расчетами.
10. Определите объем (н. у.) который займет при нормальных условиях газовая смесь, содержащая водород массой 1,4г. и азот массой 5,6 г.
11. Рассчитайте массу фосфина, содержащего столько же электронов, что и 8,96л бромоводорода.
Расчеты по химическим уравнениям
В основе расчетов по химическим уравнениям лежит закон сохранения массы (Ломоносов, Лавуазье), согласно которому общая масса всех веществ, вступивших в химическую реакцию, равна общей массе всех продуктов реакции.
Равенство этих масс обусловлено тем, что все атомы, из которых состоял реагенты, переходят в продукты реакции; «лишних» атомов в результате разрушения исходных веществ и образования новых не оказывается.
Равенства чисел атомов каждого элемента добиваются, находя коэффициенты, превращающие схему реакции в уравнение реакции:
Ca3P2+6H2O→3Ca(OH)2 + 2PH3
число атомов каждого элемента в правой и левой части одинаковы.
Коэффициенты в уравнении реакции показывает наименьшее число молекул (структурных единиц) вещества, вступающих в химическую реакцию и образующихся в результате неё. Поскольку число молекул пропорционально числу молей, то мольные соотношения участвующих в реакции веществ равны отношениям соответствующих коэффициентов.
n(Ca3P2):n(H2O):n(Ca(OH)2):n(PH3)=1:6:3:2
Очевидно, что, зная число молей одного из участвующих в реакции веществ (реагента или продукта)и составив уравнение данной реакции, легко рассчитать количество (число молей)любого вещества. поэтому именно в молях удобнее всего производить расчет по уравнениям реакций. Особенно целесообразен такой подход при решении задач, связанных с многостадийным превращением веществ.
1. Алюминий массой 13,5г. растворили в избытке НСl. Какой объем Н2 (при н. у) выделится при этом? Какую массу хлорида алюминия можно извлечь из полученного раствора?
Дано: Решение:
m(Al)=13,5г н. у. 2Al+6HCl → 2AlCl3 + 3H2
V(H2)-? 2моль 2моль 3моль
m(AlCl3)-? 1) n(Al)/n(AlCl3)=2/2, т. е. n(Al)=n(AlCl3)
n(Al)=m/M=13,5/27=0,5моль
N(AlCl3)=0,5моль, m(AlCl3)=n*M=0,5*133,5=66,75г.
2)n(Al)/n(H2)=2/3 n(H2)=n(Al)*3/2=0,5*3/2=0,75
V(H2)=n*Vm=0,75*22,4=16,8л.
Ответ: V(H2)=16,8л. m(AlCl3)=66,75г.
2. Н2S сожгли в избытке О2. Весь полученный сернистый газ окислили О2 до оксида S(VI), который растворили в Н2О. Минимальная масса NaOH, необходимая для полной нейтрализации полученного раствора, равна 10г. Какой V(H2S) н. у. был взят для сжигания?
| Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 7 |
Источник

