Какая масса na2co3 содержится в растворе если на нейтрализацию
как можно идентифицировать K2S2O3
Бэла, помогите пожалуйста с задачей )
Определите титр 0,05 N раствора Naoh
РЕШИТЕ ПОЖАЛУЙСТА.
Какую навеску стали потребуется взять для гравиметрического определения в ней хрома, если известно, что процентное содержание хрома в стали 2%, а масса гравиметрической формы Cr2O3 равна 0,5 г.
Помогите пожалуйста На титрование навески янтарной кислоты массой 0.1560 г израсходовано 26,00 мл раствора калия гидроксида. Определить молярную концентрацию и титр раствора калия гидроксида.
Сколько граммов соды Na2CO3 потребуется для нейтрализации 6 молей стеариновой кислоты (считать выход 100%)

Газовая смесь состоит из 5 10–3 м3 азота, находя¬щегося под давлением 95 940 Па, и 3 10–3 м3 кис¬лорода. Объем смеси 8 10–3 м3. Общее давление газо¬вой смеси 104 200 Па. Под каким давлением взят кис-лород?

В атоме элемента находится 5 энергетических уров¬ней, на 5-м энергетическом уровне – 7 валентных элек¬тронов. Какими квантовыми числами они характери¬зуются?

В каком направлении будет протекать реакция:
4. Fe2O3(k) + 3H2(г) = 3H2O(г) + Fe(k).
задача 150. титр раствора NaOH равен 0, 004336 г/мл. Определите Т(NaOHHCL)
ответ: 0.003952 г/мл
задача 156. составьте уравнение реакций, лежащих в основе комплексонометрического определения катионов Са2+ и Mg2+ при совместном присутствии. укажите индикатор и переход в его окраски в точке эквивалентности , а также величину рН, необходимых для определения указанных катионов
Помогите, люди добрые, решить задачу.
рассчитайте, сколько г КОН содержится в 250 мл раствора, если на нейтрализацию 20,00 мл раствора КОН ушло 40,00мл 0,2н раствора H2SO4, заранее благодарю
Здраствуйте помогите пожалуйста решить). Какую навеску бромида калия необходимо взять, чтобы на титрование приготовленного из нее раствора расходовалось 11,50 мл азотнокислого серебра, титр которого по йоду 0,004350 г/см3?

Рассчитайте титр 0,05 нормального раствора H2SO4
Отредактировал администратор, 8 июл 2019 в 21:43.
Сколько граммов едкого натрия содержится в растворе, если на его нейтрализацию израсходовано 22,5 мл 0,5 н раствора соляной кислоты?
17. Для нейтрализации 30 мл раствора щелочи NaOH потребовалось 25 мл 0,2 н раствора кислоты. Определите нормальность в титр раствора щелочи. Помогите, пожалуйста с задачей!!!!
Подскажите, пожалуйста, что такое 3AgNO3?
При титровании воды объемом 100,0 мл израсходовано 5 мл 0,08 н. раствора хлорводородной кислоты. Какова временная жесткость воды?
Отредактировал администратор, 8 июл 2019 в 13:56.
Помогите пожалуйста с задачей. Рассчитать титр раствора серной кислоты и титр ее по оксиду магния, если для приготовления 1 л этого раствора было взято 25 мл 61,54% раствооа серной кислоты(плотность 1,515г/мл). Выручайте пожалуйста.
Определить нормальность раствора КОН, если на титрование 15,00 мл его израсходовали 18,70 мл раствора HCl
T(HCl) = 0,002864.
На нейтрализацию раствора пошло 15 мл,
0,12 нормального раствора натрия соли
Найти нормальность, титрованием, количество азотной кислоты в 250 мл

сколько нужно Na2S2O3*5H2O чтобы получить 4 литра раствора T(Na2S2O3*5H2O)=0,0100
Источник
Тема
 Количественный анализ
Учебные вопросы:
Литература:

Лабораторные
работы.
- Приготовление стандартного раствора щелочи и
установление его нормальности и титра. - Контрольная задача. Определение количества кислоты
в данном растворе.
Методические
указания.
    Методы объемного анализа определяют
содержание элементов (или соединений) в исследуемом веществе. Они основаны на
точном измерении объемов растворов реагирующих веществ.
    Точные объемы растворов можно измерить
специальной мерной посудой: бюреткой, пипеткой, мерными колбами. Учащийся
должен более подробно ознакомиться с измерительной посудой и работой с ней.
    В объемном анализе применимы только такие
реакции, которые протекают быстро и до конца. Конец реакции должен легко
фиксироваться тем или иным способом. Концентрация одного из реагирующих веществ
должна быть точно известна. Концентрацию растворов выражают через нормальную
концентрацию.
В В В
Нормальная концентрация – это отношение количества эквивалента вещества
в системе (например, в растворе) к объему этой системы. Раствор, содержащий 1
моль эквивалентов в 1 л,
называется нормальным; если 0,1 моль эквивалентов в 1 л, то – децинормальным.
   Единица измерения концентрации нормального
раствор – моль на кубический метр, а для практического применения рекомендуется
моль на литр. Можно использовать обозначение Н.
В В В В Рквивалент кислоты (основания) – такая
частица вещества, которая в данной реакции титрования высвобождает один ион
водорода или соединяется с ним. Растворы, содержащие количество вещества,
обозначенное n (HNO3) = 1 моль,
будут каждый содержать один моль эквивалентов кислоты или основания.
   Масса моля эквивалента называется молярной
массой эквивалента (М). Единица измерения – грамм на моль. Для нахождения
молярной массы эквивалента вводиться фактор эквивалентности. Фактор
эквивалентности – число, показывающее, каккя доля
реальной частицы вещества эквивалентна одному иону водорода в данной
кислотно-основной реакции. Фактор эквивалентности – безразмерная величина. Он
может быть рассчитан, если известна стихеометрия реакции. Например,
В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В
В В В Р’
точке эквивалентности каждая реагирующая частица H2 SO4
будет эквивалентна РґРІСѓРј частицам РљРћРќ. Рто же уравнение можно записать так:
В В В В В В В В В В В В В В В В В В В В В В В В В В В В В
   Фактор эквивалентности КОН = 1, H2SO4 = 12
В В В В В В В В В В В В В В В В В В В
В
Фактор эквивалентности NaOH = 1, H3PO4 = 13
В В В В В В В В В В В В В В В В В В В В В В В В В В В В
В В В В В В В В В В В В В В В В В В В (SO4)3+6H2O
В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В
 Молярная масса эквивалента вещества –
произведение фактора эквивалентности на молярную массу данного вещества.
   Нормальную концентрацию раствора
рассчитывают по формуле:
В В В В В В В В В В В В В В В В В В В В В В В
Например: Вычислите
нормальную концентрацию раствора, если в 250 мл его содержится 0,5 г карбоната натрия.
Решение:
- Рассчитаем содержание Na2CO3 в литре раствора:
0,5 гNa2CO3 содержится в 250 мл
раствора
РҐ РіВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В РІ
1000мл раствора,
РўРѕРіРґР° РҐ =
- Затем рассчитываем молярную массу эквивалента
карбоната натрия:
В В В В
- Нормальная концентрация раствора карбоната натрия:
В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В Рќ =
Концентрацию рабочего раствора выражают
через титр. Титром раствора называют количество граммов растворенного вещества,
содержащееся в одном миллилитре раствора.
     Между нормальной концентрацией раствора и
титром существует взаимосвязь. Зная нормальную концентрацию раствора, можно рассчитать
титр и наоборот:
В В В В В В В В В В В В В В В В В В В В В В В В В В
     Важнейшей
операцией объемного анализа является титрование – процесс постепенного
прибавления титрованного раствора к раствору определяемого вещества. Титровать растворы
– значит определять объемы, в которых они эквивалентны между собой. Момент титрования, при котором количество
прибавленного реактива эквивалентно количеству определяемого вещества,
называется точкой эквивалентности. Точку эквивалентности определяют с помощью
индикаторов.
    Все титрованные растворы по своему
назначению делятся на рабочие и исходные. Рабочими растворами называются такие
растворы, которые служат для определения состава анализируемого вещества.
Растворы, которые применяют для установки титра рабочих растворов, называют
исходными.
     По способу приготовления титрованные
растворы могут быть с приготовленным титром и с
установленным. Растворы с приготовленным титром готовят по точной навеске
вещества, взятой на аналитических весах. Если известны масса вещества и объем,
в котором оно растворено, то легко рассчитать титр и нормальную концентрацию
данного раствора.
   Вещества, из которых готовят растворы с
приготовленным титром, называются исходными, так как они не отвечают требованиям,
предъявляемым к ним. Поэтому концентрацию растворов таких веществ определяют по
титрованию их другим титрованным раствором. Растворы, титр которых находят не
по точной навеске, а устанавливают по другому раствору, называются растворами с
установленным титром. Растворы с одинаковой нормальной концентрацией будет
израсходовано меньше по объему, и наоборот. Следовательно, между объемами
реагирующих веществ и их нормальной концентрацией существует зависимость:
В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В
где V1,V2 – объемы реагирующих
веществ, Н1, Н2 – нормальные
концентрации растворов. Следовательно, произведение объема растворов на его
нормальную концентрацию – величина постоянная для обоих веществ.
    При титровании можно использовать как
часть раствора, взятого из колбы пипеткой (способ пипетирования),
так и весь раствор (способ отдельной навески). Во втором случае навеску
растворяют в произвольном объеме растворителя и все титруют другим веществом.
Метод
нейтрализации.
Метод нейтрализации основан на реакции нейтрализации:
В В В В В В В В В В В В В В В В В В В В В В В В В В
протекающий между ионами Н+
и ОН- с образованием молекул воды, вещества слабодиссоциируемого:
В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В
     Метод нейтрализации применяется для
количественного определения кислот и щелочей. Рабочими растворами в методе
нейтрализации являются растворы сильных кислот и щелочей. В реакции
нейтрализации при титровании происходит постепенное изменение концентрации ионов водорода, а, следовательно, и рН
раствора.
В В В В В В Р
Источник
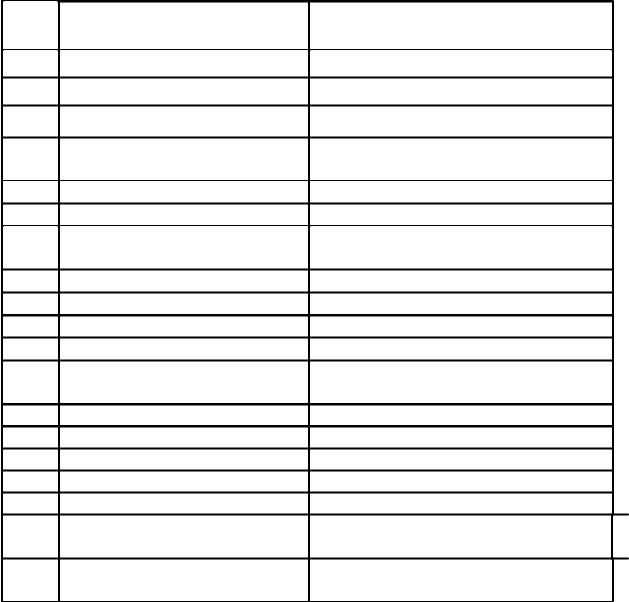
1. Вычислить концентрации в соответствии с данными таблицы:
№ | Дано | Вычислить | |
п/п | |||
1. | T(H2SO4)=0,02446 | C(1/2H2SO4 ) | |
2. | T(NaOH)=0,004020 | C(NaOH) | |
3. | T(HCl/КOH)=0.01353 | C(HCl) | |
4. | T(NaOH/HCl)=0,002914 | C(NaOH) | |
5. | T(NaOH/SO3)=0.02174 | C(NaOH) | |
6. | C(1/2H2SO4 )=0,1008 | T(H2SO4) | |
7. | C(NaOH)=0,09981 | T(NaOH) | |
8. | C(HCl)=0,09798 | T(HCl/K2O) | |
9. | C(NaOH)=0,1021 | T(NaOH/SO3) | |
10. | C(1/2H2SO4 )=0,09812 | T(H2SO4/CaO) | |
11. | T(HCl)=0,03798 | T(HCl/K2O) | |
12. | T(KOH)=0,005727 | T(KOH/H2SO4) | |
13. | T(H2SO4/KOH)=0,005643 | T(H2SO4) | |
14. | T(NaOH/HCl)=0,003645 | T(NaOH) | |
15. | C(1/2H2SO4 )=0,01; k=0,9123 | T(H2SO4) | |
16. | C(KOH)=0,05; k=0,8549 | T(KOH) | |
17. | C(HCl)=0,1046 | T(HCl), T(HCl/CaO) | |
18. | T(H2SO4)=0,004852 | C(H2SO4), | C(1/2H2SO4) |
T(H2SO4/CaO) | |||
19. | C(1/2H2SO4)=0.1; k=0.9808 | C(H2SO4), | T(H2SO4), |
T(H2SO4/NaOH) | |||
2.В 500 мл раствора содержится 2,6578 г Na2CO3 .Вычислить Т(Na2CO3), Т(Na2CO3/HCl) и нормальную концентрацию Na2CO3 при нейтрализации этого раствора: а) до СО2 ; б) до NaНСО3.
3.В воде растворили 28 г “х.ч.” КОН и 40,20 г NaOH и разбавили водой до 1500 мл. Вычислить молярную концентрацию полученного раствора.
4.К 550 мл 0,1925 М HCl прибавили 50,00 мл раствора HCl с титром 0,02370. Вычислить молярную концентрацию и титр полученного раствора.
15
5.Какой объем воды надо добавить к 1 л 0,5300 М HCl, чтобы получить 0,5000 М раствор?
6.Какой объем 4 М HCl надо прибавить к 500 мл раствора HCl с титром по СаО 0,08400, чтобы получить раствор с титром по СаО 0,09000?
7.Какой объем раствора серной кислоты с массовой долей 9,3%(ρ=1,05 г/мл) потребуется для приготовления 40 мл 0,35 М раствора H2SO4?
8. Какой объем раствора карбоната натрия с массовой долей | 15% |
(ρ=1,16г/мл) потребуется для приготовления 120 мл 0,45 М раствора Na2CO3?
9.Какой объем раствора соляной кислоты (ρ=1,19г/мл) необходим для приготовления 1 л 0,1000М раствора?
10.Какой объем раствора серной кислоты (ρ=1,84г/мл) требуется для приготовления 2,5 л 0,2000н. раствора?
11.Для приготовления 500 мл раствора было взято 20,00 мл соляной кислоты (ρ=1,19г/мл). Вычислить молярную концентрацию полученного раствора.
12.Какая масса щелочи, содержащей 98% NaOH и 2% индифферентных примесей, необходима для приготовления 200 мл 0,1000М раствора?
13.Из навески гидроксида натрия массой 8,5 г, содержащего, кроме NaOH, 4% Na2CO3 и 8% Н2О, приготовили 1 л раствора. Определить молярную концентрацию эквивалента полученного раствора, если Na2CO3 нейтрализуется до Н2СО3.
14.Вычислить молярную концентрацию и титр раствора HCl, если на титрование 0,4217 г буры израсходовали 17,50 мл этой кислоты.
15.Навеску Н2С2О4·2Н2О массой 0,6000 г растворили в мерной колбе вместимостью 100,0 мл. На титрование 20,00 мл полученного раствора израсходовали 18,34 мл NaOH. Определить молярную концентрацию раствора NaOH и его титр по Н2С2О4.
16.Вычислить молярную концентрацию раствора NaOH, T(NaOH) и T(NaOH/HCl), если на титрование 20,00 мл его израсходовали 19,20 мл 0,1000 М раствора HCl, приготовленного из фиксанала.
17.Навеску щелочи массой 0,5341 г, содержащую 92% NaOH и 8% индифферентных примесей, растворили и довели до метки в мерной колбе вместимостью 100,0 мл. Определить молярную концентрацию раствора хлороводородной кислоты, T(HCl) и T(HCl/NaOH), если на титрование 15,00 мл раствора NaOH израсходовали 19,50 мл кислоты.
18.Определить молярную концентрацию раствора КОН, если на титрование 15,00 мл раствора его израсходовали 18,70 мл раствора HCl с Т (HCl)=0,002864.
19.До какого объема нужно довести раствор, в котором содержится 1,532 г NaOH, чтобы на титрование его аликвоты в 20,00 мл израсходовать 14,70 мл HCl [T(HCl)=0,003800]?
16
20.Какая масса Na2CO3 содержится в растворе, если на нейтрализацию до NaНСО3 израсходовали 21,40 мл HCl [T(HCl)=0,002789]?
21.Какую массу безводной Na2CO3 нужно взять, чтобы на ее титрование израсходовать 20,00 мл 0,1 М H2SO4?
22.Какую массу щавелевой кислоты Н2С2О4·2Н2О нужно взять, чтобы на ее титрование израсходовать 20,00 мл 0,1 М NaOH?
23.Какую массу вещества, содержащего 90% Na2CO3 и индифферентные примеси, нужно взять, чтобы на ее титрование с метиловым оранжевым израсходовать 20,00 мл 0,1 М HCl ?
24.Какую массу NaOH нужно взять, чтобы на ее титрование израсходовать 22,00 мл раствора HCl с Т (HCl/Na2O)=0,003514.?
25.Какую массу раствора фосфорной кислоты (ρ=1,68г/мл) необходимо перенести в колбу вместимостью 250,0 мл, чтобы на титрование 20,00 мл полученного раствора в присутствии метилового оранжевого израсходовать 18,00 мл 0,1000 М NaOH ?
26.Какую массу КН2РО4 нужно взять на анализ, чтобы на титрование ее с фенолфталеином израсходовать 20,00 мл 0,1000 М NaOH?
27.Навеску фосфорной кислоты массой 0,1182 г растворили в воде и на титрование ее по фенолфталеину израсходовали 22,18 мл 0,1М NaOH (k=0,9519). Определить массовую долю (%) Н3РО4 в пробе; пересчитать ее на содержание Р2О5.
28.На титрование раствора, содержащего 3,1580 г технического КОН, израсходовали 27,45 мл раствора HCl [T(HCl/NaOH)=0,07862]. Вычиcлить массовую долю (%) КОН в образце.
29.После сжигания навески колчедана массой 0,1400 г выделившийся сернистый газ поглотили раствором Н2О2; на титрование образовавшейся серной кислоты с феноловым красным израсходовали 24,86 мл 0,1500 М NaOH. Вычиcлить массовую долю (%) серы в колчедане.
30.На нейтрализацию 0,1000 г смеси, состоящей из карбонатов калия и натрия, израсходовали 22,00 мл раствора HCl. Вычиcлить молярную концентрацию кислоты, если содержание Na2CO3 в смеси 37,00 %.
31.На нейтрализацию 0,2140 г смеси, состоящей из карбонатов кальция и бария, израсходовали 15,00 мл 0,2000 М раствора HCl. Определить массовую долю (%) СаСО3 и ВаСО3 в смеси.
32.Навеску неизвестного вещества массой 1,9996 г растворили в мерной колбе вместимостью 100,0 мл. На титрование 25,00 мл раствора израсходовали 20,00 мл 0,4455 М раствора HCl. Определить, какое соединение входило в состав анализируемого вещества: КОН или NaOH.
33.Навеску технического гидроксида натрия массой 0,3251 г растворили в мерной колбе вместимостью 100,0 мл. На титрование 25,00 мл раствора с фенолфталеином израсходовали 18,40 мл 0,1000 М HCl, а на титрование такой же аликвоты с метиловым оранжевым18,80 мл кислоты. Вычиcлить массовую долю (%) NaOH в образце.
17
34. На титрование с фенолфталеином смеси, состоящей из Na2CO3, NaНСО3 и NaCl, массой 0,4478 г потребовалось 18,80 мл 0,1998 М раствора HCl. При титровании с метиловым оранжевым на ту же навеску израсходовали 40,00 мл раствора кислоты. Вычиcлить массовую долю
(%) Na2CO3 и NaНСО3 в образце.
35.Навеску технического гидроксида натрия массой 0,4000 г растворили в мерной колбе вместимостью 100,0 мл. На титрование 20,00 мл полученного раствора с метиловым оранжевым израсходовали 19,20 мл раствора HCl с Т (HCl)=0,003600. Такую же пробу раствора обработали BaCl2 до полноты осаждения карбонатов и при титровании с фенолфталеином израсходовали 18,00 мл раствора HCl. Вычиcлить массовую долю (%) Na2CO3 в препарате.
36.В мерную колбу вместимостью 200,0 мл ввели 5,00 мл смеси соляной и фосфорной кислот и добавили до метки воды. На титрование 20,00 мл полученного раствора с метиловым оранжевым израсходовали 18,20 мл 0,1012 М NaOH; при титровании такой же пробы с фенолфталеином израсходовали 34,70 мл раствора NaOH. Какая масса HCl и H3PO4 содержалась в 100 мл смеси?
37.В мерную колбу вместимостью 500,0 мл ввели 10,00 мл смеси технических серной и фосфорной кислот и до метки наполнили водой. 25,00 мл этого раствора оттитровали 26,40 мл раствора NaOH [T(NaOH / HCl)=0,003600] по метиловому оранжевому. При титровании такой же пробы по фенолфталеину израсходовали 40,00 мл раствора NaOH. Какая масса Н2SО4 и H3PO4 содержалась в 1 л исходной смеси?
38.Какую массу NH4Cl, содержащего около 30% NH3, взяли для анализа, если после добавления к ней 50,00 мл 0,1000 М NaOH и нагревания до полного удаления аммиака, избыток NaOH оттитровали 25,00 мл 0,1000 М HCl?
39.Какую массу NaNO3 следует взять для анализа, чтобы после восстановления NO3- выделившийся аммиак мог быть поглощен 40,00 мл 0,1000 М HCl и избыток кислоты оттитрован 20,00 мл 0,1000 М NaOH?
40.Навеску соли аммония массой 1,000 г обработали избытком концентрированного раствора NaOH. Выделившийся аммиак поглотили 50,00 мл 1,072 М HCl и избыток кислоты оттитровали 25,40 мл раствора NaOH [T(NaOH =0,004120]. Вычиcлить массовую долю (%) NН3 в образце.
41.Навеску (NH4)2SO4 растворили в мерной колбе вместимостью 100,0 мл. К 20,00 мл раствора прибавили 50,00 мл 0,1122 М NaOH и нагрели до полного удаления NH3. Остаток щелочи оттитровали 18,00 мл раствора HCl (20,00 мл раствора NaOH эквивалентны 21,00 мл раствора HCl). Какая масса (NH4)2SO4 содержалась в исходном растворе?
42. Для определения аммонийного азота навеску удобрения обработали формалином. На нейтрализацию выделившейся кислоты израсходовали 21,00 мл NaOH [T(NaOH =0,003991]. Какую массу навески следует
18
взять для анализа, если содержание азота в удобрении составляло примерно 20%?
43.Для определения аммонийного азота навеску удобрения массой 2,6351
грастворили в мерной колбе вместимостью 250,0 мл. К 25,00 мл полученного раствора добавили формальдегид и выделившуюся кислоту оттитровали 18,72 мл раствора NaOH [T(NaOH =0,003987]. На титрова-
ние формальдегида в холостом опыте израсходовали 0,50 мл NaOH. Вычиcлить массовую долю (%) азота в удобрении.
44.Навеску (NH4)2SO4 массой 1,2899 г растворили в мерной колбе вместимостью 250,0 мл. К 25,00 мл полученного раствора добавили формалина и выделившуюся кислоту оттитровали 24,22 мл раствора NaOH [T(NaOH / HCl =0,003612]. Вычиcлить массовую долю (%) азота в образце.
45.Навеску Na2CO3 0,1032 г обработали 50,00 мл 0,09496 М HCl. Избыток кислоты оттитровали 24,80 мл 0,1 М NaOH (k=1,298) по метиловому оранжевому. Вычиcлить массовую долю (%) индифферентных примесей в образце.
46.К раствору, содержащему 0,3655 г Na2CO3 марки “х.ч.” добавили 40,00 мл раствора HСlO4. Раствор прокипятили для удаления СО2 и на титрование избытка HСlO4 израсходовали 11,25 мл NaOH (25,00 мл раствора NaOH эквивалентны 27,40 мл HСlO4). Определить молярную концентрацию растворов HСlO4 и NaOH.
47.Определить постоянную жесткость воды, если к 100,0 мл исследуемой воды прибавили 20,00 мл раствора Na2CO3 [Т(Na2CO3/CaO)=0,003000], смесь прокипятили и после отделения осадка карбонатов кальция и магния избыток Na2CO3 оттитровали 17,30 мл раствора HCl (20,00 мл
раствора Na2CO3 эквивалентны 21,00 мл раствора HCl). | |
48.К смеси SrCO3 и Li2CO3 массой 0,4789 г добавили | 40,00 мл 0,5100 |
М HCl. Избыток кислоты оттитровали 20,00 мл NaOH | [T(NaOH / HCl |
=0,001825] по метиловому оранжевому. Определить массовую долю
(%) SrСО3 и Li2СО3.
49.В каком объеме хлороводородной кислоты [T(HCl)=0,003638]нужно растворить навеску СаСО3, массой 0,1234 г, чтобы на титрование избытка кислоты по метиловому оранжевому израсходовать 19,50 мл раствора NaOH [T(NaOH / СаО=0,002910]?
50.К 50,00 мл 0,1012н. MgSO4 прибавили 25.00 мл 0,2514 М NaOH и смесь разбавили водой в мерной колбе вместимостью 100,0 мл. Затем 50,00 мл фильтрата оттитровали 0,1046 М HCl. Какой объем кислоты израсходовали на титрование?
51.Из раствора объемом 20,00 мл, содержащего Na2SO4, получили в кислой среде осадок бензидинсульфата. Осадок растворили в горячей воде и оттитровали 18,45 мл 0,1022 М NaOH с фенолфталеином:
C12H8(NH2)2· Н2SО4 +2OH- = C12H8(NH2)2 + SО42- + 2H2O
19
Определить концентрацию сульфата натрия в исходном растворе(г/л). 52.Калий из навески карналлита массой 0,8372 г осадили в виде калиевой
соли дипикриламина. Осадок растворили в ацетоне, прибавили 50,00 мл 0,1046 М HCl и после удаления ацетона избыток HCl оттитровали 22,34 мл 0,1124 М раствора NaOH. Вычиcлить массовую долю (%) КCl в карналлите и пересчитать содержание его на К2О.
53.К раствору смеси аминокислот , содержащему 0,1046 г глицина и 0,0848 г аланина, прибавили избыток формалина, предварительно нейтрализованного по фенолфталеину. Полученные соединения оттитровали 0,1016 М раствором NаОН. Вычиcлить объем титранта.
54.К навеске раствора массой 1,000 г, содержащего этиленгликоль, добавили уксусный ангидрид и нейтрализовали раствором NaOH по фенолфталеину. Для омыления образовавшегося эфира ввели 25,00 мл раствора NаОН [T(NaOH)=0,04020].
СН2 | СН2 | СН2 ¾ СН2 | |||
| | | | + 2ОН- = | | | | + 2СН3СОО- | |
ОСОСН3 | ОСОСН3 | ОН | ОН | ||
Смесь прокипятили и после охлаждения избыток щелочи оттитровали 10,20 мл раствора HCl с Т(HCl)=0,03798. Вычиcлить массовую долю (%) этиленгликоля (М=62,07г/моль) в растворе.
55.Пробу раствора формальдегида объемом 5,00 мл разбавили до 100,0 мл. К аликвоте раствора объемом 5,00 мл добавили сульфит натрия; образовавшиеся в результате реакции:
НСОН + SO32- + H2O = CH2(OH) SO3- + OH-
ионы гидроксида оттитровали 22,45 мл 0,1000н.(fэкв.=1/2) раствора Н2SО4. Вычислить концентрацию СН2О (г/л) в исходном растворе.
56.Для определения бензальдегида навеску массой 0,4728 г обработали раствором солянокислого гидроксиламина.
Н | Н | |
/ | / | |
C6H5—C | + NH2OH·HCl = C6H5—C | +HCl + H2O |
\ | \ | |
О | NOH |
и выделившуюся хлороводородную кислоту оттитровали 19,45 мл 0,25М NaOH (k=0,9845). На титрование солянокислого гидроксиламина в холостом опыте израсходовали 1,75 мл того же раствора NaOH. Определить массовую долю (%) бензальдегида (М=106,13 г/моль) в исходном продукте.
57.Какую массу продукта, содержащего 98% м- нитробензальдегида (М=151,13 г/моль), нужно взять на анализ, чтобы после добавления к
20
ней солянокислого гидроксиламина выделившуюся хлороводородную кислоту можно было оттитровать 20,00 мл 0,1 М NaOH (k=1,048):
H | H | |
/ | / | |
C6H4NO2—C | + NH2OH·HCl = C6H4NO2—C | +HCl + H2O |
\ | \ | |
О | NOH |
58. Какую массу 2,5-динитрофенола C6H3(OH)(NO2)2 следует взять для определения азота по Къельдалю, чтобы выделившийся аммиак мог быть поглощен 50,00 мл 0,2н. Н2SO4 (fэкв.=1/2) и избыток кислоты оттитрован 20,00 мл 0,2000 М NaOH?
59.Какую массу гидрофталата калия нужно растворить в мерной колбе вместимостью100,0 мл, чтобы на титрование 10,00 мл полученного раствора израсходовать 10,00 мл 0,1 М (k=1,082) раствора HClO4 в среде ледяной уксусной кислоты?
21
Источник
