Какая масса hno3 содержалась в растворе если на нейтрализацию его

Решение задачи по химии на закон эквивалентов
Задание 155.
Какая масса HNO3 содержалась в растворе, если на нейтрализацию его потребовалось 35 см3 0,4 н. раствора NaOН? Каков титр раствора NaOН? Ответ: 0,882 г; 0,0 16 г/см3.
Решение:
Эквивалентная масса HNO3 равна : МЭ(HNO3) = М(HNO3)/1 = 63/1 = 63 г/моль. Эквивалентная масса NaOH равна : МЭ(NaОН) = М(NaОН)/1 = 40/1 = 40 г/моль. Молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворенного вещества, содержащихся в 1 л раствора. Находим число эквивалентов NaOН , содержащихся в 35 см3 его раствора из пропорции:
1000 : 0,4 = 35 : х; х = (0,4 . 35)/1000 = m0,014Н.
Из закона эквивалентов следует, что вещества реагируют друг с другом в эквивалентных соотношениях. Находим массу HNO3 по формуле:
m(HNO3) = МЭ(HNO3) . СН(HNO3) = 63 . 0,014 = 0,882 г
Титром раствора называют число граммов растворенного вещества в 1 см3 (мл) раствора. Находим массу гидроксида натрия, содержащегося в 1 л 0,4Н раствора его:
m(NaOH) = МЭ(NaOH) . СН(NaOH) = 40 . 0,4 = 16 г.
Отсюда
Т(NaOH) = 16/1000 = 0,016 г/см3.
Можно титр раствора рассчитать, зная концентрацию эквивалента (СН) и массу эквивалента (МЭ) растворённого вещества по формуле:
Т = СН .МЭ(В)/1000;
Т(NaOH) = 0,4 . 40/1000 = 0,016 г/см3.
Ответ: 0,882 г; 0,0 16 г/см3.
Приготовление раствора
Задание 156.
Какую массу NaNO3 нужно растворить в 400 г воды, чтобы приготовить 20%-ный раствор? Ответ: 100 г.
Решение:
Для расчета используем формулу:
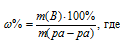
m(B) – масса растворённого вещества; m(Ра-ра) – масса раствора, которая составляет сумму масс растворителя и растворённого вещества [m(ра-ра) = m(ра-ля) + m(В); – массовая доля растворённого вещества в процентах.
Обозначим массу растворённого вещества через х и подставим данные задачи в уравнение, получим искомую массу NaNO3:
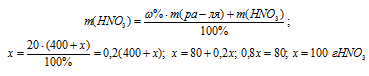
Ответ: 100 г.
Массовая доля раствора
Задание 157.
Смешали 300 г 20%-ного раствора и 500 г 40%-ного раствора NaСI. Чему равна массовая доля полученного раствора? Ответ: 32,5%.
Решение:
Находим массу растворённого вещества в каждом из смешиваемых растворов и суммировав их, получим массу растворённого вещества в смеси:
m(20%) = 300 .20/100 = 60 г;
m(40%) = 500 . 40/100 = 200 г.
Для вычисления массовой доли смеси слагаем массы вещества, растворённого в обоих растворах, и берём отношение массы растворённого вещества в смеси, выразив его в процентах, получим:
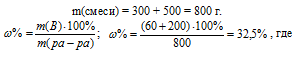
m(B) – масса растворённого вещества m(смеси); m(Ра-ра) – масса раствора, которая составляет сумму масс растворителя и растворённого вещества [m(ра-ра) = m(ра-ля) + m(В); – массовая доля растворённого вещества в процентах.
Ответ: 32,5%.
Задание 158.
Смешали 247 г 62%-ного и 145 г 18%-ного раствора серной кислоты. Какова массовая доля полученного раствора? Ответ: 45,72%.
Решение:
Находим массу растворённого вещества в каждом из смешиваемых растворов и суммировав их, получим массу растворённого вещества в смеси:
m(62%) = 247 .62/100 = 153,14 г;
m(18%) = 145 .18/100 = 26,1 г;
m(H2SO4) = 153,14 + 26,1 = 179,24 г.
Для вычисления массовой доли смеси слагаем массы вещества, растворённого в обоих растворах, и берём отношение массы растворённого вещества в смеси, выразив его в процентах, получим:
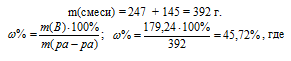
m(B) – масса растворённого вещества m(смеси); m(Ра-ра) – масса раствора, которая составляет сумму масс растворителя и растворённого вещества [m(ра-ра) = m(ра-ля) + m(В); – массовая доля растворённого вещества в процентах.
Ответ: 45,72%.
Задание 159.
Из 700 г 60%-ной серной кислоты выпариванием удалили 200 г воды. Чему равна массовая доля оставшегося раствора? Ответ: 84%.
Решение:
Находим массу серной кислоты в растворе:
m(H2SO4) = (700 .60)/100 = 420 г.
Находим массу раствора после выпаривания:
m(ра-ра) = 700 – 200 = 500 г.
Находим массовую долю оставшегося раствора из формулы:
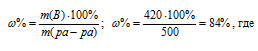
m(B) – масса растворённого вещества m(смеси); m(Ра-ра) – масса раствора, которая составляет сумму масс растворителя и растворённого вещества [m(ра-ра) = m(ра-ля) + m(В); -массовая доля растворённого вещества в процентах.
Ответ: 84%.
Задание 160.
Из 10 кг 20%-ного раствора при охлаждении выделилось 400 г соли. Чему равна массовая доля охлажденного раствора? Ответ. 16,7%.
Решение:
Находим массу соли, содержащуюся в растворе:
m(соль) = (10000 .20)/100 = 2000 г.
Находим массу соли после выпаривания:
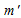 (ра-ра) = 2000 – 400 = 1600 г.
(ра-ра) = 2000 – 400 = 1600 г.
Находим массу раствора после охлаждения:
m(ра-ра) = 10000 – 400 = 9600 г.
Находим массовую долю оставшегося раствора из формулы:
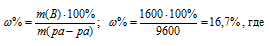
m(B) – масса растворённого вещества m(смеси); m(Ра-ра) – масса раствора, которая составляет сумму масс растворителя и растворённого вещества [m(ра-ра) = m(ра-ля) + m(В); – массовая доля растворённого вещества в процентах.
Ответ. 16,7%.
Источник
- Главная
- Вопросы & Ответы
- Вопрос 2156461
более месяца назад
Просмотров : 46
Ответов : 1
Лучший ответ:

Если будут вопросы с почерком обращайся
более месяца назад
Ваш ответ:
Комментарий должен быть минимум 20 символов
Чтобы получить баллы за ответ войди на сайт

Лучшее из галереи:































Другие вопросы:
Спортивный магазин проводит акцию: «Любая футболка по цене 300 рублей. При покупке двух футболок — скидка на вторую 60%». Сколько рублей придётся заплатить за покупку двух футболок?
более месяца назад
Смотреть ответ
Просмотров : 20
Ответов : 1
Цена деления шкалы 100 200 300 400 500,
более месяца назад
Смотреть ответ
Просмотров : 9
Ответов : 1
история создания стихотворения ” Я помню чудное мгновенье”
более месяца назад
Смотреть ответ
Просмотров : 12
Ответов : 1
Помогите вставить артикли и предлоги 🙂
более месяца назад
Смотреть ответ
Просмотров : 7
Ответов : 1
1.Составьте хронологию событий Украинской революции
более месяца назад
Смотреть ответ
Просмотров : 7
Ответов : 1
Источник
Шиманович И. Л. Химия: методические указания, программа, решение типовых задач, программированные вопросы для самопроверки и контрольные задания для студентов-заочников инженерно-технических (нехимических) специальностей вузов / И. Л. Шиманович. – 3-е изд., испр. – М.: Высш. шк., 2003. – 128 с.
141. Вычислите молярную и эквивалентную концентрации 20%-ного раствора хлорида кальция плотностью 1,178 г/см3. Решение
142. Чему равна нормальность 30%-ного раствора NaOH плотностью 1,328 г/см3? К 1 л этого раствора прибавили 5 л воды. Вычислите процентную концентрацию полученного раствора. Решение с ключом
143. К 3 л 10%-ного раствора НNО3 плотностью 1,054 г/см3 прибавили 5 л 2%-ного раствора той же кислоты плотностью 1,009 г/см3. Вычислите процентную и молярную концентрацию полученного раствора, объем которого равен 8 л. Решение с ключом
144. Вычислите эквивалентную и моляльную концентрации 20,8%-ного раствора НNО3 плотностью 1,12 г/см3. Сколько граммов кислоты содержится в 4 л этого раствора? Решение с ключом
145. Вычислите молярную, эквивалентную и моляльную концентрации 16%-ного раствора хлорида алюминия плотностью 1,149 г/см3. Решение с ключом
146. Сколько и какого вещества останется в избытке, если к 75 см3 0,3 н. раствора H2SO4 прибавить 125 см3 0,2 н. раствора КОН? Решение
147. Для осаждения в виде АgСl всего серебра, содержащегося в 100 см3 раствора АgNО3, потребовалось 50 см3 0,2 н. раствора HCl. Какова нормальность раствора АgNО3? Какая масса AgCl выпала в осадок? Решение с ключом
148. Какой объем 20,01%-ного раствора HCl (пл. 1,100 г/см3) требуется для приготовления 1 л 10,17%-ного раствора (пл. 1,050 г/см3)? Решение с ключом
149. Смешали 10 см3 10%-ного раствора HNO3 (пл. 1,056 г/см3) и 100 см3 30%-ного раствора HNO3 (пл. 1,184 г/см3). Вычислите процентную концентрацию полученного раствора. Решение с ключом
150. Какой объем 50%-ного раствора КОН (пл. 1,538 г/см3) требуется для приготовления 3 л 6%-ного раствора (пл. 1,048 г/см3)? Решение
151. Какой объем 10%-ного раствора карбоната натрия (пл. 1,105 г/см3) требуется для приготовления 5 л 2%-ного раствора (пл. 1,02 г/см3)? Решение
152. На нейтрализацию 31 см3 0,16 н. раствора щелочи требуется 217 см3 раствора H2SО4. Чему равны нормальность и титр раствора H2SО4? Решение с ключом
153. Какой объем 0,3 н. раствора кислоты требуется для нейтрализации раствора, содержащего 0,32 г NaOH в 40 см3? Решение
154. На нейтрализацию 1 л раствора, содержащего 1,4 г КОН, требуется 50 см3 раствора кислоты. Вычислите нормальность раствора кислоты. Решение с ключом
155. Какая масса HNO3 содержалась в растворе, если на нейтрализацию его потребовалось 35 см3 0,4 н. раствора NaOH? Каков титр раствора NaOH? Решение с ключом
156. Какую массу NаNО3 нужно растворить в 400 г воды, чтобы приготовить 20%-ный раствор? Решение
157. Смешали 300 г 20%-ного раствора и 500 г 40%-ного раствора NaCl. Чему равна процентная концентрация полученного раствора? Решение с ключом
158. Смешали 247 г 62%-ного и 145 г 18%-ного раствора серной кислоты. Какова процентная концентрация полученного раствора? Решение с ключом
159. Из 700 г 60%-ной серной кислоты выпариванием удалили 200 г воды. Чему равна процентная концентрация оставшегося раствора? Решение
160. Из 10 кг 20%-ного раствора при охлаждении выделилось 400 г соли. Чему равна процентная концентрация охлажденного раствора? Решение с ключом
Источник

Решение. а) массовая процентная концентрация показывает число граммов (единиц массы) раствора. Так как массу 282 см3 воды можно принять равной 282 г, то масса полученного раствора 18 +282 = 300 г и , следовательно,
300 | – | 18 | |||
100 | – | С% | С% = | 100 18 | = 6% |
300 | |||||
б) мольно-объемная концентрация или молярность , показывает число молей растворенного вещества, содержащихся в 1л раствора. Масса 1л раствора 1031г. Массу кислоты в литре раствора находим из соотношения
300 | – | 18 | |||
1031 | – | Х | Х = | 1031 18 | = 61,86 |
300 | |||||
Молярность раствора получим делением числа граммов H3PO4 в 1л раствора на мольную массу H3PO4 (97,99 г/моль).
СМ = 61,86 / 97,99 = 0,63 М
в) эквивалентная концентрация или нормальность, показывает число эквивалентов растворенного вещества, содержащихся в 1л раствора. Так как эквивалентная масса
H3PO4 = М = 97,99 = 32,66 г/моль, то СН = 61,86 / 32,66 = 1,89н;
3 3
г) мольно-массовая концентрация или моляльность, показывает число молей растворенного вещества, содержащихся в 1000г растворителя. Массу H3PO4 в 1000г растворителя находим из соотношения
282 | – | 18 | |||
1000 | – | Х | Х = | 1000 18 | = 68,83 |
282 | |||||
Отсюда Сm = 68,83 / 97,99 = 0,65m
Титром раствора называется число граммов растворенного вещества в 1 см3 (мл) раствора. Так как в 1л раствора содержится 61,86 кислоты, то
Т = 61,86 / 1000 = 0,06186 1г/см3
Зная нормальность раствора и эквивалентную массу (mЭ) растворенного вещества, титр легко найти по формуле
Т = СНmЭ / 1000.
Пример 2. На нейтрализацию 50 см3 раствора кислоты израсходовано 25 см3 0,5н раствора щелочи. Чему равна нормальность кислоты?
111

Решение. Так как вещества взаимодействуют между собой в эквивалентных соотношениях, то растворы равной нормальности реагируют в равных объемах. При разных нормальностях объемы растворов реагирующих веществ обратно пропорциональны их нормальностям, т.е.
V1/ V2 = СН2 / СН1 или V1СН1 = V2СН2
50 * СН1 = 25 * 0,5, откуда СН1= 25 * 0,5 / 50 = 0,25н
Пример 3. К метиловому спирту массой 32г и плотностью 0,8 г/мл добавили воду до объема 80 мл. Определите объемную долю спирта в растворе.
Решение. Рассчитаем объем растворенного вещества:
V(спирт) = m(спирт) 32 =40 мл
р(спирт) 0,8
Определяем объемную долю спирта в растворе по соотношению
V(спирт) | 40 | |||
V(спирт) = | 0,5 | или в процентах 0,5 100 50% | =40 мл | |
V( р ра) | 80 | |||
Пример 4. Найти массы воды и медного купороса CuSO4 · 5Н2О, необходимые для приготовления одного литра раствора, содержащего 8% (масс) безводной соли. Плотность 8% раствора CuSO4 равна 1,084 г/мл.
Решение. Масса 1 л полученного раствора будет составлять 1,084 * 1000 = 1084г. В этом растворе должно содержаться 8% безводной соли, т.е. 1084 * 0,08 = 86,7г. Массу CuSO4 * 5Н2О (мольная масса 249,7 г/моль),
содержащую 86,7г безводной соли (мольная масса 159,6 г/моль), найдем из пропорции 249,7 : 159,6 = Х : 86,7.
Х = 249,7 159,6 = 135,6 159,6
Необходимая для приготовления раствора масса воды составит 1084 – 135,6 = 948,4г.
Пример 5. К 1л 10% – ного раствора КОН (пл. 1,092 г/ см3) прибавили 0,5л 5% – ного раствора КОН (пл. 1,045 г/ см3). Объем смеси довели до 2л. Вычислить молярную концентрацию полученного раствора.
Решение. Масса 1л 10% – ного раствора КОН 1092 г. В этом растворе содержится 1092 * 10 / 100 = 109,2 г КОН. Масса 0,5л 5% – ного раствора
1045 * 0,5 = 522,5г. В этом растворе содержится 522,5 * 5 / 100 = 26,125г
КОН.
112

В общем объеме полученного раствора (2л) содержимое КОН составляет 109,2 + 26,125 = 135,325г. Отсюда молярность этого раствора СМ = 135,235 / 256,1 = 1,2М, где 56,1 г/моль – мольная масса КОН.
Пример 6. Какой объем 96% – й кислоты плотностью 1,8 г/см3 потребуется для приготовления 3л 0,4 н раствора?
Решение. Эквивалентная масса
Н2SO4 = М 92,08 = 49,04 г/моль
2 2
Для приготовления 3л 0,4 н раствора требуется 49,04 · 0,4 · 3 = 58,848 г Н2SO4 . Масса 1см3 96% – ной кислоты 1,84 г. В этом растворе содержится 1,84 * 96 / 100 = 1,766 г Н2SO4 . Следовательно, для приготовления 3л 0,4 н раствора надо взять 58,848 : 1,766 = 38,32 см3 этой кислоты.
Закон эквивалентов: Все вещества реагируют между собой в эквивалентных количествах.
Иногда удобнее пользоваться другим определением закона эквивалентов: массы (объемы) реагирующих между собой веществ пропорциональны их молярным массам эквивалентов (объемам эквивалентов).
m1 / m2 = Э1 / Э2 – формула для веществ
Сн1 х V1 = Сн2 х V2 – формула для растворов
Титр – масса растворенного вещества в 1 мл раствора T = mв-ва / V
Пример 7. На нейтрализацию 31 см3 0,16 н раствора щелочи требуется 217 см3 раствора H2SO4. Чему равна нормальность и титр раствора H2SO4?
Дано: | Решение | |
Vщ = 31 см3 | по з-ну эквивалентов: Снщ * Vщ = Снк * Vк | |
Снщ = 0,16 н | Снк = Снщ * Vщ / Vк, отсюда | |
Vк | = 217 см3 | Снк = 0,16н 31 см3 / 217 см3 = 0,02н |
Снк = ? | Снк = mк / Эк * V; mк = Снк * Эк х V | |
титр -? | Э H2SO4 = М H2SO4 / 2 = 98 / 2 = 49 г/моль | |
mк = 0,02 * 49 * 1л = 0,98 г | ||
г/мл | T = mк / V; Т = 0,098 / 1000 мл = 0,00098 | |
113 | ||

Ответ: Снк = 0,02 н; титр = 0,00098 г/мл
Температуры кристаллизации, замерзания и кипения растворов:
Раствор кипит при более высокой и замерзает при более низкой температуре, чем растворитель. Повышение температуры кипения и понижение температуры замерзания растворов прямо пропорционально их моляльной концентрации:
∆t0кип = ЕСm; ∆t0зам = КСm,
где
∆t0кип – повышение температуры кипения;
∆t0зам – понижение температуры замерзания;
Е – эбуллиоскопическая константа;
К – криоскопическая константа;
Сm – моляльная концентрация раствора.
Сm = m 1000 ,
M m1
где m – масса растворенного вещества в 1000 г растворителя;
M – молекулярная масса растворенного вещества;
m1 – масса растворителя.
Подставив Сm в уравнение (I), получим:
∆t0кип = Е | m 1000 | , ∆t0зам | = К | m 1000 | , | |
M m1 | M m1 | |||||
Зная | t0кип или t0зам можно найти молекулярную массу растворенного | |||||
вещества (М), эбуллиоскопическую (Е) или криоскопическую (К) константы.
Например. Определить температуру кипения 10% – го растворы глюкозы в воде. Е Н 2О = 0,520.
Решение. В 10% – ом растворе глюкозы в 100г раствора содержится 10г глюкозы и 90 г растворителя. Подставив конкретные значения:
Е Н 2О = 0,520, m = 10г; m1 = 90г
МС6 Н12О8 = 180 в уравнение (II) , получим
t0кип = 0,52 10 1000 = 0,3200
180 90
114
Вода кипит при р = 760 мм.рт.ст. при 1000С, поэтому температура кипения раствора равна 100 + 0,32 = 100,320С.
КОНТРОЛЬНЫЕ ЗАДАНИЯ
181. К 1 литру раствора с массовой долей HCl 20 % (ρ = 1,100 г/см3) добавили 400 см3 раствора с массовой долей HCl 5 % (ρ = 1,024 г/см3). Вычислите массовую долю HCl в полученном растворе. Ответ: 15,93%
182. Вычислить молярную концентрацию раствора сульфата калия, 20 мл которого содержат 1,74 г этой соли. Ответ: 0,5моль/л.
183.Сколько граммов оксида кальция содержится в 200 мл 0,3 н. раствора? Рассчитать титр раствора. Ответ: 37 г/моль; Т = 0,0111 г/мл.
184.Вычислить температуры кристаллизации, и кипения раствора с массовой долей сахара C12H22O11 = 5 %. Ответ: 0,060С; 100,060С
185.Рассчитайте, при какой температуре будет кристаллизоваться раствор, содержащий в 200 г бензола, 12 г нафталина? Ответ: 2,150С.
186.В каком количестве воды следует растворить 20 г глюкозы, чтобы получить раствор с температурой кипения 100,2 С? Ответ: 289 г
187.При растворении 6,9 г глицерина в 500 г воды температура замерзания понизилась на 0,279 С. Определите молярную массу глицерина. Ответ: 92 г/моль
188.Вычислите: а) процентную (С%); б) молярную (СM); в) эквивалентную (Сн); г) моляльную (См) концентрации раствора Н3РО4, полученного при растворении 18 г кислоты в 282 см3 воды, если плотность его 1,031 г/см3. Чему равен титр T этого раствора? Ответ:
С% = 6%; б) СM = 0,63 М; в) Сн = 1,89 Н; г) См = 0,65 м; Т = 0,06186
г/см3.
189.На нейтрализацию 50 см3 раствора кислоты израсходовано 25 см3 0,5 н раствора щелочи. Чему равна нормальность кислоты? Ответ: 0,25Н
190.К 1 л 10%-ного раствора КОН (ρ = 1,092 г/см3) прибавили 0,5 л 5%- ного раствора КОН (пл. 1,045 г/см3). Объем смеси довели до 2 л. Вычислите молярную концентрацию полученного раствора. Ответ: 1,2 М
191.Какой объем 96%-ной кислоты (ρ = 1,84 г/см3) потребуется для приготовления 3 л 0,4 н раствора? Ответ: 33,32 см3
192.В какой массе воды надо растворить 44,8 л HCl (объем измерен при н. у.), чтобы получить 26 %-й раствор HCl? Ответ: 207,8 г
115
193.Какую массу воды надо прибавить к 3 моль К2SO4 . 7H2O, чтобы получить 9 %-й раствор К2SO4? Ответ: 4900 г
194.Какой объем 0,3 М раствора Na3(PO4)2 можно приготовить из 250 мл 1,5 н. раствора? Ответ: 417 мл
195.Плотность 12 %-го раствора Na2SO3 равна 1,08 г/мл. Вычислить
моляльность, молярность и эквивалентную концентрацию (нормальность) этого раствора. Ответ: Ст = 1,08 т; СМ = 1,03 М; СН = 2,06 Н
196.Сколько граммов поваренной соли и воды необходимо для приготовления 2 кг 20 % – го раствора? Ответ: 400 г соли; 1600 г воды
197.Сколько граммов КОН нужно взять для приготовления 500 мл 0,1М раствора? Ответ: 2,8 г
198.Сколько миллилитров 96 %-ной H2SO4 (р = 1,84 г/мл) нужно взять для приготовления 1 л 0,5 н. раствора? Ответ: 13,84 мл
199.Вычислить температуру замерзания раствора содержащего 54 г
глюкозы С6Н12О6 в 250г воды. Криоскопическая константа воды равна
1,86 0С. Ответ: – 2,230С
200.К 1л 10%-ного раствора КОН (ρ = 1,092г/см3) прибавили 0,5л 5%- ного раствора КОН (ρ = 1,045г/см3). Объем смеси довели до 2 л. Вычислите молярную концентрацию полученного раствора. Ответ: 1,2 М
201.Из образца горной породы массой 25 г, содержащей минерал аргентит Ag2S, выделено серебро массой 5,4 г. Определите массовую долю аргентита в образце. Ответ: 24,8%
202.Определите простейшую формулу соединения калия с марганцем и кислородом, если массовые доли элементов в этом веществе составляют соответственно 24,7; 34,8 и 40,5%. Ответ: KMnO4.
203.Сколько литров 6 н раствора NaOH следует добавить к 4,5 литрам 0,8 н раствора NaOH, чтобы смешанный раствор оказался двунормальным?
Ответ: 1,35 л
204.Смешали 247 г 62%-ного и 145 г 18%-ного раствора серной кислоты. Чему равна процентная концентрация полученного раствора? Ответ: 45,57%
205.Вычислите молярную и эквивалентную концентрации 49% раствора H3PO4 плотностью 1,33 г/мл. Ответ: Cм = 0,6 М; Cн = 2 Н
116
206.Какую массу NaNO3 нужно растворить в 400 г воды, чтобы приготовить 20%-ный раствор? Ответ: 100 г
207.Сколько граммов 3% раствора MgSO4 можно приготовить, растворив в воде MgSO4 . 7H2O? Ответ: 16,3 г
208.Какой объем 10% раствора карбоната натрия (ρ = 1,105 г/мл) требуется для приготовления 5 л 2% раствора (ρ = 1,02 г/мл)? Ответ: 0,9 л
209.К 3 л 10% раствора HNO3 плотностью 1,054 г/мл прибавили 5 л 2% раствора той же кислоты плотностью 1,009 г/мл. Вычислите процентную и молярную концентрации полученного раствора, объем которого равен 8 л. Ответ: 5,082%; СМ = 0,83М
210.Какая масса HNO3 содержалась в растворе, если на нейтрализацию его потребовалось 35 см3 0,4 н раствора NaOH? Каков титр раствора
NaOH? Ответ: 0,882 г; ТNaOH = 0,016 г/мл
РАЗДЕЛ 8. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ.
Окислительно-восстановительные реакции (ОВР) – это такие химические реакции, в которых происходит передача электронов от одних частиц (атомов, молекул, ионов) к другим, в результате чего степень окисления атомов, входящих в состав этих частиц, изменяется.
Наличие атомов, у которых в ходе реакции изменяется степень окисления – характерный признак ОВР.
Протекание химических реакций в целом обусловлено обменом частицами между реагирующими веществами. Часто обмен сопровождается переходом электронов от одной частицы к другой. Так, при вытеснении цинком меди в растворе сульфата меди (II)
Zn (т) + CuSO4 (р) = ZnSO4 (p) + Cu (т)
электроны от атомов цинка переходят к ионам меди: Zn (т) = Zn2+ (p) + 2e,
Cu2+ (р) + 2e = Cu (т) ,
или суммарно: | Zn (т) + Cu2+ (р) = Zn2+ (p) + Cu (т). |
Процесс потери | электронов частицей называют окислением, а |
процесс приобретения электронов – восстановлением. Окисление и восстановление протекают одновременно, поэтому взаимодействия, сопровождающиеся переходом электронов от одних частиц к другим,
называют окислительно-восстановительными реакциями.
Для удобства описания окислительно-восстановительных реакций используют понятие степени окисления (n) – формальный заряд, который
117
можно приписать атому, входящему в состав какой-либо частицы (молекулы, иона), исходя из предположения о чисто ионном характере связи в данной частице (частица состоит из ионизированных атомов). Следует помнить, что величина n выражается не в кулонах, а в количестве отданных (принятых) электронов. Заряд одного электрона равен –
1.60218·10-19Кл.
Протекание окислительно-восстановительных реакций сопровождается изменением степеней окисления элементов участвующих в реакции веществ. При восстановлении степень окисления элемента уменьшается, при окислении – увеличивается. Вещество, в состав которого входит элемент, понижающий степень окисления, называют окислителем, вещество, в состав которого входит элемент, повышающий степень окисления, называют восстановителем.
Степень окисления элемента в соединении определяют в соответствии со следующими правилами:
1.степень окисления элемента в простом веществе равна нулю;
2.алгебраическая сумма всех степеней окисления атомов в молекуле равна нулю;
3.алгебраическая сумма всех степеней окисления атомов в сложном ионе, а также степень окисления элемента в простом одноатомном ионе равна заряду иона;
4.отрицательную степень окисления проявляют в соединении атомы элемента, имеющего наибольшую электроотрицательность;
5.максимально возможная (положительная) степень окисления элемента соответствует номеру группы, в которой расположен элемент в Периодической таблице Д.И. Менделеева.
6.В соединениях с ионным и ковалентно-полярным характером связи более электроотрицательным атомам соответствует более низкая степень окисления
7.В бинарных ионных соединениях, атомы неметалла, как правило, проявляют минимальные степени окисления
8.Постоянную степень окисленности в соединениях проявляют щелочные металлы (+1), металлы главной подгруппы II группы (+2)
9.При определении степени окисления предпочтение отдают элементу, который располагается в таблице выше. Например, в CaO : n(Сa) = +2,
2
n(О) = – 1
118
10.степень окисленности кислорода в соединениях равна –2 , за исключением пероксидов (-1) и фторида кислорода OF2 (+2).
11.водород проявляет степень окисленности +1 во всех соединениях, кроме гидридов металлов (NaH, CaH2 и т.п.), где степень окисленности равна –1;
Ряд элементов в соединениях проявляют постоянную степень окисления, что используют при определении степеней окисления других элементов:
1)фтор, имеющий наивысшую среди элементов электроотрицательность, во всех соединениях имеет степень окисления –1;
2)водород в соединениях проявляет степень окисления +1, кроме гидридов металлов (–1);
3)металлы IA подгруппы во всех соединениях имеют степень окисления +1; 4) металлы IIA подгруппы, а также цинк и кадмий во всех соединениях имеют степень окисления +2;
4)степень окисления алюминия в соединениях +3;
5)степень окисления кислорода в соединениях равна –2, за исключением соединений, в которых кислород присутствует в виде молекулярных
ионов: О2+, О2 , О22 , О3 , а также фторидов OxF2.
Степени окисления атомов элементов в соединении записывают над символом данного элемента, указывая вначале знак степени окисления, а
1 +7 -2
затем ее численное значение, например, K Mn O 4, в отличие от заряда иона, который записывают справа, вначале указывая зарядовое число, а затем знак: Fe2+, SO42–.
Окислительно-восстановительные свойства атомов различных элементов проявляются в зависимости от многих факторов, важнейшие из которых – электронное строение элемента, его степень окисления в веществе, характер свойств других участников реакции. Соединения, в состав которых входят атомы элементов в своей максимальной (положительной)
степени окисления, например, K Mn O4, K2 Cr 2O7, H N O3, Pb O2, могут только восстанавливаться, выступая в качестве окислителей. Соединения, содержащие элементы в их минимальной степени окисления, например,
-3 | -2 | -1 | могут только окисляться и выступать в качестве | |||
N H3, | H2 S , | H I , | ||||
восстановителей. | Вещества, содержащие | элементы | в промежуточных | |||
+3 | -1 | 0 0 +3 < | ||||
