Какая масса hno3 содержалась в растворе если на нейтрализацию

Решение задачи по химии на закон эквивалентов
Задание 155.
Какая масса HNO3 содержалась в растворе, если на нейтрализацию его потребовалось 35 см3 0,4 н. раствора NaOН? Каков титр раствора NaOН? Ответ: 0,882 г; 0,0 16 г/см3.
Решение:
Эквивалентная масса HNO3 равна : МЭ(HNO3) = М(HNO3)/1 = 63/1 = 63 г/моль. Эквивалентная масса NaOH равна : МЭ(NaОН) = М(NaОН)/1 = 40/1 = 40 г/моль. Молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворенного вещества, содержащихся в 1 л раствора. Находим число эквивалентов NaOН , содержащихся в 35 см3 его раствора из пропорции:
1000 : 0,4 = 35 : х; х = (0,4 . 35)/1000 = m0,014Н.
Из закона эквивалентов следует, что вещества реагируют друг с другом в эквивалентных соотношениях. Находим массу HNO3 по формуле:
m(HNO3) = МЭ(HNO3) . СН(HNO3) = 63 . 0,014 = 0,882 г
Титром раствора называют число граммов растворенного вещества в 1 см3 (мл) раствора. Находим массу гидроксида натрия, содержащегося в 1 л 0,4Н раствора его:
m(NaOH) = МЭ(NaOH) . СН(NaOH) = 40 . 0,4 = 16 г.
Отсюда
Т(NaOH) = 16/1000 = 0,016 г/см3.
Можно титр раствора рассчитать, зная концентрацию эквивалента (СН) и массу эквивалента (МЭ) растворённого вещества по формуле:
Т = СН .МЭ(В)/1000;
Т(NaOH) = 0,4 . 40/1000 = 0,016 г/см3.
Ответ: 0,882 г; 0,0 16 г/см3.
Приготовление раствора
Задание 156.
Какую массу NaNO3 нужно растворить в 400 г воды, чтобы приготовить 20%-ный раствор? Ответ: 100 г.
Решение:
Для расчета используем формулу:
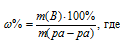
m(B) – масса растворённого вещества; m(Ра-ра) – масса раствора, которая составляет сумму масс растворителя и растворённого вещества [m(ра-ра) = m(ра-ля) + m(В); – массовая доля растворённого вещества в процентах.
Обозначим массу растворённого вещества через х и подставим данные задачи в уравнение, получим искомую массу NaNO3:
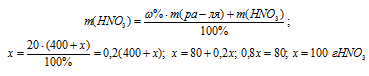
Ответ: 100 г.
Массовая доля раствора
Задание 157.
Смешали 300 г 20%-ного раствора и 500 г 40%-ного раствора NaСI. Чему равна массовая доля полученного раствора? Ответ: 32,5%.
Решение:
Находим массу растворённого вещества в каждом из смешиваемых растворов и суммировав их, получим массу растворённого вещества в смеси:
m(20%) = 300 .20/100 = 60 г;
m(40%) = 500 . 40/100 = 200 г.
Для вычисления массовой доли смеси слагаем массы вещества, растворённого в обоих растворах, и берём отношение массы растворённого вещества в смеси, выразив его в процентах, получим:
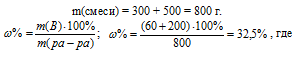
m(B) – масса растворённого вещества m(смеси); m(Ра-ра) – масса раствора, которая составляет сумму масс растворителя и растворённого вещества [m(ра-ра) = m(ра-ля) + m(В); – массовая доля растворённого вещества в процентах.
Ответ: 32,5%.
Задание 158.
Смешали 247 г 62%-ного и 145 г 18%-ного раствора серной кислоты. Какова массовая доля полученного раствора? Ответ: 45,72%.
Решение:
Находим массу растворённого вещества в каждом из смешиваемых растворов и суммировав их, получим массу растворённого вещества в смеси:
m(62%) = 247 .62/100 = 153,14 г;
m(18%) = 145 .18/100 = 26,1 г;
m(H2SO4) = 153,14 + 26,1 = 179,24 г.
Для вычисления массовой доли смеси слагаем массы вещества, растворённого в обоих растворах, и берём отношение массы растворённого вещества в смеси, выразив его в процентах, получим:
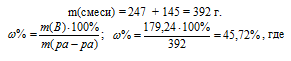
m(B) – масса растворённого вещества m(смеси); m(Ра-ра) – масса раствора, которая составляет сумму масс растворителя и растворённого вещества [m(ра-ра) = m(ра-ля) + m(В); – массовая доля растворённого вещества в процентах.
Ответ: 45,72%.
Задание 159.
Из 700 г 60%-ной серной кислоты выпариванием удалили 200 г воды. Чему равна массовая доля оставшегося раствора? Ответ: 84%.
Решение:
Находим массу серной кислоты в растворе:
m(H2SO4) = (700 .60)/100 = 420 г.
Находим массу раствора после выпаривания:
m(ра-ра) = 700 – 200 = 500 г.
Находим массовую долю оставшегося раствора из формулы:
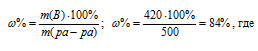
m(B) – масса растворённого вещества m(смеси); m(Ра-ра) – масса раствора, которая составляет сумму масс растворителя и растворённого вещества [m(ра-ра) = m(ра-ля) + m(В); -массовая доля растворённого вещества в процентах.
Ответ: 84%.
Задание 160.
Из 10 кг 20%-ного раствора при охлаждении выделилось 400 г соли. Чему равна массовая доля охлажденного раствора? Ответ. 16,7%.
Решение:
Находим массу соли, содержащуюся в растворе:
m(соль) = (10000 .20)/100 = 2000 г.
Находим массу соли после выпаривания:
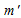 (ра-ра) = 2000 – 400 = 1600 г.
(ра-ра) = 2000 – 400 = 1600 г.
Находим массу раствора после охлаждения:
m(ра-ра) = 10000 – 400 = 9600 г.
Находим массовую долю оставшегося раствора из формулы:
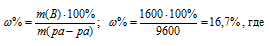
m(B) – масса растворённого вещества m(смеси); m(Ра-ра) – масса раствора, которая составляет сумму масс растворителя и растворённого вещества [m(ра-ра) = m(ра-ля) + m(В); – массовая доля растворённого вещества в процентах.
Ответ. 16,7%.
Источник
- Главная
- Вопросы & Ответы
- Вопрос 2156461
более месяца назад
Просмотров : 45
Ответов : 1
Лучший ответ:

Если будут вопросы с почерком обращайся
более месяца назад
Ваш ответ:
Комментарий должен быть минимум 20 символов
Чтобы получить баллы за ответ войди на сайт

Лучшее из галереи:































Другие вопросы:
Спортивный магазин проводит акцию: «Любая футболка по цене 300 рублей. При покупке двух футболок — скидка на вторую 60%». Сколько рублей придётся заплатить за покупку двух футболок?
более месяца назад
Смотреть ответ
Просмотров : 20
Ответов : 1
Цена деления шкалы 100 200 300 400 500,
более месяца назад
Смотреть ответ
Просмотров : 9
Ответов : 1
история создания стихотворения ” Я помню чудное мгновенье”
более месяца назад
Смотреть ответ
Просмотров : 12
Ответов : 1
Помогите вставить артикли и предлоги 🙂
более месяца назад
Смотреть ответ
Просмотров : 7
Ответов : 1
1.Составьте хронологию событий Украинской революции
более месяца назад
Смотреть ответ
Просмотров : 7
Ответов : 1
Источник
Шиманович И. Л. Химия: методические указания, программа, решение типовых задач, программированные вопросы для самопроверки и контрольные задания для студентов-заочников инженерно-технических (нехимических) специальностей вузов / И. Л. Шиманович. – 3-е изд., испр. – М.: Высш. шк., 2003. – 128 с.
141. Вычислите молярную и эквивалентную концентрации 20%-ного раствора хлорида кальция плотностью 1,178 г/см3. Решение
142. Чему равна нормальность 30%-ного раствора NaOH плотностью 1,328 г/см3? К 1 л этого раствора прибавили 5 л воды. Вычислите процентную концентрацию полученного раствора. Решение с ключом
143. К 3 л 10%-ного раствора НNО3 плотностью 1,054 г/см3 прибавили 5 л 2%-ного раствора той же кислоты плотностью 1,009 г/см3. Вычислите процентную и молярную концентрацию полученного раствора, объем которого равен 8 л. Решение с ключом
144. Вычислите эквивалентную и моляльную концентрации 20,8%-ного раствора НNО3 плотностью 1,12 г/см3. Сколько граммов кислоты содержится в 4 л этого раствора? Решение с ключом
145. Вычислите молярную, эквивалентную и моляльную концентрации 16%-ного раствора хлорида алюминия плотностью 1,149 г/см3. Решение с ключом
146. Сколько и какого вещества останется в избытке, если к 75 см3 0,3 н. раствора H2SO4 прибавить 125 см3 0,2 н. раствора КОН? Решение
147. Для осаждения в виде АgСl всего серебра, содержащегося в 100 см3 раствора АgNО3, потребовалось 50 см3 0,2 н. раствора HCl. Какова нормальность раствора АgNО3? Какая масса AgCl выпала в осадок? Решение с ключом
148. Какой объем 20,01%-ного раствора HCl (пл. 1,100 г/см3) требуется для приготовления 1 л 10,17%-ного раствора (пл. 1,050 г/см3)? Решение с ключом
149. Смешали 10 см3 10%-ного раствора HNO3 (пл. 1,056 г/см3) и 100 см3 30%-ного раствора HNO3 (пл. 1,184 г/см3). Вычислите процентную концентрацию полученного раствора. Решение с ключом
150. Какой объем 50%-ного раствора КОН (пл. 1,538 г/см3) требуется для приготовления 3 л 6%-ного раствора (пл. 1,048 г/см3)? Решение
151. Какой объем 10%-ного раствора карбоната натрия (пл. 1,105 г/см3) требуется для приготовления 5 л 2%-ного раствора (пл. 1,02 г/см3)? Решение
152. На нейтрализацию 31 см3 0,16 н. раствора щелочи требуется 217 см3 раствора H2SО4. Чему равны нормальность и титр раствора H2SО4? Решение с ключом
153. Какой объем 0,3 н. раствора кислоты требуется для нейтрализации раствора, содержащего 0,32 г NaOH в 40 см3? Решение
154. На нейтрализацию 1 л раствора, содержащего 1,4 г КОН, требуется 50 см3 раствора кислоты. Вычислите нормальность раствора кислоты. Решение с ключом
155. Какая масса HNO3 содержалась в растворе, если на нейтрализацию его потребовалось 35 см3 0,4 н. раствора NaOH? Каков титр раствора NaOH? Решение с ключом
156. Какую массу NаNО3 нужно растворить в 400 г воды, чтобы приготовить 20%-ный раствор? Решение
157. Смешали 300 г 20%-ного раствора и 500 г 40%-ного раствора NaCl. Чему равна процентная концентрация полученного раствора? Решение с ключом
158. Смешали 247 г 62%-ного и 145 г 18%-ного раствора серной кислоты. Какова процентная концентрация полученного раствора? Решение с ключом
159. Из 700 г 60%-ной серной кислоты выпариванием удалили 200 г воды. Чему равна процентная концентрация оставшегося раствора? Решение
160. Из 10 кг 20%-ного раствора при охлаждении выделилось 400 г соли. Чему равна процентная концентрация охлажденного раствора? Решение с ключом
Источник
Все
вещества, вступающие друг с другом в
химические реакции, реагируют в
количествах, пропорциональных химическим
эквивалентам этих веществ. Например, в
реакции нейтрализации
NaOH
+ Hcl
NaCl
+ H2O
количество
вещества щелочи, израсходованное на
реакцию, всегда эквивалентно количеству
вещества кислоты, прореагировавшему в
данной химической реакции:
N(NaOH)
= N(HCl),
или
CН(NaOH)
V(NaOH)
= CН(HCl)
V(HCl),
где
CН(NaOH)
и CН(HCl)
– эквивалентные концентрации NaOH
и НС1, моль/л; V(NaOH)
и V(HCl)
– объемы растворов NaOH
и НС1, пошедшие на химическую реакцию,
л.
Эквивалентная
концентрация (СН)
представляет собой отношение количества
вещества эквивалента в растворе к объему
этого раствора:
СН
= N/V
(моль/л).
Таким
образом, в общем виде для реагирующих
веществ, находящихся в растворе, закон
эквивалентов можно записать как
СН1V1
= CН2V2.
Пример
1
Для
нейтрализации 42 мл раствора H2SO4
потребовалось добавить 14 мл 0,3 Н раствора
щелочи. Определить молярную концентрацию
кислоты.
Решение
С
Нк
Vк
= CНщ
V2щ,
где
СНк
и CНщ
– эквивалентные концентрации кислоты
и щелочи; Vк
и Vщ
– соответствующие объемы. Следовательно
СНк
= (СНщ
Vщ)/Vк
= 0,314/42
= 0,1 моль экв/л.
Фактор
эквивалентности H2SO4
f
= 1/2
CМ
= fСН
=1/2
0,1 = 0,05 моль/л.
Задачи для самостоятельного решения
Для
нейтрализации 30 мл 0,1 Н раствора щелочи
потребовалось 12 мл кислоты. Определить
эквивалентную концентрации кислоты.Какой
объем 0,2 Н раствора щелочи потребуется
для осаждения в виде Fe(OH)3
всего железа, содержащегося в 100 мл 0,5
Н раствора FeCl3
?Для
нейтрализации 20 мл 0,1 Н раствора кислоты
потребовалось 8 мл NaOH.
Сколько г NaOH
содержит 1 л этого раствора ?На
нейтрализацию 40 мл раствора щелочи
израсходовано 24 мл 0,5 Н раствора H2SO4.
Какова нормальная концентрация щелочи?
Какой объем 0,5 Н раствора НС1 потребовался
бы для той же цели ?Для
нейтрализации 20 мл раствора, содержащего
2.4 г кислоты, потребовалось 25 мл 2 Н
раствора щелочи. Определить нормальность
раствора кислоты и ее эквивалентную
массу.На
нейтрализацию 20 мл раствора, содержащего
в 1 л 12 г щелочи, израсходовано 24 мл 0,25
Н раствора кислоты. Рассчитать
эквивалентную массу щелочи.Вычислить
эквивалентную массу гексафторкремниевой
кислоты, если на нейтрализацию 25 мл
раствора, содержащего 0,18 г кислоты,
пошло 50 мл раствора NaOH,
содержащего 0,1 г щелочи.К
250 мл 1,6 Н H2SO4
добавили 400 мл 0,35 Н NaOH.
Сколько мл щелочи дополнительно
требуется добавить до полной нейтрализации.К
100 мл 0,2 Н H2SO4
добавили
200 мл NaOH
с концентрацией 0,01 экв/л. Сколько
миллилитров 0,1 Н NaOH
нужно еще добавить до полной нейтрализации
раствора?Какой
объем 0,3 Н раствора кислоты требуется
для нейтрализации раствора, содержащего
0,32 г NaOH?Какая
масса HNO3
содержалась в растворе, если на его
нейтрализацию потребовалось 35 мл 0,4 Н
раствора NaOH
?Для
полного осаждения ВаSO4
из 100 г 15 % -раствора BaCl2
потребовалось 14,4 мл раствора H2SO4.
Определить нормальную концентрацию
раствора H2SO4.На
осаждение хлорид-ионов из раствора,
содержащего 0,924 г NaCl,
израсходовано 16,00 мл раствора AgNO3.
Вычислить нормальную концентрацию
раствора нитрата серебра.Сколько
0,50 Н раствора щелочи потребуется, чтобы
осадить в виде Cu(OH)2
всю медь, содержащуюся в 15 мл 1,2 Н
раствора CuCl2?Сколько
миллилитров 0,2 М раствора Na2CO3
требуется
для реакции с 50,0 мл 0,1 Н раствора СаС12
?
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
