Какая масса глюкозы содержится в 250 мл раствора
Глинка Н. Л. Задачи и упражнения по общей химии. Учебное пособие для вузов / Под ред. В. А. Рабиновича и Х. М. Рубиной. – 23-е изд., исправленное – Л.: Химия, 1985. – 264 с., ил.
463. Чему равно осмотическое давление 0,5 М раствора глюкозы C6H12O6 при 25 °С? Решение
464. Вычислить осмотическое давление раствора, содержащего 16 г сахарозы C12H22O11 в 350 г H2O при 293 K. Плотность раствора считать равной единице. Решение с ключом
465. Сколько граммов глюкозы C6H12O6 должно находиться в 0,5 л раствора, чтобы его осмотическое давление (при той же температуре) было таким же, как раствора, в 1 л которого содержится 9,2 г глицерина C3H5(OH)3? Решение с ключом
466. К 100 мл 0,5 М водного раствора сахарозы C12H22O11 добавлено 300 мл воды. Чему равно осмотическое давление полученного раствора при 25 °С? Решение с ключом
467. При 25 °С осмотическое давление некоторого водного раствора равно 1,24 МПа. Вычислить осмотическое давление раствора при 0 °С. Решение
468. При 25 °С осмотическое давление раствора, содержащего 2,80 г высокомолекулярного соединения в 200 мл раствора, равно 0,70 кПа. Найти молекулярную массу растворенного вещества. Решение
469. При 20 °С смешивают 1 л раствора неэлектролита, осмотическое давление которого 243,4 кПа, с 3 л раствора неэлектролита, осмотическое давление которого 486,8 кПа. Найти осмотическое давление смешанного раствора. Решение с ключом
470. Раствор, в 100 мл которого находится 2,30 г вещества, обладает при 298 K осмотическим давлением, равным 618,5 кПа. Определить молекулярную массу вещества. Решение с ключом
471. Сколько молей неэлектролита должен содержать 1 л раствора, чтобы его осмотическое давление при 25 °С было равно 2,47 кПа? Решение
472. В 1 мл раствора содержится 1018 молекул растворенного неэлектролита. вычислить осмотическое давление раствора при 298 K. Решение с ключом
473. Найти при 65 °С давление пара над раствором, содержащим 13,68 г сахарозы C12H22O11 в 90 г H2O, если давление насыщенного пара над водой при той же температуре равно 25,0 кПа (187,5 мм рт. ст.). Решение
474. Чему равно давление насыщенного пара над 10% раствором карбамида CO(NH2)2 при 100 °С? Решение с ключом
475. При 315 K давление насыщенного пара над водой равно 8,2 кПа (61,5 мм рт. ст.). На сколько понизится давление пара при указанной температуре, если в 540 г воды растворить 36 г глюкозы C6H12O6? Решение
476. При 293 K давление насыщенного пара над водой равно 2,34 кПа (17,53 мм рт. ст.). Сколько граммов глицерина C3H5(OH)3 надо растворить в 180 г воды, чтобы понизить давление пара на 133,3 Па (1 мм рт. ст.). Решение с ключом
477. На сколько градусов повысится температура кипения воды, если в 100 г воды растворить 9 г глюкозы C6H12O6? Решение
478. При какой приблизительно температуре будет кипеть 50%-ный (по массе) раствор сахарозы C12H22O11? Решение с ключом
479. При какой приблизительно температуре будет кристаллизоваться 40%-ный (по массе) раствор этилового спирта C2H5OH? Решение с ключом
480. Сколько граммов сахарозы C12H22O11 надо растворить в 100 г воды, чтобы: а) понизить температуру кристаллизации на 1 градус; б) повысить температуру кипения на 1 градус? Решение с ключом
481. В каком отношении должны находиться массы воды и этилового спирта, чтобы при их смешении получить раствор, кристаллизующийся при -20 °С? Решение с ключом
482. В радиатор автомобиля налили 9 л воды и прибавили 2 л метилового спирта (ρ=0,8 г/мл). При какой наинизшей температуре можно после этого оставлять автомобиль на открытом воздухе, не опасаясь, что вода в радиаторе замерзнет? Решение с ключом
483. При растворении 5,0 г вещества в 200 г воды получается не проводящий тока раствор, кристаллизующийся при -1,45 °С. Определить молекулярную массу растворенного вещества. Решение с ключом
484. При растворении 13,0 г неэлектролита в 400 г диэтилового эфира (C2H5)2O температура кипения повысилась на 0,453 K. Определить молекулярную массу растворенного вещества. Решение с ключом
485. При растворении 3,24 г серы в 40 г бензола температура кипения последнего повысилась на 0,81 K. Из скольких атомов состоит молекула серы в растворе? Решение с ключом
486. В 60 г бензола растворено 2,09 г некоторого вещества, элементарный состав [в % (масс.)] которого: C – 50,69, H2 – 4,23 и O2 – 45,08. Раствор кристаллизуется при 4,25 °С. Установить молекулярную формулу вещества. Чистый бензол кристаллизуется при 5,5 °С. Решение с ключом
487. Водно-спиртовый раствор, содержащий 15% спирта (ρ=0,97 г/мл), кристаллизуется при -10,26 °С. Найти молекулярную массу спирта и осмотическое давление раствора при 293 K. Решение с ключом
488. В 100 г H2O содержится 4,57 г сахарозы C12H22O11. Найти: а) осмотическое давление при 293 K; б) температуру кристаллизации раствора; в) температуру кипения раствора; г) давление насыщенного пара над раствором при 293 K. Давление насыщенного пара над водой при 293 K равно 2,337 кПа (17,53 мм рт. ст.). Плотность раствора считать равной плотности воды. Решение с ключом
489. Температура кипения водного раствора сахарозы C12H22O11 равна 101,4 °С. Вычислить моляльную концентрацию и массовую долю сахарозы в растворе. При какой температуре замерзает этот раствор? Решение с ключом
490. Чему равно при 0 °С осмотическое давление раствора, содержащего 1 моль глицерина в 22,4 л H2O: а) 1,01·102 кПа; б) 1,01·105 кПа в) 760 мм рт. ст.? Решение
491. Чему равно при 273 K осмотическое давление раствора, содержащего одновременно 0,25 моля спирта и 0,25 моля глюкозы в 2 л H2O: а) 760 мм рт. ст.; б) 380 мм рт. ст.; в) 4256 мм рт. ст.? Решение
492. Как соотносятся осмотические давления при 273 K, если в 250 мл воды растворено 5 г спирта C2H5OH (P1), 5 г глюкозы C6H12O6 (P2), 5 г сахарозы C12H22O11 (P3): а) P3>P2>P1; б) P1>P2>P3? Решение с ключом
493. Чему равно отношение масс формалина HCHO и глюкозы C6H12O6, которые содержатся в равных объемах растворов, обладающих при данной температуре одинаковым осмотическим давлением: а) 1:1; б) MHCHO:MC6H12O6? Решение с ключом
494. Сколько молей неэлектролита должен содержать 1 л раствора, чтобы его осмотическое давление при 0 °С было равно 2,27 кПа (17 мм рт. ст.): а) 0,001 моля; б) 0,01 моля; в) 0,1 моля? Решение
495. Какова молярность раствора неэлектролита, если при 0 °С его осмотическое давление равно 2,27 кПа: а) 0,1 моль/л; б) 0,01 моль/л; в) 0,001 моль/л? Решение
496. При какой температуре кристаллизуется водный раствор, содержащий 3·1023 молекул неэлектролита в 250 г H2O: а) 273 K; б) 269,28 K; в) 271,14 K? Решение с ключом
497. Как соотносятся температуры кристаллизации 0,1%-ных (по массе) растворов глюкозы (t1; M=180) и альбумина (t2; M=68000): а) t1>t2; б) t1=t2; в) t1<t2? Решение с ключом
498. Как соотносятся температуры кипения 10%-ных (по массе) растворов CH3OH (t1) и C2H5OH (t2): а) t1>t2; б) t1<t2; в) t1=t2? Решение с ключом
499. В 200 г воды растворено: 1) 31 г карбамида CO(NH2)2; 2) 90 г глюкозы C6H12O6. Будет ли температура кипения этих растворов одинакова: а) да; б) нет? Решение с ключом
500. В 250 г органического растворителя содержатся g г растворенного неэлектролита с молекулярной массой M. Криоскопическая постоянная растворителя равна K. Какое выражение для Δtкрист правильно: а) Kg/M; б) 4Kg/M; в) Kg/4M? Решение
501. Некоторый водный раствор неэлектролита кипит при 373,52 K. Какова моляльная концентрация этого раствора: а) m=1; б) m=0,1; в) m=0,01 моль на 1000 г H2O? Решение
Источник
Примеры решения задач
1.1. ПРОЦЕНТНАЯ КОНЦЕНТРАЦИЯ
Пример 1
а) Определите массовую долю (%) хлорида калия в растворе, содержащем 0,053 кг KCl в 0,5 л раствора, плотность которого 1063 кг/м3.
Решение:
Массовая доля ω или С% показывает, сколько единиц массы растворенного вещества содержится в 100 единицах массы раствора. Массовая доля – безразмерная величина, ее выражают в долях единицы или процентах:
где ωA – массовая доля (%) растворенного вещества;
mA- масса растворенного вещества, г;
mр-ра – масса раствора, г.
Масса раствора равна произведению объема раствора V на его плотность ρ:
m=ρV, тогда
Массовая доля хлорида калия в растворе равна:
Пример 2
Какой объем раствора азотной кислоты с массовой долей HNO3 30% (ρ=1180кг/м3) требуется для приготовления 20 л 0,5 М раствора этой кислоты?
Решение: Сначала определяем массу азотной кислоты в 20 л 0,5 М раствора:
M (HNO3)=63,01 г/моль;
mHNO3=0,5∙63,01∙20=630,1 г.
Определим, в каком объеме раствора с массовой долей HNO3 30% содержится 630,1 г HNO3 :
Следовательно , чтобы приготовить 20 л 0,5 М HNO3, надо израсходовать всего 1,78 л раствора азотной кислоты с массовой долей HNO3 равной 30%.
Пример 3
Какую массу раствора с массовой долей КОН 20% надо прибавить к 250 г раствора с массовой долей КОН 90%, чтобы получить раствор с ωКОН=50 %?
Решение: Задача решается с помощью правила смешения. Массу раствора с массовой долей КОН 20 % обозначим через х.
Тогда 3х=1000; х=333,3.
Для получения раствора с массовой долей КОН 50 % необходимо к 250 г раствора КОН с ω=90 % прибавить 333,3 г раствора КОН с 20 %.
Задачи такого типа решают с помощью диагональной схемы или «правила креста»: точкой пересечения двух отрезков прямой обозначают свойства смеси, которую необходимо получить.
20 (90-50)=40
50
90 (50-20)=30
Массы исходных растворов, необходимые для приготовления смеси, обратно пропорциональны разностям между концентрациями заданного и менее концентрированного раствора и более концентрированного и заданного растворов:
Также эту задачу можно решить, учитывая, что при сливании двух растворов суммируется масса растворенного вещества. Пусть масса 20% раствора х г, тогда масса КОН в нем 0,2 х. Масса КОН во втором растворе 0,9 · 250 = 225 г. Масса вещества в итоговом растворе 0,5 · (250 + х). Таким образом,
0,2х + 225 = 0,5(250+х); х=333,3 г.
1.2. МОЛЯРНАЯ И ЭКВИВАЛЕНТНАЯ КОНЦЕНТРАЦИИ
Пример 1
Какова масса NaOH, содержащегося в 0,2 л раствора, если молярная концентрация раствора 0,2 моль/л?
Решение:
Молярная концентрация См или М (молярность) показывает количество растворенного вещества, содержащегося в 1 л раствора.
Молярную концентрацию (моль/л) выражают формулой
где m1 – масса растворенного вещества, г;
M – молярная масса растворенного вещества, г/моль;
V – объем раствора, л.
M (NaOН)=40 г/моль. Масса NaOH, содержащегося в растворе, равна
MNaOH=MV=0,2∙40∙0,2=1,6 г.
Пример 2
Определите молярную концентрацию эквивалента хлорида железа (ІІІ), если в 0,3 л раствора содержится 32,44 г FeCl3.
Решение:
Молярная концентрация эквивалента вещества (нормальность) показывает число молярных масс эквивалентов растворенного вещества, содержащихся в 1л раствора (моль/л):
где mА – масса растворенного вещества, г;
M (1/zА) – молярная масса эквивалента растворенного вещества, г/моль;
V – объем раствора, л.
Молярная масса эквивалента FeCl3 равна
Молярная концентрация эквивалента раствора FeCl3 равна
Пример 3
Определите концентрацию раствора КОН, если на нейтрализацию 0,035 л 0,3 н. H3PO4 израсходовано 0,02 л раствора КОН.
Решение:
Из закона эквивалентов следует, что количество эквивалентов веществ участвующих в химической реакции одинаково. В реакции участвуют 0,035·0,3=0,0105 эквивалента фосфорной кислоты. Для нейтрализации H3PO4
потребуется такое же количество вещества эквивалента КОН, т.е.
V(H3PO4)СН(H3PO4)=V(KOH)СН(KOH).
Отсюда
1.3. МОЛЯЛЬНАЯ КОНЦЕНТРАЦИЯ (МОЛЯЛЬНОСТЬ) , МОЛЬНАЯ ДОЛЯ, ТИТР
Пример 1
В какой массе эфира надо растворить 3,04 г анилина C6H5NH2 , чтобы получить раствор, моляльность которого равна 0,3 моль/кг?
Решение:
Моляльность раствора Сm (моль/кг) показывает количество растворенного вещества, находящегося в 1 кг растворителя:
где mр-ля – масса растворителя, кг;
n (А) – количество растворенного вещества, моль.
M (C6H5NH2 ) – 99,13 г/моль.
Масса растворителя (эфира) равна:
тогда
Пример 2
Определите титр 0,01 н. КОН.
Решение:
Титр раствора показывает массу (г) растворенного вещества, содержащегося в 1 мл раствора. В 1 л 0,01 н. КОН содержится 0,564 г КОН. Титр этого раствора равен:
Т= 0,561/1000=0,000561 г/мл.
Пример 3
Рассчитайте молярные доли глюкозы C6H12O6 и воды в растворе с массовой долей глюкозы 36 %.
Решение:
Мольная доля вещества А(χА) в растворе равна отношению количества данного вещества nА к общему количеству всех веществ, содержащихся в растворе:
где ( ) количество всех веществ, содержащихся в растворе.
В 100 г раствора с массовой долей глюкозы, равной 36 %, содержится 36 г глюкозы и 64 г воды:
nC6H12O6 =36/180=0,20 моль;
nH2O= 64/18= 3,56 моль;
nC6H12O6 + nH2O= 0,20 + 3,56 =3,76 моль;
χC6H12O6= 0,20/3,76= 0,053;
χH2O= 3,56/3,76= 0,947.
Сумма молярных долей всех компонентов раствора равна 1.
Пример 4
Вычислите молярную концентрацию эквивалента, молярную концентрацию и моляльность раствора, в котором массовая доля CuSO4 равна 10 %. Плотность раствора 1107 кг/м3.
Решение:
Определим молярную массу и молярную массу эквивалента CuSO4:
M (CuSO4)= 159,61 г/моль; M(1/2 CuSO4)=
В 100 г раствора с ωCuSO4=10 % содержится 10,0 г CuSO4 и 90 г H2O.
Следовательно, моляльность раствора CuSO4 равна
Сm(CuSO4/H2O)=10/(159,61∙0,09)=0,696 моль/кг.
Молярная концентрация и молярная концентрация эквивалента относятся к 1л раствора:
mр-ра= ρV= 1107·10-3=1,107 кг.
В этой массе раствора содержится 1,107·0,1=0,1107 кг CuSO4, что составляет 110,7/159,61=0,693 моль, или 0,693·2=1,386 экв.
Молярная концентрация и молярная концентрация эквивалента данного раствора соответственно равны 0,693 и 1,386 моль/л.
1.4. ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ. ЗАКОН ВАНТ- ГОФФА
Пример 1
Вычисление осмотического давления растворов.
Вычислите осмотическое давление раствора, содержащего в
1,4 л 63 г глюкозы С6Н12О6 при 0°С.
Решение:
Осмотическое давление раствора определяют согласно закону Вант-Гоффа:
Pocм = nRT/V,
где п — количество растворенного вещества, моль;
V – объем раствора, м3;
R — молярная газовая постоянная, равная 8,3144 Дж/(моль-К).
В 1,4 л раствора содержится 63 г глюкозы, молярная масса которой равна 180,16 г/моль. Следовательно, в 1,4л раствора содержится
n= 63/180,16=0,35моль глюкозы.
Осмотическое давление этого раствора глюкозы:
Пример 2
Определение молекулярной массы неэлектролита по осмотическому давлению раствора.
Рассчитайте молекулярную массу неэлектролита, если в 5л раствора содержится 2,5 г неэлектролита. Осмотическое давление этого раствора равно 0,23∙105 Па при 20°С.
Решение:
Заменив п выражением m/M, где т — масса растворенного вещества, а М — его молярная масса, получим
Росм = mRT/(MV).
Отсюда молярная масса растворенного вещества равна
Следовательно, молекулярная масса неэлектролита равна 52,96
Росм кПа: R=8,31 Дж/моль∙К;
Росм мм Hg ст.: R=62,32 л∙мм.рт.ст./град.∙моль;
Росм. атм.: R=0,082 л∙атм../град.∙моль.
1.5.ДАВЛЕНИЕ НАСЫЩЕННОГО ПАРА РАСТВОРОВ. ТОНОМЕТРИЧЕСКИЙ ЗАКОН РАУЛЯ
Пример 1. а) Вычислите давление пара над раствором, содержащим 34,23 г сахара C12H22O11 в 45,05 г воды при 65 ºС, если давление паров воды при этой температуре равно 2,5·104 Па.
Решение:
Давление пара над раствором нелетучего вещества в растворителе всегда ниже давления пара над чистым растворителем при той же температуре. Относительное понижение давления пара растворителя над раствором согласно закону Рауля выражается соотношением
где p0 – давление пара над чистым растворителем;
p – давление пара растворителя над раствором;
n – количество растворенного вещества, моль;
N – количество растворителя, моль;
M (C12H22O11) = 342,30 г/моль;
M (H2O) = 18,02 г/моль.
Количество растворенного вещества и растворителя: n=34,23/342,30=0,1 моль; N = 45,05/18,02= 2,5моль.
Давление пара над раствором:
Пример 2. Рассчитайте молекулярную массу неэлектролита, если 28,5 г этого вещества, растворенного в 785 г воды, вызывают понижение давления пара воды над раствором на 52,37 Па при 40°С. Давление водяного пара при этой температуре равно 7375,9 Па.
Решение:
Относительное понижение давления пара растворителя над раствором равно
Находим:
здесь mx – масса неэлектролита, молярная масса которого Mx г/моль.
0,309Mx + 0,202=28,5;
0,309Mx =28,298;
Mx=91,58 г/моль.
Молекулярная масса неэлектролита равна ~ 92.
1.6. ТЕМПЕРАТУРЫ КИПЕНИЯ И ЗАМЕРЗАНИЯ РАСТВОРОВ.
ЭБУЛЛИОСКОПИЧЕСКИЙ И КРИОСКОПИЧЕСКИЙ ЗАКОНЫ РАУЛЯ
Пример 1.Определите температуру кипения и замерзания раствора, содержащего 1 г нитробензола C6H5NO2 в 10 г бензола. Эбулиоскопическая и криоскопическая константы равны 2,57 и 5,1 °С. Температура кипения чистого бензола 80,2 °С, температура замерзания –5,4°С.
Решение:
По закону Рауля:
где ∆tзам и ∆tкип – соответственно понижение температуры замерзания и повышение температуры кипения раствора; Кк и Кэ – соответственно криоскопическая и эбуллиоскопическая константы растворителя; g- масса растворенного вещества, г; G- масса растворителя, г; Мr- молекулярная масса растворенного вещества; Mr(С6H5NO2)= 123,11.
Повышение температуры кипения раствора нитробензола в бензоле:
Температура кипения раствора: tкип=80,2+2,09=82,29 °C.
Понижение температуры замерзания раствора нитробензола в бензоле:
Температура замерзания раствора tзам= 5,4 – 4,14 =1,26 °C.
Пример 2.Раствор камфоры массой 0,522 г в 17 г эфира кипит при температуре на 0,461ºС выше, чем чистый эфир. Эбуллиоскопическая константа эфира 2,16 ºС. Определите молекулярную массу камфоры.
Решение:
Молекулярную массу камфоры определяем, пользуясь соотношением
Mr=
Молекулярная масса камфоры равна 155,14.
Читайте также:
Рекомендуемые страницы:
©2015-2020 poisk-ru.ru
Все права принадлежать их авторам. Данный сайт не претендует на авторства, а предоставляет бесплатное использование.
Дата создания страницы: 2016-07-22
Нарушение авторских прав и Нарушение персональных данных
Источник
Осмолярная концентрация – суммарное молярное количество всех кинетически активных частиц, содержащихся в 1 литре раствора, независимо от их формы, размера и природы.
i – можно взять в справочниках или рассчитать на основе экспериментальных данных.
Образцы решений задач
1. Вычислите осмотическое давление раствора глюкозы при 370С, если в 100 г
воды растворено 0,18 г глюкозы (С6Н12О6).
Дано:
t 370C
m Н2О 100 г
m С6Н12О6 0,18 г
Найти: Pосм.
Решение:
Осмотическое давление рассчитывается
по закону Вант-Гоффа: Pосм. C х R T
T 273 t0C 273 37 310 K
R 8,31 кПа л (справочная величина)
моль K
В разбавленном водном растворе 1 г мл,
мл,
следовательно Vр ра 100мл. М С6Н12О6 180г моль
моль
Молярная концентрация раствора глюкозы:
C С6Н12О6 | m С6Н12О6 | 0,18 г | 0,01 моль л | |||||
M С Н О | V | 180г моль 0,1л | ||||||
6 12 6 | р ра | |||||||
Pосм. 0,01 | моль | 8,31 | кПа л | 310K 25,76кПа | ||||
лмоль K
Ответ: Pосм. 25,76кПа .
2. Какое давление называется онкотическим? Из 1 г белка приготовили 100 мл водного раствора при температуре 250С. Чему примерно равно осмотическое давление раствора белка, если его молекулярная масса составляет 10000 г/моль.
41
Дано:
t 250C
Vр ра 100мл
m белка 1 г
М белка 10000 г моль
Найти: Pонк.
Ответ: Pонк. 2,48кПа
Решение:
Молярная концентрация раствора белка:
C белка | m белка | 1 г | 0,001 моль л | |
M белка V | 10000г моль 0,1л | |||
р ра |
Для примерной оценки онкотического давления
воспользуемся уравнением Вант-Гоффа, что допустимо
при небольших концентрациях полимера ( С2 0 ):
P | C белка R T | T 273 t0C 273 25 298 K | |||
онк. | |||||
Pонк. | 0,001 | моль | 8,31 | кПа л | 298K 2,48кПа |
лмоль K
.
3. Какие растворы называют изотоническими? Являются ли изотоническими
(при t 200C) растворы, содержащие в 100 мл: а) 1,8 г глюкозы (С6Н12О6);
б) 0,92 г глицерина (С3Н8О3).
Дано:
t 200C
Vр ра 100мл
m С6Н12О6 1,8 г
m C3Н8О3 0,92 г
Найти: C С6Н12О6 ,
C С3Н8О3
Решение:
М С6Н12О6 180г моль | М С3Н8О3 92г моль |
Молярные концентрации растворов глюкозы и глицерина:
C С6Н12О6 | m С6Н12О6 | 1,8 г | 0,1 моль л | |||||||
M С Н О | V | 180г моль 0,1л | ||||||||
6 | 12 6 | р ра | ||||||||
C С3Н8О3 | m С3Н8О3 | 0,92 г | 0,1 моль л | |||||||
M С | Н | О | V | 92г моль 0,1л | ||||||
3 | 8 | 3 | р ра | |||||||
Ответ: так как у растворов глюкозы и глицерина одинакова молярная концентрация, то и осмотическое давление у них равно,
следовательно, они изотонические.
4. Рассчитаете, на сколько давление насыщенного пара воды над плазмой крови, общее содержание в которой растворенных веществ можно принять равным 0,31 моль/л при температуре тела человека ≈310K ниже, чем над чистой водой при той же температуре? (Р0 над чистой водой при 310K
равно 61,78гПа)
42

Дано: | Решение: | ||||||||||||
C 0,31 моль л | В растворе содержится n = 0,31 моль вещества, | ||||||||||||
P0 61,78 гПа | а растворителя воды | N | 1000г | 55,5 моль, | |||||||||
18г моль | |||||||||||||
T 310K | так как (Н2О) 1 г мл, масса 1 литра воды равна 1000 г. | ||||||||||||
Мольная доля растворенного вещества: | |||||||||||||
Найти: | P | ||||||||||||
P | n | P | n | P0 | 0,31 | 61,78гПа 0,34гПа | |||||||
N n | N n | ||||||||||||
P0 | 55,55 0,31 | ||||||||||||
P P0 P | P P0 | P 61,78 0,34 61,44 гПа | |||||||||||
давление над плазмой крови при T 310K | |||||||||||||
Ответ: | P 0,34гПа. | ||||||||||||
5. Определите массу сахарозы (С12Н22О11), которую следует растворить в воде массой 250 г, чтобы получить раствор, кипящий при 100,20С.
Дано:
m Н2О 250 г
tкип.р-ра 100,20C
tкип. H2O 1000C
Найти:
m C12H22O11
Решение:
По следствию из закона Рауля: tкип. Kэб. Сm x
Kэб. H2O 0,52K кг (справочная величина)
моль
Разница в температурах кипения раствора и растворителя,
выраженная в Кельвинах или градусах Цельсия, одинакова
tкип. tкип.р-ра tкип.р-ля 100,20C 1000С 373,2K 373K 0,2K
Моляльная концентрация сахарозы равна:
C | C | H | O | tкип. | 0,2K | 0,385 | моль | ||||||||||||||||||
m | 22 | K кг | |||||||||||||||||||||||
12 | 11 | Kэб. | 0,52 | кг | |||||||||||||||||||||
моль | |||||||||||||||||||||||||
М С12Н22О11 342г моль | |||||||||||||||||||||||||
Cm C12H22O11 | m C12H22O11 | следовательно | |||||||||||||||||||||||
M C H | 22 | O m р ля | |||||||||||||||||||||||
12 | 11 | ||||||||||||||||||||||||
m C12H22O11 Cm C12H22O11 M C12H22O11 m р ля | |||||||||||||||||||||||||
m C | H | O 0,385 | моль | 342 | г | 0,25кг 32,9г | |||||||||||||||||||
22 | |||||||||||||||||||||||||
12 | 11 | кг | моль | ||||||||||||||||||||||
Ответ: m C12H22O11 32,9г.
43
6. Определите молярную массу углевода, если при растворении 0,9 г этого
вещества в 50 г воды получили раствор с температурой кипения 100,0520С.
Дано: | Решение: | ||||||||||||||||||||||||
m углевода 0,9 г | tкип. tкип.р-ра | tкип.р-ля 100,0520C 1000С 0,0520C 0,052K | |||||||||||||||||||||||
m Н2О 50 г | tкип. Kэб. Сm x | Kэб. H2O 0,52 | K кг | ||||||||||||||||||||||
tкип.р-ра 100,0520C | моль | ||||||||||||||||||||||||
Cm углевода | tкип. | 0,052K | моль | ||||||||||||||||||||||
tкип. H2O 1000C | 0,1 | ||||||||||||||||||||||||
Kэб. | 0,52 | K кг | кг | ||||||||||||||||||||||
моль | |||||||||||||||||||||||||
m углевода | |||||||||||||||||||||||||
Найти: | Cm углевода | следовательно | |||||||||||||||||||||||
M углевода | M углевода m р ля | ||||||||||||||||||||||||
M углевода | m углевода | 0,9г | 180 | г | |||||||||||||||||||||
C | m р ля | моль | моль | ||||||||||||||||||||||
m | 0,1 | 0,05кг | |||||||||||||||||||||||
кг
Ответ: молярная масса углевода 180 г/моль.
7. Рассчитаете массу глицерина в 500 г воды, если этот раствор замерзает при температуре минус 0,520С?
Дано: | Решение: | ||
m H2O 500 г | tзам. | tзам.р-ля tзам.р-ра | |
tзам.р-ра 0,520C | tзам. H | 2O 00C 273K | tзам.р-ра 0,520C 272,48K |
0 0,520C 273K 272,48K 0,52K | |||
Найти | tзам. | ||
m C3H8O3 | tзам. | Kкр. Сm | C3H8O3 | Kкр. | H | 2O 1,86 | K кг | |||||
моль | ||||||||||||
Cm C3H8O3 | tзам. | 0,52K | 0,28 | моль | ||||||||
K кг | ||||||||||||
Kкр. | 1,86 | кг | ||||||||||
моль
m C3H8O3 Cm C3H8O3 M C3H8O3 m р ля
М С3Н8О3 92г моль
моль
m C3H8O3 | 0,28 | моль | 92 | г | 0,5кг 12,88г |
кг | моль | ||||
Ответ: m C3H8O3 12,88г .
44

8. Что произойдет | с эритроцитами при 310 K в 2% растворе глюкозы |
( 1,006г мл)? | (Осмотическое давление крови в норме равно 740-780 кПа) |
Дано:
T 310K
W% 2%
1,006г мл
мл
Найти: Pосм.
Решение:
Эритроциты в гипотонических растворах за счет эндоосмоса
лопаются, происходит деплазмолиз (гемолиз), а в гипертонических растворах сморщиваются плазмолиз (цитолиз).
Осмотическое давление 2% раствора глюкозы рассчитывается по формуле: Pосм. C х R T
где молярную концентрацию раствора глюкозы можно выразить через массовую долю:
C C H | O | W% 10 | 2% 10 1,006г мл | 0,11 | моль | |||||||||
M C H O | л | |||||||||||||
6 12 | 6 | 180г моль | ||||||||||||
6 | 12 | 6 | ||||||||||||
М С6Н12О6 180г моль | ||||||||||||||
Pосм. 0,11 | моль | 8,31 | кПа л | 310K 287,95кПа | ||||||||||
лмоль K
Ответ: Pосм. 2%-ного раствора глюкозы значительно меньше Pосм. крови,
поэтому с эритроцитами в таком растворе произойдет гемолиз
(«осмотический» шок).
9. Осмотическое давление крови при 250С равно 7,7 атм. Для введения раствора глюкозы в кровь пациента необходимо, чтобы он был изотоничным крови.
Какой должна быть молярная концентрация раствора глюкозы, чтобы удовлетворять этому условию?
Дано: | Решение: | ||||
t 250C | Рассчитаем осмотическое давление крови | ||||
Pосм. 7,7атм. | 1 | атм. = 101,32 кПа | |||
7,7 | атм. = 780,2 кПа – осмотическое давление крови при 250С | ||||
Найти: | |||||
C глюкозы | Pосм. | крови Pосм. глюкозы 780,2кПа | |||
P | C глюкозы R T следовательно | C глюкозы | Росм. | ||
осм. | R T | ||||
45
T 273 t0C 273 25 298 K
C глюкозы | 780,2кПа | 0,315 | моль | |
кПа л | л | |||
8,31 | 298K | |||
моль K
Ответ: C глюкозы 0,315моль л.
л.
10. Рассчитайте осмотическое | давление | раствора KCl, | в котором |
C KCl 0,01 моль л, при | 310 K, если | изотонический | коэффициент |
равен 1,96. Каким будет этот раствор по отношению к плазме крови?
Дано:
C KCl 0,01 моль л
л
T 310K
i 1,96
Найти: Pосм. KCl .
Решение:
Для разбавленных растворов электролитов в уравнение Вант-Гоффа вводится изотонический коэффициент (i) для учета электролитической диссоциации:
Pосм. | KCl i C KCl R T | ||||
Pосм. | KCl 1,96 0,01 | моль | 8,31 | кПа л | 310K 50,5кПа |
лмоль K
Ответ: Pосм. KCl 50,5кПа < Pосм. крови , т.е. этот раствор гипотоничен по
отношению к плазме крови.
Задачи для самостоятельного решения
1. Рассчитайте осмотическое давление 20%-ного водного раствора глюкозы
( 1,08г мл) при 310 K, применяемого для внутривенного введения, например
мл) при 310 K, применяемого для внутривенного введения, например
при отеке легкого. Каким будет этот раствор (гипо-, гипер-, изотоническим) по отношению к крови, если учесть, что Pосм. крови равно 740-780 кПа?
Ответ: Pосм. глюкозы 3091,3кПа > Pосм. крови , то 20%-ный раствор глюкозы является гипертоническим по отношению к плазме крови.
2. Осмотическое давление крови в норме равно 740-780 кПа. Вычислите осмолярность крови при 310 K.
Ответ: 0,287-0,303 осмоль/л.
46
3. При несахарном диабете выделяются большие объемы разбавленной мочи,
осмолярность которой снижается до 0,06 осмоль/л. Вычислите осмотическое давление такой мочи при 310 K.
Ответ: осмотическое давление разбавленной мочи значительно ниже осмотического давления плазмы крови.
4. Вычислите температуру кипения и замерзания 5%-ного водного раствора фруктозы.
Ответ: tкип.р-ра 100,150C, tзам.р-ра 0,540C.
5. Рассчитайте молярную массу неэлектролита, если его массовая доля в водном растворе 1,96%, и раствор замерзает при –0,2480С.
Ответ: М x 150,4г моль.
моль.
6. При растворении 2,76 г глицерина в 200 г воды температура замерзания раствора равна –0,2790С. Определите молярную массу глицерина.
Ответ: М глицерина 92г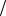 моль.
моль.
7. Гормон адреналин, регулирующий выделение в кровь дополнительной глюкозы в стрессовых ситуациях, состоит по массе из 59% углерода, 26,2%
кислорода, 7,1% водорода и 7,7% азота. Температура кипения раствора,
содержащего 5,38 г адреналина в 300 г CCl4 на 0,490С выше температуры кипения чистого четыреххлористого углерода. Какова молярная масса и молекулярная формула гормона адреналина? (Kэб.(CCl4) = 5,02 K∙кг/моль)
Ответ: М C9H14O3N 183г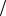 моль.
моль.
8. Рассчитайте ионную силу раствора «Трисоль», применяемого в медицинской практике в качестве плазмозамещающего раствора, на основании его прописи:
натрия хлорид – 0,5 г, калия хлорид – 0,4 г, воды для инъекций до 100 мл.
Ответ: I 0,146моль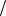 л, что соответствует ионной силе плазмы крови.
л, что соответствует ионной силе плазмы крови.
9. Водный раствор сульфата меди (II) с массовой долей 1% ( 1,009г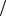 мл)
мл)
назначают в малых дозах для улучшения кроветворной функции. Вычислите активность ионов меди в таком растворе (T 298K ).
Ответ: Cu2 0,006моль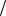 л .
л .
47
10. Формальдегид, обладающий дезинфицирующим и антисептическим действием, применяется для синтеза многих лекарственных препаратов.
Раствор, содержащий 1,5 г формальдегида в 100 мл воды, закипает при температуре 100,260С. Определите молярную массу формальдегида.
Ответ: М формальдегида 30г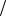 моль.
моль.
11. Смешали 50 мл раствора, в котором C HCl 0,2 моль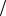 л и 300 мл раствора с
л и 300 мл раствора с
C HCl 0,02 моль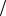 л. Вычислите рН полученного раствора, принимая H 0,9.
л. Вычислите рН полученного раствора, принимая H 0,9.
Ответ: рН полученного раствора равен 1,38.
12. В желудочном соке содержится соляная кислота, которая практически полностью диссоциирует в водных растворах. Рассчитайте рН желудочного сока, если массовая доля HCl в нем составляет в норме 0,05%. Плотность желудочного сока принять равной 1 г/мл.
Ответ: рН желудочного сока равна 1,86 (норма).
13. К 200 мл раствора с концентрацией соляной кислоты 0,15 моль/л добавили
100 мл раствора с концентрацией гидроксида калия 0,01 моль/л. Рассчитайте рН полученного раствора. Коэффициентом активности можно пренебречь.
Ответ: рН полученного раствора равен 1,013.
14.Вычислите осмотическое давление раствора, содержащего 17,6 г сахарозы С12Н22О11 в 500 мл раствора при 293 К ?
15.Рассчитайте, сколько молей неэлектролита должен содержать 1 литр раствора, чтобы его осмотическое давление при 25оС было равно 248 кПа?
16.Рассчитайте, при какой температуре замерзнет раствор, содержащий в 250 г
воды 7,2 г глюкозы (С6Н12О6)?
17.При растворении 13 г камф
