Какая масса азота содержится в 65 растворе азотной кислоты

Задача 1. Какой объем раствора азотной кислоты с массовой долей 65 % (ρ = 1,391 г/см3) необходимо взять для приготовления 300 мл раствора с массовой долей 10 % (ρ = 1,054 г/см3)?
Дано: w1(HNО3) = 65 %
ρ1 = 1,391 г/см3
ρ2 = 1,054 г/см3
w2(HNО3) = 10 %
V2 = 300 мл
Найти: V1 = ?
Решение.
По условию задачи из более концентрированного раствора необходимо приготовить менее концентрированный раствор. В этом случае расчет проще всего вести с учетом того, что масса азотной кислоты в исходном растворе и полученном растворе должна быть одинакова:
m1(HNО3) = m2(HNО3) (*)
Выразим массу растворенного вещества исходя из определения и выражения массовой доли вещества в растворе:
w(C) = _ m(Х) _ =____m(X)____
m(р-ра) V(р-ра) . r(р-ра)
m(X) = V(р-ра) . r(р-ра) . w(C) или
m(X) = _V(р-ра) . r(р-ра) . w(C)%_
Следовательно, для выше приведенного равенства (*), мы можем записать:
V1(р-ра) . r1(р-ра) . w1( HNО3) = V2(р-ра) . r2(р-ра) . w2(HNО3) и выразить из этого уравнения V1(р-ра):
V1(р-ра) = _ V2(р-ра) . r2(р-ра) . w2( HNО3) _ =
r1(р-ра) . w1(HNО3)
=__300 мл . 1,054 г/мл . 0,10_ =35 мл.
1,391 г/мл . 0,65
Задача 2.Какой объем раствора соды (карбоната натрия) с массовой долей 15 % (r = 1,16 г/см3) надо взять для приготовления 120 мл раствора с молярной концентрацией эквивалента соды 0,45 моль/л?
Дано: w1(Na2CO3) = 15 %
r1(р-ра) = 1,16 г/см3
V2(р-ра) = 120 мл
С2(1/z*Na2CO3) = 0,45 моль/л
Найти: V1(р-ра) =?
Решение.
По условию задачи из более концентрированного раствора, для которого указана массовая доля соли в растворе, необходимо приготовить менее концентрированный раствор, с заданной молярной концентрацией эквивалента. В этом случае расчет проще всего вести с учетом того, что масса соли в исходном растворе и полученном растворе должна быть одинакова:
m1(Na2CO3) = m2(Na2CO3) (*)
Выразим массу растворенного вещества исходя из определения и выражения массовой доли вещества в растворе (m1) и молярной концентрации эквивалента (m2):
m1(Na2CO3) = V1(р-ра) . r1(р-ра) . w1(Na2CO3)
m2(Na2CO3) = V2(р-ра).С2(1/z*Na2CO3).M(1/z*Na2CO3)
Предварительно вычислим молярную массу эквивалента карбоната натрия:
M(1/z*Na2CO3) = ½ . M(Na2CO3)= ½ . 106 г/моль = 53 г/моль
Подставим значения m1 иm2 в равенство (*) и выразим V1(р-ра):
V1(р-ра).r1(р-ра) . w1(Na2CO3)=V2(р-ра).С2(1/z*Na2CO3).M(1/z*Na2CO3)
V1(р-ра) = V2(р-ра) .С2(1/z*Na2CO3).M(1/z*Na2CO3)=
r1(р-ра) . w1(Na2CO3)
=__0,120 л . 0,45 моль/л . 53 г/моль_ = 16,4мл.
1,16 г/мл . 0,15
Задача 3. Определите молярную концентрацию, молярную концентрацию эквивалента, моляльность, молярную долю и титр карбоната натрия в растворе с массовой долей соли, равной 15 %. Плотность этого раствора 1,16 г/см3.
Дано: w( Na2CO3) = 15 %
r = 1,16 г/см3
Найти: С(Na2CO3) =? , С(Na2CO3) =?,
в(Na2CO3) =?, c( Na2CO3) =?, Т(Na2CO3) =?
Решение.
Для определения молярной концентрации и молярной концентрации эквивалента найдем массу соли, которая содержится в 1 л данного раствора:
m(Na2CO3)=V(р-ра).r(р-ра).w( Na2CO3) =
=1000 мл . 1,16 г/мл . 0,15 = 174 г.
Определим с помощью периодической таблицы молярную массу и молярную массу эквивалента карбоната натрия:
М(Na2CO3) = 106 г/моль,
М(1/z* Na2CO3) = 1/2 .106 г/моль = 53 г/моль.
Зная массу соли в 1 л рассматриваемого раствора, молярную массу и молярную массу эквивалента карбоната натрия, вычислим молярную концентрацию и молярную концентрацию эквивалента данного раствора:
С(Na2CO3) = _n( Na2CO3)_ =___m(Na2CO3)____ =
V(р-ра) М(Na2CO3). V(р-ра)
=__174 г___ =1,64 моль/л,
106 г/моль . 1 л
С(1/ z* Na2CO3) = n(1/z* Na2CO3) =____m(Na2CO3)______ =
V(р-ра) М(1/z* Na2CO3). V(р-ра)
=____174 г____ =3,28 моль/л.
53 г/моль . 1 л
Молярная концентрация и молярная концентрация эквивалента связаны между собой соотношением:
С(1/z*X) = z* . C(X).
Поэтому переход от молярной концентрации к молярной концентрации эквивалента и обратно можно выполнять с учетом этой зависимости, если известна одна из концентраций.
Для карбоната натрия число эквивалентности (z*)равно 2, так в состав молекулы соли входят два одновалентных атома натрия. Следовательно, если С(Na2CO3) = 1,64 моль/л,то
С(1/z* Na2CO3) = 2 . 1,64 моль/л = 3,28 моль/л.
И, наоборот, если известна молярная концентрация эквивалента раствора, то молярную концентрацию этого раствора можно определить, используя выше приведенную зависимость:
С(Na2CO3) = С(1/z* Na2CO3)_ =_3,28 моль/л_ = 1,64 моль/л.
z*2
Для того чтобы вычислить молялность раствора карбоната натрия, необходимо найти массу и количество вещества соли, приходящееся на 1 кг растворителя (воды). Из условий задачи следует, что для 15 %-го раствора в каждых 100 г раствора содержится 15 г серной кислоты и 85 г воды. Следовательно, чтобы найти массу соли, приходящейся на 1 кг воды, можно составить пропорцию:
1000 : 85 = х : 15
х = m(Na2CO3) = 1000 . 15 / 85= 176,5 г (масса кислоты,
приходящаяся на 1000 г
или 1 кг растворителя)
в(Na2CO3) = __n( Na2CO3)__=_ __m(Na2CO3) ____ =
m(растворителя) М(Na2CO3) . m(р-ля)
= ___176,5 г_____ = 1,66 моль/кг.
98 г/моль .1кг
Моляльность раствора можно вычислить и по формуле:
в(Na2CO3) = __ m(Na2CO3) 1000___
М(Na2CO3) . m(р-ля)
Если взять 1 л раствора карбоната натрия, то масса соли и растворителя может быть определена таким образом:
m(Na2CO3) =1000 мл . 1,16 г/мл . 0,15 = 174 г.
m(р-ля) = m(р-ра) – m(Х) = 1000мл.1,16г/мл – 174г = 986 г или
m(р-ля) = m(р-ра) . w(р-ля) = 1000мл .1,16г/мл . 0,85 = 986 г
в(Na2CO3) = _ m(Na2CO3) 1000_ = _174 г 1000__ = 1,66 моль/кг.
М(Na2CO3) . m(р-ля) 106 г/моль 986 г
Для раствора с массовой долей, равной 15 %, независимо от того какой объем раствора был взят соотношение между содой и водой будет 15 : 85, поэтому моляльность можно вычислить и таким образом:
в(Na2CO3) = _ m(Na2CO3) 1000_ = __15 г 1000__ = 1,66 моль/кг.
М(Na2CO3) . m(р-ля) 106 г/моль 85 г
Для определения молярной доли карбоната натрия в 15 %-ном растворе соли, возьмем 100 г раствора данной соли, в котором на 15 г соли приходится 85 г воды:
_15 г_
c( Na2CO3) = __n( Na2CO3)__ = ___ 106 г/моль___ = 0,03 = 3%.
n( Na2CO3) + n(Н2О) __15 г__ + __85 г__
106 г/моль 18 г/моль
Титр раствора показывает массу растворенного вещества, содержащегося в 1 см3 или 1 мл раствора. В данном случае в 1 л раствора содержится 174 г соли, следовательно, титр раствора будет равен:
Т(Na2CO3) = m(Na2CO3) = _227,8 г_ = 0,2278 г/мл »0,23 г/мл.
V(р-ра) 1000 мл
Задча 4.Какой объем раствора гидроксида натрия с молярной концентрацией 0,25 моль/л необходимо взять, чтобы осадить в виде Fe(OH)3 все железо, содержащееся в 300 мл раствора хлорида железа(Ш) с молярной концентрацией эквивалента 1,5 моль/л? Какова масса выпавшего осадка?
Дано: С1(NaOH) = 0,25 моль/л = C(1/z* NaOH)
С2(1/z* FeС13) = 1,5 моль/л
Найти: V1(р-ра NaOH) = ?
m[Fe(OH)3] = ?
Решение.
Если в задаче речь идет о взаимодействии веществ, то вычисления можно вести: а) по закону эквивалентов, б) по уравнению реакции.
1 способ. По закону эквивалентов.
Очень широко этот способ решения задач применяется в аналитической химии. Этот метод не требует составления уравнений реакций, протекающих в системах, но для лучшего понимания сути задачи необходимо представлять какие процессы протекают при взаимодействии реагирующих веществ. По закону эквивалентов – количество вещества эквивалента для всех веществ, участвующих в реакции, должно быть равно.
В растворе протекает реакция:
FeCl3 + 3 NaOH = Fe(OH)3↓ + 3 NaCl
По закону эквивалентов:
n(1/z* NaOH) = n(1/z* FeCl3)
С1(1/z* NaOH) .V1(р-ра NaOH) = С2(1/z* FeCl3) .V2(р-ра FeCl3)
V1(р-ра NaOH) =_С2(1/z* FeCl3) .V2(р-ра FeCl3)_
С1(1/z* NaOH)
V1(р-ра NaOH) = _1,5 моль/л . 0,3 л_ = 1,8 л
0,25 моль/л
Для определения массы осадка также воспользуемся законом эквивалентов:
n(1/z* FeCl3) = n[1/z*Fe(OH)3]
С(1/z* FeCl3) . V(р-ра FeCl3) =__ m[Fe(OH)3] __
М[1/z*Fe(OH)3]
m[Fe(OH)3] = 1,5 моль/л . 0,3 л . 1/3. 107 г/моль = 16 г.
2 способ. По уравнению реакции.
Составим уравнение реакции взаимодействия хлорида железа(III) и гидроксида натрия:
FeСl3 + 3 NaOH = Fe(OH)3↓ + 3 NaCl
По условию задачи определим, какое количество вещества хлорида железа(III) содержится в исходном растворе, предварительно определим молярную концентрацию раствора хлорида железа(III):
C(FeCl3) = С(1/z*FeCl3) / z* = 1,5 моль/л : 3 = 0,5 моль/л
n(FeCl3) =C(FeCl3) . V(р-ра FeCl3) = 0,5 моль/л . 0,3 л = 0,15 моль
Из уравнения реакции следует, что:
n( FeCl3): n(NaOH) = 1 моль : 3 моль.
По данным задачи в реакцию должно вступить 0,15 моль хлорида железа(III), поэтому можно записать следующее соотношение:1 : 3 = 0,15 : х; х = n(NaOH) = 0,45 моль.
Для осаждения гидроксида железа(III) используется раствор гидроксида натрия с молярной концентрацией 0,25 моль/л. Зная, молярную концентрацию раствора данного основания и количество вещества гидроксида натрия, необходимого для данного процесса, вычислим объем раствора NaOH :
С(NaOH) = _n( NaOH)_
Источник
Примеры решения задач
1.1. ПРОЦЕНТНАЯ КОНЦЕНТРАЦИЯ
Пример 1
а) Определите массовую долю (%) хлорида калия в растворе, содержащем 0,053 кг KCl в 0,5 л раствора, плотность которого 1063 кг/м3.
Решение:
Массовая доля ω или С% показывает, сколько единиц массы растворенного вещества содержится в 100 единицах массы раствора. Массовая доля – безразмерная величина, ее выражают в долях единицы или процентах:
где ωA – массовая доля (%) растворенного вещества;
mA- масса растворенного вещества, г;
mр-ра – масса раствора, г.
Масса раствора равна произведению объема раствора V на его плотность ρ:
m=ρV, тогда
Массовая доля хлорида калия в растворе равна:
Пример 2
Какой объем раствора азотной кислоты с массовой долей HNO3 30% (ρ=1180кг/м3) требуется для приготовления 20 л 0,5 М раствора этой кислоты?
Решение: Сначала определяем массу азотной кислоты в 20 л 0,5 М раствора:
M (HNO3)=63,01 г/моль;
mHNO3=0,5∙63,01∙20=630,1 г.
Определим, в каком объеме раствора с массовой долей HNO3 30% содержится 630,1 г HNO3 :
Следовательно , чтобы приготовить 20 л 0,5 М HNO3, надо израсходовать всего 1,78 л раствора азотной кислоты с массовой долей HNO3 равной 30%.
Пример 3
Какую массу раствора с массовой долей КОН 20% надо прибавить к 250 г раствора с массовой долей КОН 90%, чтобы получить раствор с ωКОН=50 %?
Решение: Задача решается с помощью правила смешения. Массу раствора с массовой долей КОН 20 % обозначим через х.
Тогда 3х=1000; х=333,3.
Для получения раствора с массовой долей КОН 50 % необходимо к 250 г раствора КОН с ω=90 % прибавить 333,3 г раствора КОН с 20 %.
Задачи такого типа решают с помощью диагональной схемы или «правила креста»: точкой пересечения двух отрезков прямой обозначают свойства смеси, которую необходимо получить.
20 (90-50)=40
50
90 (50-20)=30
Массы исходных растворов, необходимые для приготовления смеси, обратно пропорциональны разностям между концентрациями заданного и менее концентрированного раствора и более концентрированного и заданного растворов:
Также эту задачу можно решить, учитывая, что при сливании двух растворов суммируется масса растворенного вещества. Пусть масса 20% раствора х г, тогда масса КОН в нем 0,2 х. Масса КОН во втором растворе 0,9 · 250 = 225 г. Масса вещества в итоговом растворе 0,5 · (250 + х). Таким образом,
0,2х + 225 = 0,5(250+х); х=333,3 г.
1.2. МОЛЯРНАЯ И ЭКВИВАЛЕНТНАЯ КОНЦЕНТРАЦИИ
Пример 1
Какова масса NaOH, содержащегося в 0,2 л раствора, если молярная концентрация раствора 0,2 моль/л?
Решение:
Молярная концентрация См или М (молярность) показывает количество растворенного вещества, содержащегося в 1 л раствора.
Молярную концентрацию (моль/л) выражают формулой
где m1 – масса растворенного вещества, г;
M – молярная масса растворенного вещества, г/моль;
V – объем раствора, л.
M (NaOН)=40 г/моль. Масса NaOH, содержащегося в растворе, равна
MNaOH=MV=0,2∙40∙0,2=1,6 г.
Пример 2
Определите молярную концентрацию эквивалента хлорида железа (ІІІ), если в 0,3 л раствора содержится 32,44 г FeCl3.
Решение:
Молярная концентрация эквивалента вещества (нормальность) показывает число молярных масс эквивалентов растворенного вещества, содержащихся в 1л раствора (моль/л):
где mА – масса растворенного вещества, г;
M (1/zА) – молярная масса эквивалента растворенного вещества, г/моль;
V – объем раствора, л.
Молярная масса эквивалента FeCl3 равна
Молярная концентрация эквивалента раствора FeCl3 равна
Пример 3
Определите концентрацию раствора КОН, если на нейтрализацию 0,035 л 0,3 н. H3PO4 израсходовано 0,02 л раствора КОН.
Решение:
Из закона эквивалентов следует, что количество эквивалентов веществ участвующих в химической реакции одинаково. В реакции участвуют 0,035·0,3=0,0105 эквивалента фосфорной кислоты. Для нейтрализации H3PO4
потребуется такое же количество вещества эквивалента КОН, т.е.
V(H3PO4)СН(H3PO4)=V(KOH)СН(KOH).
Отсюда
1.3. МОЛЯЛЬНАЯ КОНЦЕНТРАЦИЯ (МОЛЯЛЬНОСТЬ) , МОЛЬНАЯ ДОЛЯ, ТИТР
Пример 1
В какой массе эфира надо растворить 3,04 г анилина C6H5NH2 , чтобы получить раствор, моляльность которого равна 0,3 моль/кг?
Решение:
Моляльность раствора Сm (моль/кг) показывает количество растворенного вещества, находящегося в 1 кг растворителя:
где mр-ля – масса растворителя, кг;
n (А) – количество растворенного вещества, моль.
M (C6H5NH2 ) – 99,13 г/моль.
Масса растворителя (эфира) равна:
тогда
Пример 2
Определите титр 0,01 н. КОН.
Решение:
Титр раствора показывает массу (г) растворенного вещества, содержащегося в 1 мл раствора. В 1 л 0,01 н. КОН содержится 0,564 г КОН. Титр этого раствора равен:
Т= 0,561/1000=0,000561 г/мл.
Пример 3
Рассчитайте молярные доли глюкозы C6H12O6 и воды в растворе с массовой долей глюкозы 36 %.
Решение:
Мольная доля вещества А(χА) в растворе равна отношению количества данного вещества nА к общему количеству всех веществ, содержащихся в растворе:
где ( ) количество всех веществ, содержащихся в растворе.
В 100 г раствора с массовой долей глюкозы, равной 36 %, содержится 36 г глюкозы и 64 г воды:
nC6H12O6 =36/180=0,20 моль;
nH2O= 64/18= 3,56 моль;
nC6H12O6 + nH2O= 0,20 + 3,56 =3,76 моль;
χC6H12O6= 0,20/3,76= 0,053;
χH2O= 3,56/3,76= 0,947.
Сумма молярных долей всех компонентов раствора равна 1.
Пример 4
Вычислите молярную концентрацию эквивалента, молярную концентрацию и моляльность раствора, в котором массовая доля CuSO4 равна 10 %. Плотность раствора 1107 кг/м3.
Решение:
Определим молярную массу и молярную массу эквивалента CuSO4:
M (CuSO4)= 159,61 г/моль; M(1/2 CuSO4)=
В 100 г раствора с ωCuSO4=10 % содержится 10,0 г CuSO4 и 90 г H2O.
Следовательно, моляльность раствора CuSO4 равна
Сm(CuSO4/H2O)=10/(159,61∙0,09)=0,696 моль/кг.
Молярная концентрация и молярная концентрация эквивалента относятся к 1л раствора:
mр-ра= ρV= 1107·10-3=1,107 кг.
В этой массе раствора содержится 1,107·0,1=0,1107 кг CuSO4, что составляет 110,7/159,61=0,693 моль, или 0,693·2=1,386 экв.
Молярная концентрация и молярная концентрация эквивалента данного раствора соответственно равны 0,693 и 1,386 моль/л.
1.4. ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ. ЗАКОН ВАНТ- ГОФФА
Пример 1
Вычисление осмотического давления растворов.
Вычислите осмотическое давление раствора, содержащего в
1,4 л 63 г глюкозы С6Н12О6 при 0°С.
Решение:
Осмотическое давление раствора определяют согласно закону Вант-Гоффа:
Pocм = nRT/V,
где п — количество растворенного вещества, моль;
V – объем раствора, м3;
R — молярная газовая постоянная, равная 8,3144 Дж/(моль-К).
В 1,4 л раствора содержится 63 г глюкозы, молярная масса которой равна 180,16 г/моль. Следовательно, в 1,4л раствора содержится
n= 63/180,16=0,35моль глюкозы.
Осмотическое давление этого раствора глюкозы:
Пример 2
Определение молекулярной массы неэлектролита по осмотическому давлению раствора.
Рассчитайте молекулярную массу неэлектролита, если в 5л раствора содержится 2,5 г неэлектролита. Осмотическое давление этого раствора равно 0,23∙105 Па при 20°С.
Решение:
Заменив п выражением m/M, где т — масса растворенного вещества, а М — его молярная масса, получим
Росм = mRT/(MV).
Отсюда молярная масса растворенного вещества равна
Следовательно, молекулярная масса неэлектролита равна 52,96
Росм кПа: R=8,31 Дж/моль∙К;
Росм мм Hg ст.: R=62,32 л∙мм.рт.ст./град.∙моль;
Росм. атм.: R=0,082 л∙атм../град.∙моль.
1.5.ДАВЛЕНИЕ НАСЫЩЕННОГО ПАРА РАСТВОРОВ. ТОНОМЕТРИЧЕСКИЙ ЗАКОН РАУЛЯ
Пример 1. а) Вычислите давление пара над раствором, содержащим 34,23 г сахара C12H22O11 в 45,05 г воды при 65 ºС, если давление паров воды при этой температуре равно 2,5·104 Па.
Решение:
Давление пара над раствором нелетучего вещества в растворителе всегда ниже давления пара над чистым растворителем при той же температуре. Относительное понижение давления пара растворителя над раствором согласно закону Рауля выражается соотношением
где p0 – давление пара над чистым растворителем;
p – давление пара растворителя над раствором;
n – количество растворенного вещества, моль;
N – количество растворителя, моль;
M (C12H22O11) = 342,30 г/моль;
M (H2O) = 18,02 г/моль.
Количество растворенного вещества и растворителя: n=34,23/342,30=0,1 моль; N = 45,05/18,02= 2,5моль.
Давление пара над раствором:
Пример 2. Рассчитайте молекулярную массу неэлектролита, если 28,5 г этого вещества, растворенного в 785 г воды, вызывают понижение давления пара воды над раствором на 52,37 Па при 40°С. Давление водяного пара при этой температуре равно 7375,9 Па.
Решение:
Относительное понижение давления пара растворителя над раствором равно
Находим:
здесь mx – масса неэлектролита, молярная масса которого Mx г/моль.
0,309Mx + 0,202=28,5;
0,309Mx =28,298;
Mx=91,58 г/моль.
Молекулярная масса неэлектролита равна ~ 92.
1.6. ТЕМПЕРАТУРЫ КИПЕНИЯ И ЗАМЕРЗАНИЯ РАСТВОРОВ.
ЭБУЛЛИОСКОПИЧЕСКИЙ И КРИОСКОПИЧЕСКИЙ ЗАКОНЫ РАУЛЯ
Пример 1.Определите температуру кипения и замерзания раствора, содержащего 1 г нитробензола C6H5NO2 в 10 г бензола. Эбулиоскопическая и криоскопическая константы равны 2,57 и 5,1 °С. Температура кипения чистого бензола 80,2 °С, температура замерзания –5,4°С.
Решение:
По закону Рауля:
где ∆tзам и ∆tкип – соответственно понижение температуры замерзания и повышение температуры кипения раствора; Кк и Кэ – соответственно криоскопическая и эбуллиоскопическая константы растворителя; g- масса растворенного вещества, г; G- масса растворителя, г; Мr- молекулярная масса растворенного вещества; Mr(С6H5NO2)= 123,11.
Повышение температуры кипения раствора нитробензола в бензоле:
Температура кипения раствора: tкип=80,2+2,09=82,29 °C.
Понижение температуры замерзания раствора нитробензола в бензоле:
Температура замерзания раствора tзам= 5,4 – 4,14 =1,26 °C.
Пример 2.Раствор камфоры массой 0,522 г в 17 г эфира кипит при температуре на 0,461ºС выше, чем чистый эфир. Эбуллиоскопическая константа эфира 2,16 ºС. Определите молекулярную массу камфоры.
Решение:
Молекулярную массу камфоры определяем, пользуясь соотношением
Mr=
Молекулярная масса камфоры равна 155,14.
Читайте также:
Рекомендуемые страницы:
©2015-2020 poisk-ru.ru
Все права принадлежать их авторам. Данный сайт не претендует на авторства, а предоставляет бесплатное использование.
Дата создания страницы: 2016-07-22
Нарушение авторских прав и Нарушение персональных данных
Источник
Задачи на определение молярной концентрации вещества
В 500 мл раствора содержится 56 г гидроксида калия. Определите молярную концентрацию раствора. (2б)
В 100 мл раствора содержится 0,98 г серной кислоты. Определите молярную концентрацию данного раствора. (2б)
Из 2, 65 г карбоната натрия приготовили 250 мл раствора. Какова его молярная концентрация? (2б)
Какая масса уксусной кислоты СН3СООН содержится в 250 мл 0,2 М раствора? (2б)
Какая масса хлорида железа (lll) содержится в 150 мл 2М раствора? (2б)
Слили 300 мл 2 М и 200 мл 8 М раствора серной кислоты. Рассчитайте молярную концентрацию полученного раствора. (2б)
Какую массу нитрата аммония NН4NО3 надо взять для приготовления 5 л 2 М раствора? (2б)
Какой объем 38 % – го раствора HCL (р = 1,19 г/мл) надо взять, чтобы приготовить из него 2 л 2 М раствора? (3б)
Раствор серной кислоты с массовой долей H2SO4 30 % имеет плотность 1,219 г/мл. Какова молярная концентрация этого раствора? (3б)
Сульфат натрия массой 21,3 г растворили в 150 г воды, плотность полученного раствора 1,12 г/мл. Какова его молярная концентрация? (3б)
Какова молярная концентрация 10 % раствора гидроксида калия, плотность которого равна 1,09 г/мл? (3б)
Какое количество вещества нитрата натрия содержится в растворе объемом 1 л с массовой долей NaNO3 40 %, плотность которого 1,32 г/мл? (3б)
Какой объем раствора с массовой долей серной кислоты 9,3 % (p = 1,05 г/ мл) потребуется для приготовления 0,35 М раствора H2SO4 объемом 40 мл? (3б)
Какой объем раствора с массовой долей карбоната натрия 0,15 (плотностью1,16 г/мл) надо взять для приготовления раствора 0,45M Na2CO3 объемом120 мл? (3б)
В лаборатории имеется раствор 3М KCL. Определите его объем, который потребуется для приготовления раствора объемом 200 мл с массовой долей KCL 8% и плотностью 1,05 г/мл. (3б)
К воде массой 200 г прилили раствор 2М KCL объемом 40 мл и плотностью 1,09 г/мл. Определите молярную концентрацию и массовую долю KCL в полученном растворе, если его плотность равна 1,015 г/мл. (4б)
Какой объем раствора 3 М Na CL плотностью 1,12 г/мл надо прилить к воде массой 200 г, чтобы получить раствор с массовой долей NaCL 10 %? (4б)
К раствору 3,5 М NH4CL объемом 80 мл и плотностью 1,05 г/мл прилили воду
объемом 40 мл. Определите массовую долю соли в полученном растворе. (4б)
В воде массой 128 г растворили метиловый спирт объемом 40 мл и плотностью 0,8 г/мл. Определите молярную концентрацию полученного раствора, если его плотность равна 0,97 г/мл. (4б)
Определите массовую долю хлорида кальция в растворе 1,4 М CaCL2, плотность которого равна 1,12 г/мл. (4б)
Упарили вдвое (по объему) 4 л 10 % -го раствора NaCL (р = 1,07 г/мл). Определите молярную концентрацию нового раствора. (4б)
Вычислите молярную концентрацию раствора с массовой долей серной кислоты
44 % и плотностью 1,34 г/мл. (4б)
Определите молярную концентрацию азотной кислоты, полученной смешиванием 40 мл 96 % – го раствора HNO3 (р= 1,5 г/мл) и 30 мл 48 % – го раствора HNO3(р= 1,3 г/мл), если полученный раствор имеет плотность р = 1,45 г/мл. (4б)
Эталоны ответов
1. Дано: Решение:
V р – ра = 500 мл n = 56 г/ 56г/моль = 1 моль
m кон = 56 г С = 1 моль / 0,5 л = 2 М
С – ? Ответ: 2 М
2. Дано: Решение:
V р – ра = 100 мл n = 0,98 г/ 98 г/моль = 0,01 моль
m н2SО4= 0,98 г С = 0,01 моль / 0,1 л = 0,1 моль
С – ? Ответ: 0,1 моль
3. Дано: Решение:
V р – ра = 250 мл n = 2,65 г/ 106 г/моль = 0,025 моль
m Na2CO3 = 2,65 г С = 0,025 моль / 0,25 л = 0,1 М
С – ? Ответ: 0,1 моль
4. Дано: Решение:
V р – ра = 200 мл n = С ∙ V = 0,2 М ∙ 0,2 л = 0,04 моль
С = 0,2 М m = n ∙ М = 0,04 моль ∙ 60 г/моль = 2,4 г
m сн3соон – ? Ответ: 2,4 г
5. Дано: Решение:
V р – ра = 150 мл n = С ∙ V = 2 М ∙ 0,15 л = 0,3 моль
С = 2 М m = n ∙ М = 0,3 моль ∙ 162,5 г/моль = 48,75 г
m FeCl3 – ? Ответ: 48,75 г
6. Дано: Решение:
V 1 = 300 мл 1.n1 = 2М ∙ 0,3 л = 0,6 моль


 С 1 = 2 М 2. n2 = 8 М ∙ 0,2 л = 1,6 моль
С 1 = 2 М 2. n2 = 8 М ∙ 0,2 л = 1,6 моль
V2 = 200 мл 3. n3 = 0,6 моль + 1 ,6 моль = 2,2 моль
С 2 = 8 М 4.V3 = 0,3 л + 0,2 л = 0,5 л
С 3 -?
 5 . С 3 = 2,2 моль/0,5л =4,4 М
5 . С 3 = 2,2 моль/0,5л =4,4 М
Ответ: 4,4 М
7. Дано: Решение:
V р – ра =5 л n = С ∙ V = 2 М ∙ 5 л = 10 моль
С = 2 М m NH4NO3 = n ∙ М = 10 моль ∙ 80 г/моль = 800 г
m NH4NO3 – ? Ответ: 800 г
8.Дано: Решение:
ω р-ра = 38 % 1. n = 2М ∙ 2 л = 4 моль


 ρ р- ра = 1,19 г/мл 2. m в-ва = 4 моль ∙36,5 г/моль = 146 г
ρ р- ра = 1,19 г/мл 2. m в-ва = 4 моль ∙36,5 г/моль = 146 г
Vр-ра 1 = 2 л 3. m р – ра = 146 г/0,38 = 384 г
m р – ра = 146 г/0,38 = 384 г
С = 2 М 4. V р-ра = 398 г / 1,19 г/мл = 322,6 мл
V -? Ответ: 322,6 мл
9. Дано: Решение:
m Na2 SO4 = 21,3г 1. m р-ра = 21,3 г + 150 г = 171,3 г
m

 воды = 150 г
воды = 150 г
ρ р-ра = 1,12 г/мл 2. n Na2SO4= 21,3 г /142г/моль = 0,15 моль
С – ? 3. V р-ра = 171,3 г /1,12г/мл ≈ 153 мл ≈ 0,153 л
4. С = 0,15 моль /0,153л ≈ 1М
Ответ: 1 М
10. Дано: Решение:
ωр-ра= 10 % 1.Берем объем раствора 1 л, тогда
ρ р-ра = 1,09 г/мл m р-ра = 1000 мл ∙ 1,09 г/мл = 1090 г
С – ? 

 2. m в-ва = 1090 г ∙ 0,1 = 109 г
2. m в-ва = 1090 г ∙ 0,1 = 109 г

3.n КОН = 109 г /56г/моль = 1,95 моль
4. С = 1,95 моль/1л = 1,95 М
Ответ: 1,95 М
11. Дано: Решение:
ω р-ра= 9,3 % 1.n = 0,35 М ∙ 0,04 л = 0,014 моль
ρ

 р-ра = 1,05 г/мл 2. m в-ва = 0,014 моль ∙ 98 г/моль = 1,372 г
р-ра = 1,05 г/мл 2. m в-ва = 0,014 моль ∙ 98 г/моль = 1,372 г
С р-ра 1 = 0,35 М 3. m р-ра = 1,372г / 0, 093 = 14,75г
р-ра 1 = 0,35 М 3. m р-ра = 1,372г / 0, 093 = 14,75г
V р-ра 1 = 40 мл = 0,04 л 4. V р-ра = 14,75 г / 1,05г/мл = 14 мл
Vр-ра – ? Ответ: 14 мл
12. Дано: Решение:
Vр-ра= 1 л 1.m р-ра = 1000мл ∙ 1,32 г/мл = 1320 г
ω

 р-ра = 40 % 2.m в-ва = 1320г ∙ 0,4 = 528г
р-ра = 40 % 2.m в-ва = 1320г ∙ 0,4 = 528г
ρ р-ра= 1,32 г/моль 3. n NaNO3 = 528 г / 85г/моль = 6,2 моль
n NaNO 3 – ? Ответ: 6,2 моль
13. Дано: Решение:
С= 0,45 М 1.n = 0,45 М ∙ 0,12 л = 0,054 моль
V

 р-ра = 120 мл = 0,12 л
р-ра = 120 мл = 0,12 л
2. m в-ва = 0,054 моль ∙ 106 г/моль = 5,724 г
ω р-ра 1 = 0,15 3. m р-ра = 5,724г / 0,15 = 38,16 г
р-ра 1 = 0,15 3. m р-ра = 5,724г / 0,15 = 38,16 г
ρ р-ра 1 = 1,16 г/мл 4. V р-ра = 38,16 г /1,16 г/мл = 32,9 мл
Vр-ра 1 – ? Ответ: 32,9 мл
14.Дано: Решение:
Vр-ра = 200 мл = 0,2 л 1.m р-ра = 200 мл ∙ 1,05 г/мл = 210 г
2. m в-ва = 0,08 ∙ 200 = 16,8 г
ω р-ра = 8 % 3. m в-ва 1 = 3 моль∙ 74,5 г/моль = 223,5 г
р-ра = 8 % 3. m в-ва 1 = 3 моль∙ 74,5 г/моль = 223,5 г
ρ р-ра = 1,05 г/мл 4. 1 л р-ра – 223,5г в-ва
С= 3М х л – 16,8 г в-ва
x = (16,8 г∙ 1 л) /223,5г = 0,075 л = 75 мл
 V р-ра 1 – ?
V р-ра 1 – ?
Ответ: 75 мл
15.Дано: Решение:
m воды = 200 г 1.m р-ра = 40 мл ∙ 1,09 г/мл = 43,6 г
С = 2 М 2.n = 2 моль/л ∙ 0,04 л = 0,08 моль
V р-ра = 40 мл = 0,04 л 3. m в-ва = 0,08 моль∙ 74,5 г/моль =5,96 г
р-ра = 40 мл = 0,04 л 3. m в-ва = 0,08 моль∙ 74,5 г/моль =5,96 г
ρ р-ра = 1,09 г/мл 4. m р-ра = 200 г+ 43,6 г = 243,6 г
ρ р-ра 1= 1,015 г/мл 5. V р-ра 1 = 243,6 г / 1,015г/мл = 240 мл = 0,24 л
С 1 – ? ω- ? 6. ωр-ра 1 = 5,96 г / 243,6 г ∙100 % = 2,45 %
 7.С р-ра 1 = 0,08 моль / 0,24л ≈ 0,33 М
7.С р-ра 1 = 0,08 моль / 0,24л ≈ 0,33 М
Ответ: 0,33 М
16.Дано: Решение:
С = 3 М 1.n = 3М ∙ 1л = 3 моль
Ρ р-ра = 1,12 г/м 2. m в-ва = 3 моль ∙ 58,5 г/моль = 175,5 г
 m воды = 200 г 3. m в-ва 1000 мл ∙ 1,12 г/мл = 1 120 г
m воды = 200 г 3. m в-ва 1000 мл ∙ 1,12 г/мл = 1 120 г
ω р-ра = 10 % 4. ωр-ра = 175,5 г / 1120г ∙100 % ≈ 15,7 %
V р-ра – ?
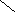
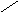 5. 15,7 % 10 м.ч
5. 15,7 % 10 м.ч
 10 %
10 %
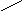

0 5,7 м.ч
6. 5,7 м.ч – 200 г 1 м.ч = 200 г/ 5,7 ≈ 35,1 г
10 м.ч = 351 г


 7.m р-ра = 351 г, тогда V р-ра = 351 г/1,12г/мл ≈ 314 мл
7.m р-ра = 351 г, тогда V р-ра = 351 г/1,12г/мл ≈ 314 мл
Ответ: 314 мл
17. Дано: Решение:
С = 3,5 М 1.n = 3,5 М∙ 0,08 л = 0,28 моль
V р-ра = 80 мл = 0,08 л 2. m в-ва = 0,28 моль ∙ 53,5 г/моль = 14,98 г≈ 15 г
Р р-ра = 1,05 г/мл 3. m р-ра 1 = (80 мл∙1,05 г/мл) + 40 г = 124 г
р-ра = 1,05 г/мл 3. m р-ра 1 = (80 мл∙1,05 г/мл) + 40 г = 124 г
Vводы = 40 мл 4. ω р-ра 1 = (15 г /124г) ∙ 100 % = 12,1 %
ω р-ра 1 – ? Ответ: 12,1 %
Дано: Решение:
m воды = 128 г 1.m сn. = 40 мл ∙ 0,8 г/мл = 32 г
V сn. = 40 мл 2. m р-ра = 128 г + 32 г = 160 г
 ρ сn. = 0,8 г/мл 3.n сn. = 32 г /32 г/мл = 1 моль
ρ сn. = 0,8 г/мл 3.n сn. = 32 г /32 г/мл = 1 моль
ρ р-ра = 0,97 г/мл 4.Vр-ра = 160 г /0,97 г/мл ≈ 165 мл = 0,165 л
С-? 5. С = 1 моль / 0,165 л ≈ 6,06 М
Ответ: 6,06 М
19. Дано: Решение:
С = 1,4 М 1.m р-ра = 1000 мл ∙ 1,12 г/мл = 1120 г
ρ р-ра = 1,12 г/мл 2.n = 1,4 М ∙ 1 л = 1,4 моль
ω  – ? 3. m в-ва = 1,4 моль ∙ 111 г/моль = 155,4 г
– ? 3. m в-ва = 1,4 моль ∙ 111 г/моль = 155,4 г
 4. ω = (155,4 г / 1120г ) ∙ 100% = 13,87%
4. ω = (155,4 г / 1120г ) ∙ 100% = 13,87%
Ответ: 13,87 %
Дано: Решение:
V р-ра = 4 л 1.m р-ра = 4000 мл ∙ 1,07 г/мл = 4280 г
ω р-ра = 10 % 2. m в-ва = 4280 г ∙ 0,1 = 428 г
ρ р-ра = 1,07 г/мл 3.Vр-ра 1 = 4 л/ 2 = 2 л
С р-ра 1 – ? 4. n = 428 г / 58,5 г/моль = 7,3 моль
р-ра 1 – ? 4. n = 428 г / 58,5 г/моль = 7,3 моль
5. С р-ра 1 = 7,3 моль / 2 л = 3,65 М
 Ответ: 3,65 М
Ответ: 3,65 М 
Дано: Решение:
ω р-ра = 44 % 1.m р-ра = 1000 мл ∙ 1,34 г/мл = 1340 г
ρ р-ра = 1,34 г/мл 2. m в-ва = 1340 г ∙ 0,44 = 589,6 г
С- ? 3. n = 589,6 г / 98 г/моль = 6 моль
 4. С = 6 моль / 1 л = 6 М
4. С = 6 моль / 1 л = 6 М
О твет: 6 М
твет: 6 М
Дано: Решение:
С = 2,1 М 1.m р-ра = 1000 мл ∙ 1,13 г/мл = 1130 г
ρ р-ра = 1,13 г/мл 2.n = 2,1 М ∙ 1 л = 2,1 моль
ω р-ра- ? 3. m в-ва = 2,1 моль ∙ 98 г/моль = 205,8 г
р-ра- ? 3. m в-ва = 2,1 моль ∙ 98 г/моль = 205,8 г
 4. ω р-ра = (205,8 г / 1130г) ∙ 100 % = 18,2 %
4. ω р-ра = (205,8 г / 1130г) ∙ 100 % = 18,2 %
Ответ: 18,2 %
Дано: Решение:
С= n/V
Vр-ра 1 = 40 мл 1.m р-ра 1 = 40 мл ∙ 1,5 г/мл = 60 г
ω р-ра 1 = 96 % 2.m в-ва 1 = 60 г ∙ 0,96 = 57,6 г
ρ р-ра 1 = 1,5 г/мл 3. m р-ра 2 = 30 мл ∙ 1,3 г/мл = 39 г
р-ра 1 = 1,5 г/мл 3. m р-ра 2 = 30 мл ∙ 1,3 г/мл = 39 г
Vр-ра 2 = 30 мл 4. m в-ва 2 = 39 г ∙ 0,48 = 18,72 г
ω р-ра 2= 48 % 5. m р-ра 3 = 60 г + 39 г = 99 г
p р-ра 2 = 1,3 г/мл 6. Vр-ра 3 = 99 г / 1,45 г/мл = 68,3 мл = 0,0683 л
p р-ра 3 = 1,45 г/мл
С р-ра 3 – ? 7. n в-ва 3 = 57,6 г + 18,72 г = 1,21 моль
63,г/моль
 8.С = 1,21 моль / 0, 0683 л = 17,7 М
8.С = 1,21 моль / 0, 0683 л = 17,7 М
Ответ: 17,7 М
Источник
