Какая функциональная группировка придает аминокислоте кислые свойства

Цель: расширить знания о функциях белков в живой клетке; научить учащихся выявлять причины происходящих в клетке процессов, используя свои знания о функциях в ней белков.
Оборудование: таблицы по общей биологии, модель первичной структуры белка.
Ход урока
I. Проверка знаний учащихся.
Карточка для работы у доски.
Запишите номера вопросов, против них – правильные ответы.
- Какие органические вещества в клетке на первом месте по массе?
- Какие элементы входят в состав простых белков?
- Сколько аминокислот образует все многообразие белков?
- Сколько аминокислот являются незаменимыми для человека?
- Какие белки называются неполноценными?
- Какая функциональная группировка придает аминокислоте кислые, какое – щелочные свойства?
- В результате какой реакции образуется пептидная связь?
- Между какими группировками аминокислот образуется пептидная связь?
- Какие связи стабилизируют вторичную структуру белков ?
- Какую структуру имеет молекула гемоглобина?
Тесты классу.
Тест 1. Какие органические вещества в клетке на первом месте по массе?
- углеводы.
- белки
- липиды.
- нуклеиновые кислоты.
Тест 2. Какие элементы входят в состав простых белков?
- углерод…
- водород
- кислород
- сера
- фосфор
- азот
- железо
- хлор.
Тест 3. Сколько аминокислот образует все многообразие белков?
- 170
- 26
- 20
- 10
Тест 4. Сколько аминокислот являются незаменимыми для человека?
- таких аминокислот нет.
- 20
- 10
- 7
Тест 5. Какие белки называются неполноценными?
- В которых отсутствуют некоторые аминокислоты.
- В которых отсутствуют некоторые незаменимые аминокислоты.
- В которых отсутствуют некоторые заменимые аминокислоты.
- Все известные белки являются полноценными.
Тест 6. Какая функциональная группировка придает аминокислоте кислые, какое –щелочные свойства?
- Кислые – радикал, щелочные – аминогруппа.
- Кислые – аминогруппа, щелочные – радикал.
- Кислые – карбоксильная группа, щелочные – радикал.
- Кислые – карбоксильная группа, щелочные – аминогруппа.
Тест 7. В результате какой реакции образуется пептидная связь?
- Реакция гидролиза.
- Реакция гидратации.
- Реакции конденсации.
- Все вышеперечисленные реакции могут привести к образованию пептидной связи.
Тест 8. Между какими группировками аминокислот образуется пептидная связь?
- Между карбоксильными группами соседних аминокислот.
- Между аминогруппами соседних аминокислот.
- Между аминогруппой одной аминокислоты и радикалом другой.
- Между аминогруппой одной аминокислоты и карбоксильной группой другой.
Тест 9. Какие связи стабилизируют вторичную структуру белков ?
- ковалентные
- водородные
- ионные
- такие связи отсутствуют
Тест 10. Какую структуру имеют молекула гемоглобина?
- первичную
- вторичную
- третичную
- четвертичную
II. Изучение нового материала.
1. Свойства белков.
У человека более 10 000 видов разных белков.
Свойства белков:
- Денатурация (утрата трехмерной конформации без изменения первичной структуры ). Ренатурация.
- Нерастворимые белки (кератин, фиброин) и растворимые белки (альбумины, фибринген).
- Малоактивные и химически высокоактивные.
- Устойчивые и крайне неустойчивые.
- Фибриаллярные и глобулярные.
- Нейтральные (альбумины, глобулины), основные (гистоны), кислые (казеин)
- Инактивация при замерзании.
2. Функции белков в клетке и организме.
1. Строительная.
2. Каталическая (ферментативная).
Напомним некоторые особенности функционирования ферментов:
а) ферменты ускоряют протекание реакции только одного вида, то есть обладают специфичностью действия;
б) ферменты конкретного организма действуют в узких температурных пределах;
в) ферменты эффективно работают при строго определенных показателях среды. Например, в разных участках пищеварительного тракта она может быть слабощелочной, щелочной или кислой.
Ферментативный белок соединятся реагирующими веществами, ускоряет их превращения ения и выходит из реакции неизменным.
3. Регуляторная.
Осуществляется с помощью гормонов. Многие гормоны являются белками. Рассмотрим их действия на некоторых конкретных примерах.
Пример 1
Пример 2
Ослабленное функционирование поджелудочной железы может привести к нарушению (замедлению) процесса превращения глюкозы в гликоген, вследствие чего возникает серьезное заболевание – сахарный диабет.
4. Двигательная функция белка проявляется при работе мускулатуры человека и животных. В мышечных клетках имеются специальные сократительные белки, обеспечивающие специфическое функционирование этих клеток.
5. Транспортная функция белка проявляется в переносе кислорода и углекислого газа с помощью белка глобина.
6. Защитная функция белка заключается в выработке белков – антител, уничтожающих возбудителей болезней, попавших в организм.
Защитная функция белка приносит… человеку не только пользу. Могут возникнуть серьезные проблемы при пересадке органов и тканей от одного человека другому. Пересаженный орган воспринимается иммунной системой нового «хозяина» этого органа как чужеродный белок. Воздействие антител приводит к отторжению пересаженного органа со всеми вытекающими отсюда последствиями.
Аналогичные проблемы могут возникнуть при беременности, в том случае, если мать будущего ребенка является резус-отрицательной, а отец имеет резус-положительную кровь. В том случае может возникнуть серьёзный конфликт между материнским организмом и организмом развивающего плода.
Напомним, что ген резус-положительности доминирует над геном резус-отрицательности.
Следствием указанного выше конфликта являются задержка и нарушение процесса развития плода, в ряде случаев – его гибель. Связи с ответным воздействием антител плода на чужеродный белок материнского организма женщина испытывает симптомы обостренно протекающего токсикоза беременности.
Защитные функции могут быть могут быть ослаблены либо с помощью медицинских средств (когда это необходимо),либо в результате негативного воздействия природных факторов(ухудшение условий жизни организма, агрессия вируса СПИДа) (см. схему).
7. Энергетическая функция белка проявляется в выделении свободной энергии при последовательном расщеплении полипептидной молекулы
Биологическую роль, которую играют белки в живой клетке и организме, трудно переоценить. Вероятно, жизнь на нашей планете действительно можно рассматривать как способ существования белковых тел, осуществляющих обмен веществом и энергией с внешней средой.
III. Закрепление.
«Свойства и функции белков. »
Тест 1. Что образуется при окислении 1 г белка?
- Вода
- Углекислый газ.
- Аммиак.
- 17,6 кДж энергии.
- Мочевина.
- 38,9 кДж энергии.
Тест 2. В пробирке с пероксидом водорода поместили кусочек варенной колбасы, хлеба, моркови, рубленного яйца. В одной из пробирок выделялся кислород. В какой?
- С кусочком вареной колбасы.
- С кусочком хлебы.
- С кусочком моркови.
- С кусочком рубленного яйца.
Тест 3. Какие суждения верны?
- Ферменты специфичны, каждый фермент обеспечивает раекции одного типа.
- Ферменты универсальны и могут катализировать реакции разных типов.
- Каталическая активность ферментов не зависит от рН и температуры.
- 4. Каталическая активность ферментов напрямую зависит от рН и температуры.
Тест 4. Какие суждения верны?
- Фермент – ключ, субстрат – замок, согласно теории Фишера.
- Фермент – замок, субстрат – ключ, согласно теории Фишера.
- После каталитической реакции фермент и субстрат распадаются, образуя продукты реакции.
- После каталитической реакции фермент остается неизменным, субстрат распадается, образуя продукты реакции.
Тест 5. Какие суждения верны?
- Витамины являются кофакторами ферментов.
- Все белки являются биологическими катализаторами, ферментов.
- При замерзании происходит необратимая денатурация ферментов.
- Ренатурация – утрата трехмерной конфигурации белка без изменения первичной структуры
Тест 6. Какая функциональная группировка придает аминокислоте кислые, какое –щелочные свойства?
- Кислые – радикал, щелочные – аминогруппа.
- Кислые – аминогруппа, щелочные – радикал.
- Кислые – карбоксильная группа, щелочные – радикал.
- Кислые – карбоксильная группа, щелочные – аминогруппа.
Тест 7. В результате какой реакции образуется пептидная связь?
- Реакция гидролиза.
- Реакция гидратации.
- Реакции конденсации.
- Все вышеперечисленные реакции могут привести к образованию пептидной связи.
Тест 8. Между какими группировками аминокислот образуется пептидная связь?
- Между карбоксильными группами соседних аминокислот.
- Между аминогруппами соседних аминокислот.
- Между аминогруппой одной аминокислоты и радикалом другой.
- Между аминогруппой одной аминокислоты и карбоксильной группой другой.
Тест 9. Какие связи стабилизируют вторичную структуру белков?
- ковалентные
- водородные
- ионные
- такие связи отсутствуют.
Тест 10. Какие связи стабилизируют третичную структуру белков?
- ковалентные
- водородные
- ионные
- гидрофильно-гидрофобное взаимодействие.
На дом: стр. 94-99, вопросы в конце параграфа.
Источник
Аминокислоты классифицируют по следующим структурным признакам.
I. Классификация по взаимному положения функциональных групп
В зависимости от взаимного расположения амино- и карбоксильной групп аминокислоты подразделяют на α- , b- , g- , d- , e- и т. д.
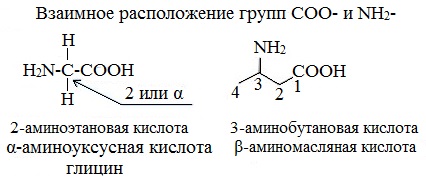
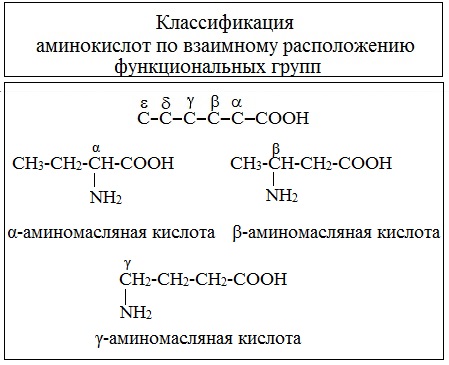
Греческая буква при атоме углерода обозначает его удаленность от карбоксильной группы.
II. Классификация по строению бокового радикала (функциональным группам)
Алифатические аминокислоты
Моноаминомонокарбоновые кислоты: глицин, аланин, валин, изолейцин, лейцин.
Оксимоноаминокарбоновые кислоты (содержат-ОН-группу): серин, треонин.
Моноаминодикарбоновые кислоты (содержат СООН-группу): аспартат, глутамат (за счёт второй карбоксильной группы несут в растворе отрицательный заряд).
Амиды моноаминодикарбоновых кислоты (содержат NH2СО-группу): аспарагин, глутамин.
Диаминомонокарбоновые кислоты (содержат NH2-группу): лизин, аргинин (за счёт второй аминогруппы несут в растворе положительный заряд).
Серусодержащие кислоты: цистеин, метионин.
Ароматические аминокислоты: фенилаланин, тирозин, триптофан.
Гетероциклические аминокислоты: триптофан, гистидин, пролин.
Иминокислоты: пролин.
Важнейшие α–аминокислоты
III. Классификация по полярности бокового радикала (по Ленинджеру)
Выделяют четыре класса аминокислот, содержащих радикалы следующих типов.
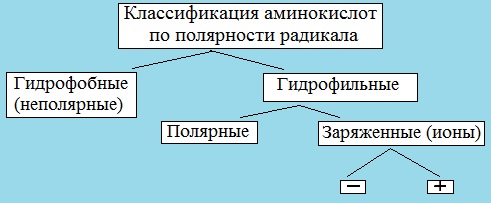
Гидрофобные аминокислоты располагаются внутри молекулы белка, тогда как гидрофильные – на внешней поверхности, что делает гидрофильными и хорошо растворимыми в воде молекулы белка.
Благодаря этому свойству белки хорошо связывают воду, удерживая жидкость в крови, в межклеточном пространстве и внутри клеток.
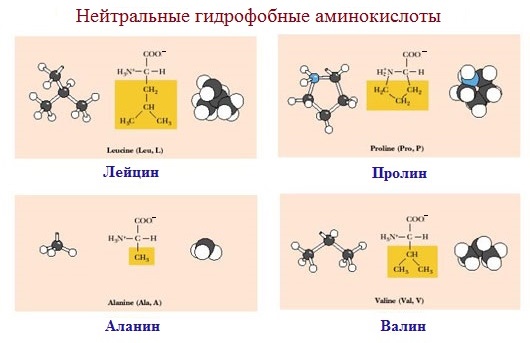
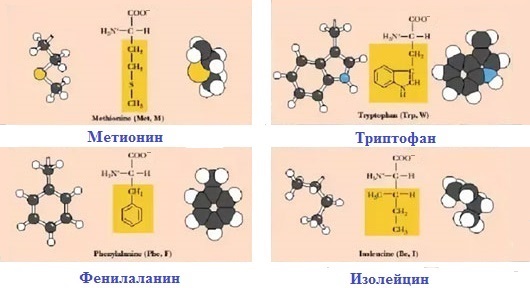
1. Неполярные (гидрофобные)
К неполярным (гидрофобным) относятся аминокислоты с неполярными R-группами и одна серусодержащая аминокислота:
— алифатические: аланин, валин, лейцин, изолейцин
— ароматические: фенилаланин, триптофан.
— серусодержащие: метионин
— иминокислота: пролин.
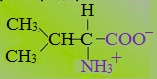
2. Полярные незаряженные
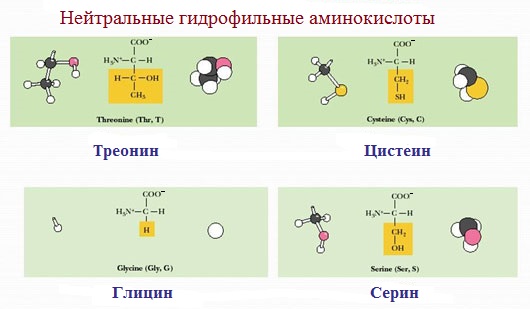
Полярные незаряженные аминокислоты по сравнению с неполярными лучше растворяются в воде, более гидрофильны, так как их функциональные группы образуют водородные связи с молекулами воды.
К ним относятся аминокислоты, содержащие:
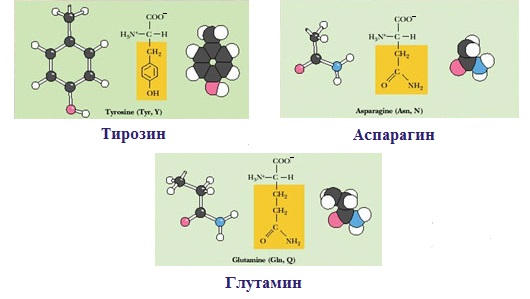
— полярную ОН-группу (оксиаминокислоты): серин, треонин и тирозин
— HS-группу: цистеин
— амидную группу: глутамин, аспарагин
— и глицин (R-группа глицина, представленная одним атомом водорода, слишком мала, чтобы компенсировать сильную полярность a-аминогруппы и a-карбоксильной группы).
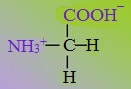
3. Заряженные отрицательно при рН-7 (кислые)
Аспарагиновая и глутаминовая кислоты относятся к отрицательно заряженным аминокислотам.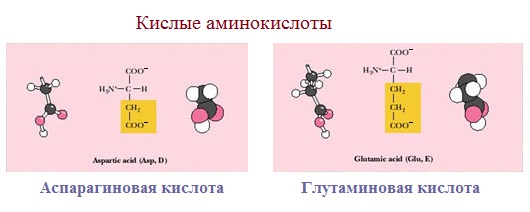
Они содержат по две карбоксильные и по одной аминогруппе, поэтому в ионизированном состоянии их молекулы будут иметь суммарный отрицательный заряд:
4. Заряженные положительно при рН-7 (основные)
К положительно заряженным аминокислотам принадлежат лизин, гистидин и аргинин.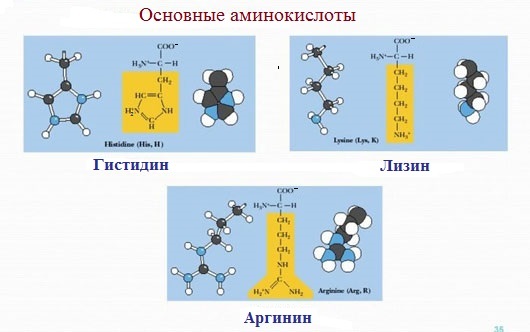
В ионизированном виде они имеют суммарный положительный заряд:
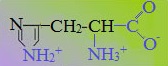
В зависимости от характера радикалов природные аминокислоты также подразделяются на нейтральные, кислые и основные. К нейтральным относятся неполярные и полярные незаряженные, к кислым – отрицательно заряженные, к основным – положительно заряженные.
IV. Классификация по кислотно-основным свойствам
В зависимости от количества функциональных групп различают кислые, нейтральные и основные аминокислоты.
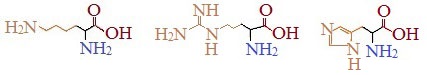
Основные
Аминокислоты, в которых число аминогрупп превышает число карбоксильных групп, называют основными аминокислотами: лизин, аргинин, гистидин:
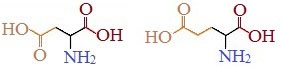
Кислые
Если в аминокислотах имеется избыток кислотных групп, их называют кислыми аминокислотами: аспарагиновая и глутаминовая кислоты:
Все остальные аминокислоты относятся к нейтральным.
V. По числу функциональных групп
Аминокислоты по числу функциональных групп можно разделить моноаминомонокарбоновые, моноаминодикарбоновые, диаминомонокарбоновые:

VI.Биологическая классификация (по способности синтезироваться в организме человека и животных)
Заменимые аминокислоты – десять из 20 аминокислот, входящих в состав белков, могут синтезироваться в организме человека. К ним относятся: глицин (гликокол), аланин, серин, цистеин, тирозин, аспарагиновая и глутаминовая кислоты, аспарагин, глутамин, пролин.
Незаменимые аминокислоты (8 аминокислот) – не могут синтезироваться в организме человека и животных и должны поступать в организм в составе белковой пищи.
Абсолютно незаменимых аминокислот восемь: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан.
Незаменимые аминокислоты входят часто в состав пищевых добавок, используются в качестве лекарственных препаратов.
Условно незаменимые (2 аминокислоты) — синтезируются в организме, но в недостаточном количестве, поэтому частично должны поступать с пищей. Такими аминокислотами являются гистидин, аргинин.
Для детей также незаменимыми являются гистидин и аргинин.

Для человека одинаково важны оба типа аминокислот: и заменимые, и незаменимые. Большая часть аминокислот идет на построение собственных белков организма, но без незаменимых аминокислот организм существовать не сможет.
При недостатке каких-либо аминокислот в организме человека в течение непродолжительного времени могут разрушаться белки соединительной ткани, крови, печени и мышц, а полученный из них «строительный материал» — аминокислоты идут на поддержание нормальной работы наиболее важных органов — сердца и мозга.
Дефицит аминокислот приводит к ухудшению аппетита, задержке роста и развития, жировой дистрофии печени и другим тяжелым нарушениям.
При этом наблюдается снижение аппетита, ухудшение состояния кожи, выпадение волос, мышечная слабость, быстрая утомляемость, снижение иммунитета, анемия.
Избыток аминокислот может вызвать развитие тяжелых заболеваний, особенно у детей и в юношеском возрасте. Наиболее токсичными являются метионин (провоцирует риск развития инфаркта и инсульта), тирозин (может спровоцировать развитие артериальной гипертонии, привести к нарушению работы щитовидной железы) и гистидин (может способствовать возникновению дефицита меди в организме и привести к заболеваниям суставов, ранней седине, тяжелым анемиям).
В условиях нормального функционирования организма, когда присутствует достаточное количество витаминов (В6, В12, фолиевой кислоты) и антиоксидантов (витамины А, Е, С и селен), избыток аминокислот не наносит вред организму.
Продукты с повышенным содержанием отдельных незаменимых аминокислот
Качество некоторых пищевых белков относительно белков женского молока
Аминокислоты
Источник
Аминокислоты – органические бифункциональные соединения, в состав которых входят карбоксильные группы –СООН и аминогруппы –NH2.
Природные аминокислоты можно разделить на следующие основные группы:
| 1) Алифатические предельные аминокислоты (глицин, аланин) | NH2-CH2-COOH глицин NH2-CH(CH3)-COOH аланин |
| 2) Серосодержащие аминокислоты (цистеин) |  цистеин |
| 3) Аминокислоты с алифатической гидроксильной группой (серин) | NH2-CH(CH2OH)-COOH серин |
| 4) Ароматические аминокислоты (фенилаланин, тирозин) |  фенилаланин
тирозин |
| 5) Аминокислоты с двумя карбоксильными группами (глутаминовая кислота) | HOOC-CH(NH2)-CH2-CH2-COOH глутаминовая кислота |
| 6) Аминокислоты с двумя аминогруппами (лизин) | CH2(NH2)-CH2-CH2-CH2-CH(NH2)-COOH лизин |
- Для природных α-аминокислот R-CH(NH2)COOH применяются тривиальные названия: глицин, аланин, серин и т. д.
- По систематической номенклатуре названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино- и указанием места расположения аминогруппы по отношению к карбоксильной группе:
- Часто используется также другой способ построения названий аминокислот, согласно которому к тривиальному названию карбоновой кислоты добавляется приставка амино- с указанием положения аминогруппы буквой греческого алфавита.
Аминокислоты – твердые кристаллические вещества с высокой температурой плавления. Хорошо растворимы в воде, водные растворы хорошо проводят электрический ток.
- Замещение галогена на аминогруппу в соответствующих галогензамещенных кислотах:

- Восстановление нитрозамещенных карбоновых кислот (применяется для получения ароматических аминокислот):

При растворении аминокислот в воде карбоксильная группа отщепляет ион водорода, который может присоединиться к аминогруппе. При этом образуется внутренняя соль, молекула которой представляет собой биполярный ион:
![]()
1. Кислотно-основные свойства аминокислот
Аминокислоты — это амфотерные соединения.
Они содержат в составе молекулы две функциональные группы противоположного характера: аминогруппу с основными свойствами и карбоксильную группу с кислотными свойствами.
Водные растворы аминокислот имеют нейтральную, щелочную или кислую среду в зависимости от количества функциональных групп.
Так, глутаминовая кислота образует кислый раствор (две группы -СООН, одна -NH2), лизин — щелочной (одна группа -СООН, две -NH2).
1.1. Взаимодействие с металлами и щелочами
Как кислоты (по карбоксильной группе), аминокислоты могут реагировать с металлами, щелочами, образуя соли:

1.2. Взаимодействие с кислотами
По аминогруппе аминокислоты реагируют с основаниями:

2. Взаимодействие с азотистой кислотой
Аминокислоты способны реагировать с азотистой кислотой.
Например, глицин взаимодействует с азотистой кислотой:
![]()
3. Взаимодействие с аминами
Аминокислоты способны реагировать с аминами, образуя соли или амиды.
![]()
4. Этерификация
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир:
Например, глицин взаимодействует с этиловым спиртом:
![]()
5. Декарбоксилирование
Протекает при нагревании аминокислот с щелочами или при нагревании.
Например, глицин взаимодействует с гидроксидом бария при нагревании:
![]()
Например, глицин разлагается при нагревании:
![]()
6. Межмолекулярное взаимодействие аминокислот
При взаимодействии аминокислот образуются пептиды. При взаимодействии двух α-аминокислот образуется дипептид.
Например, глицин реагирует с аланином с образованием дипептида (глицилаланин):

Фрагменты молекул аминокислот, образующие пептидную цепь, называются аминокислотными остатками, а связь CO–NH — пептидной связью.
Источник

