Какая формула высшего оксида и гидроксида и его свойства мышьяка

В таблице Менделеева такой химический элемент, как мышьяк, занимает позицию на границе металл – неметалл. По своей активности он находится между водородом и медью. Неметаллический характер проявляется в том, что он способен проявлять степень окисления -3 (AsH3 – арсин). Соединения с положительной степенью окисления +3 обладают амфотерными свойствами, а со степенью +5 проявляются его кислотные свойства. Что представляет собой оксид мышьяка?

Оксиды и гидроксиды
Существуют следующие оксиды мышьяка: As2О3 и As2О5. Также есть соответствующие гидроксиды:
- Метамышьяковистая кислота HAsO2.
- Ортомышьяковистая кислота H3AsO3.
- Метамышьяковая кислота HAsO3.
- Ортомышьяковая кислота H3AsO4.
- Пиромышьяковая кислота H4As2O7.

Что такое триоксид мышьяка?
Мышьяк образует два оксида, из которых As2О3 имеет название триоксид. Это вещество, которое часто используется для лечения, но это не совсем безобидный химикат. Это неорганическое соединение, которое является основным источником органоарсенических соединений (соединений, содержащих химическую связь c углеродом) и многих других. Многие применения As2О3 являются спорными из-за токсичной природы элемента. Торговым названием этого соединения является Trisenox.
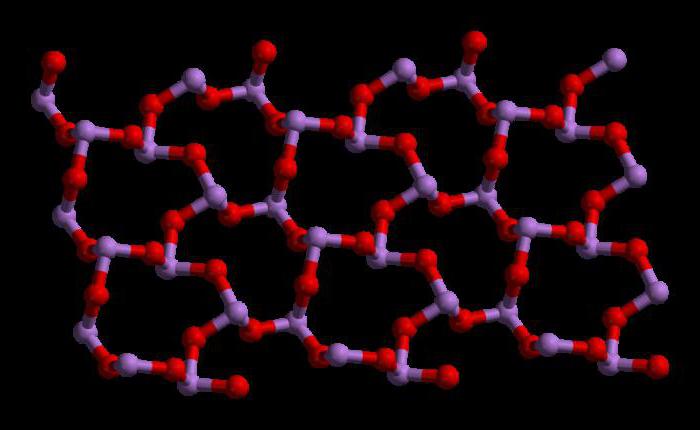
Общие сведения о триоксиде
Химическая формула триоксида мышьяка имеет следующий вид As2О3. Молекулярная масса этого соединения составляет 197,841 г/моль. Существует много способов получения этого оксида. Одним из них них является обжиг сульфидной руды. Химическая реакция происходит следующим образом:
2As2О3 + 9O2 → 2As2О3 + 6SO2
Большинство оксидов может быть получено в качестве побочного продукта переработки других руд. Арсенопирит является общей примесью в золоте и меди, и он высвобождает триоксид мышьяка при нагревании в присутствии воздуха. Это может привести к серьезному отравлению.

Структура триоксида мышьяка
Триоксид мышьяка имеет формулу As4O6 в жидкой и газовой фазах (ниже 800°C). В этих фазах он является изоструктурным с фосфоровым триоксидом (P4O6). Но при температуре выше 800°C As4O6 разрушается до молекулярного As2O3. В этой фазе он является изоструктурным с триоксидом диизотрона (N2O3). В своем твердом состоянии это соединение показывает полиморфную способность (способность существовать в двух или более формах кристаллической структуры).
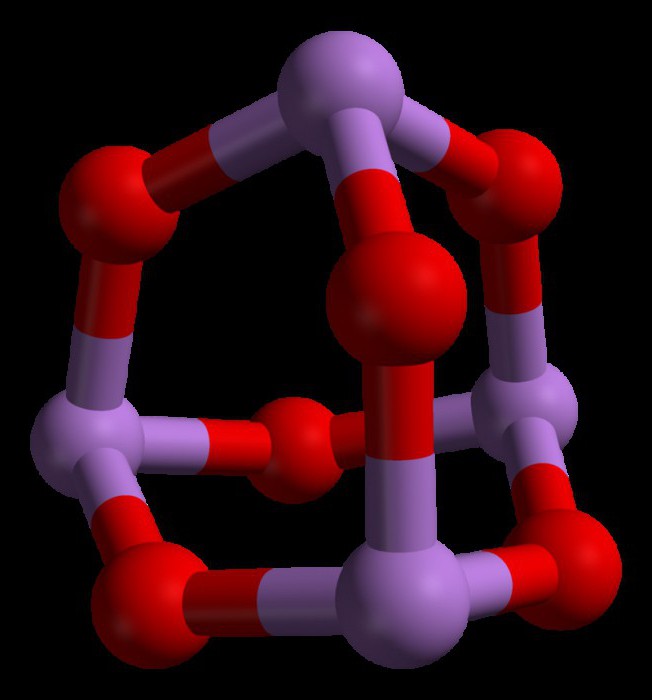
Свойства триоксида мышьяка
Некоторые из основных свойств триоксида мышьяка заключаются в следующем:
- Растворы триоксида образуют слабые кислоты с водой. Это связано с тем, что соединение представляет собой амфотерный оксид мышьяка.
- Он растворим в щелочных растворах и дает арсенаты.
- Триоксид мышьяка обладает высокой растворимостью в соляной кислоте (HCl) и, наконец, дает трихлорид мышьяка и концентрированную кислоту.
- Он дает пентаоксид (As2O5) в присутствии сильных окислителей, таких как пероксид водорода, озон и азотная кислота.
- Он почти нерастворим в органических растворителях.
- Он выглядит как белое твердое тело в нормальном физическом состоянии.
- Он имеет температуру плавления 312,2°C и температуру кипения 465°C.
- Плотность этого вещества составляет 4,15 г/см3.
Применение триоксида мышьяка в медицине
Это химическое вещество относится к классу противоопухолевых средств и применяется при лечении рака. Токсичность мышьяка хорошо известна. Но триоксид мышьяка является химиотерапевтическим препаратом и используется для лечения определенных видов рака в течение многих лет. Решение, используемое для этой обработки, называется раствором Фаулера. В 1878 году Бостонская городская больница сообщила, что этот раствор может быть эффективным в снижении количества лейкоцитов у человека.
В результате As2O3 был главным образом использован для лечения лейкемии до тех пор, пока его не заменила лучевая терапия. Но после 1930-х годов он постепенно восстановил свою популярность в лечении лейкемии, до тех пор, пока не появилась современная химиотерапия. Этот оксид мышьяка считался лучшим методом лечения хронической миелогенной лейкемии. Даже сегодня это вещество используется для лечения конкретного типа острого промиелоцитарного лейкоза при неудачной ретиноидной или антрациклиновой химиотерапии. Он также используется для лечения хронического миелоидного лейкоза, множественной миеломы, острого миелоидного лейкоза, лимфомы, рака лимфатической системы.

Использование триоксида
Триоксид мышьяка широко используется в производстве бесцветного стекла. Это соединение также полезно в области электроники для создания полупроводников и некоторых сплавов. Он используется и в красках. Триоксид мышьяка может оказаться эффективным средством лечения опухоли головного мозга.
В прошлом это вещество использовалось в стоматологии, но поскольку это высокотоксичное соединение, его применение современными стоматологами было прекращено. Оксид мышьяка (формула As2O3) используется также в качестве консерванта для древесины, но такие материалы запрещены во многих частях мира. В сочетании с ацетатом меди трехокись мышьяка дает яркий пигмент зеленого цвета.
Высокотоксичное вещество
Сам по себе триоксид обладает высоким уровнем токсичности. Поэтому всегда необходимо принять необходимые меры предосторожности, прежде чем его использовать. Он может быть очень опасным в следующих случаях:
- Прием пищи. Если As2O3 случайно попадает в пищеварительный тракт, нужно немедленно обратитесь к врачу. Не рекомендуется пытаться вызвать рвоту, прежде чем обращаться за медицинской помощью. Нужно убрать любую плотную одежду, снять галстук, расстегнуть воротник, пояс и т. д.
- Контакт с кожей. В случае соприкосновения с любой поверхностью тела стоит немедленно промыть пораженный участок большим количеством воды. Зараженная одежды и обувь должны быть немедленно удалены, и их следует вымыть перед повторным использованием. В случае серьезного контакта с кожей вам следует немедленно обратиться за медицинской помощью. Может быть полезно промывание зараженной области дезинфицирующим мылом и применение антибактериального крема.
- Попадание в глаза. Если As2O3 вступает в контакт с глазами, первое, что нужно сделать, это удалить любые контактные линзы и промывать глаза большим количеством воды в течение 15 минут. Рекомендуется использовать холодную воду. Параллельно с этим кто-то должен вызвать скорую.
- Ингаляция. Люди, которые вдыхали этот газ, должны быть помещены в другое место со свежим воздухом. А также нужно немедленно обратиться за медицинской помощью. Если трудно дышать, следует незамедлительно вводить кислород. Если пострадавший не в состоянии дышать самостоятельно, необходимо сделать искусственное дыхание.
- Это соединение может оказывать ядовитое воздействие на человека. В случае попадания в организм чрезмерного его количества триоксид мышьяка может даже привести к смерти. Защитные очки и перчатки всегда должны использоваться во время работы с As2O3. Работа всегда должна выполняться в хорошо проветриваемом помещении.

Побочные эффекты
Общие побочные эффекты этого вещества включают в себя такие симптомы, как:
- плохой аппетит;
- рвота;
- тошнота;
- боль в животе;
- запор;
- головная боль;
- усталость;
- головокружение;
- лихорадка;
- проблемы с дыханием;
- высокий уровень лейкоцитов;
- высокий уровень сахара в крови;
- кожная сыпь.
Менее распространенные побочные эффекты включают в себя:
- сухость во рту;
- сбивчивое дыхание;
- боль в груди;
- низкий уровень лейкоцитов;
- мышечную и костную боль;
- опухание лица и глаз;
- понос;
- тремор;
- низкий уровень сахара в крови;
- низкий уровень кислорода в крови.
Редкие побочные эффекты As2O3:
- нерегулярное сердцебиение (это может даже привести к смерти);
- увеличение веса;
- обморок;
- рассеянность;
- кома;
- распухший живот;
- потемнение кожи.
Опасные для жизни симптомы воздействия триоксида мышьяка – это увеличение веса, лихорадка, сложность дыхания, одышка, грудная боль, кашель.
Триоксид мышьяка является высокотоксичным веществом, которое может даже привести к гибели человека. Тем не менее, он имеет свою полезность в медицинской области. Всегда должны приниматься меры предосторожности.
Химические реакции
Триоксид мышьяка представляет собой амфотерный высший оксид мышьяка, и его водные растворы являются слабокислотными. Таким образом, он легко растворяется в щелочных растворах для получения арсенатов. Он менее растворим в кислотах, за исключением соляной.
Только с сильными окислителями, такими как озон, перекись водорода и азотная кислота, из него образуется пента-оксид мышьяка с +5 степенью кислотности As2O5. Что касается устойчивости к окислению, триоксид мышьяка отличается от триоксида фосфора, который легко сгорает до пятиокиси фосфора. Редукция дает элементный мышьяк или арсин (AsH3).

Пентаоксид мышьяка
Химической формулой пентаоксида является As2O5. Его молярная масса составляет 229,8402 г/моль. Это белый гигроскопичный порошок с плотностью 4,32 г/см3. Температура плавления достигает 315°C, при которой он начинает разлагаться. Вещество имеет хорошую растворимость в воде и спирте. Свойства оксида мышьяка делают его очень токсичным и опасным для окружающей среды. Это неорганическое соединение, которое является менее распространенным, высокотоксичными и, следовательно, находит лишь ограниченное коммерческое применение, в отличие от высшего оксида мышьяка (формула As2O3).
Мышьяк известен в первую очередь как яд и канцероген. Его триоксид – это водорастворимый порошок, который производит бесцветный, безвкусный и без запаха раствор. Это был популярный способ убийства в средние века. Его использование продолжается и сегодня, но уже в мирных целях и в небольшом количестве.
Источник
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 16 февраля 2020; проверки требует 1 правка.
Оксид мышьяка(III) — неорганическое соединение с химической формулой As2O3, являющееся ценным химическим сырьём для получения других производных мышьяка, в том числе мышьяксодержащих органических соединений. Валовой объём производства в мире — 50 000 тонн в год[1]. Однако безопасность применения во многих областях подвергается сомнению из-за чрезвычайно высокой токсичности данного вещества.
Получение и свойства[править | править код]
Оксид мышьяка(III) может быть получен многими способами, включая окисление (горение) мышьяка и его производных на воздухе. Показательна реакция разложения аурипигмента, сульфида мышьяка:
Большая часть, однако, является побочным продуктом других производств — золотодобычи и получения меди, где он выделяется при прокаливании на воздухе, что приводило к многочисленным массовым отравлениям[2]. В настоящее время интенсивная добыча мышьяковых руд ведётся только в Китае[1].
Оксид мышьяка(III) является амфотерным оксидом, его раствор обладает слабокислой реакцией. В щелочных растворах образует арсениты, в концентрированной соляной кислоте даёт хлорид мышьяка(III).
Только сильнейшие окислители — озон, пероксид водорода, азотная кислота — способны превратить его в оксид мышьяка(V) As2O5 или — при понижении концентрации — арсин (AsH3) в зависимости от условий реакции.
Структура[править | править код]
В жидком и газообразном (до 800 °C) состояниях имеет формулу As4O6 (в форме димера) и изоструктурен P4O6). При нагреве свыше 800 °C As4O6 распадается на молекулы As2O3, схожий по строению с N2O3. В твёрдом состоянии сосуществуют три полиморфных формы: кубический молекулярный As4O6 и две полимерные формы. Полимеры, образующие при остывании монокристаллы, напоминают пирамидальную структуру AsO3 с общими атомами кислорода.[3]
Использование[править | править код]
Оксид мышьяка(III) используется для изготовления цветного стекла, также применяется в лесохимии и электротехнике полупроводников[1], получения чистого мышьяка и его соединений, таких как какодилат натрия и арсенид натрия.
В соединении с ацетатом меди(II)[1] триоксид образует красящее вещество — парижскую зелень, ныне из-за чрезвычайной токсичности неиспользуемую.
Применение в медицине[править | править код]
Используется с древнейших времён в китайской медицине[4], а также (с XIX века) в гомеопатии. В конвенциональной медицине триоксид мышьяка используется для лечения злокачественных опухолей, таких как лейкемия, однако ввиду высоких рисков его применения предпочтение отдаётся другим препаратам[5][6][7].
Также триоксид успешно лечит аутоиммунные заболевания[8], взаимодействует с ферментом тиоредоксиновая редуктаза[9].
Обнаружение в природе[править | править код]
As2O3 содержится в арсенолите и клаудетите.
Токсикология[править | править код]
Оксид мышьяка (III) очень ядовит. Токсичность триоксида стала легендарной и широко описана в литературе[10][11][11][12].
В Австрии жили «мышьякоеды», получавшие дозы во много раз больше смертельной без особого вреда для здоровья. Считается, что мышьяк повышает работоспособность, особенно при работе на больших высотах[13][14][15].
ПДК для неорганических соединений мышьяка, включая As2O3, составляет 0.010 мг/м³.
Полулетальная доза — 19,1 мг/кг.[источник не указан 1575 дней]
Примечания[править | править код]
- ↑ 1 2 3 4 Sabina C. Grund, Kunibert Hanusch, Hans Uwe Wolf «Arsenic and Arsenic Compounds» in Ullmann’s Encyclopedia of Industrial Chemistry, VCH-Wiley, 2008, Weinheim. (англ.)
- ↑ Giant Mine – Northwest Territories Region – Indian and Northern Affairs Canada (недоступная ссылка). Дата обращения 28 августа 2007. Архивировано 2 апреля 2012 года. (англ.)
- ↑ Holleman, A. F.; Wiberg, E. «Inorganic Chemistry» Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ↑ Marcel Gielen, Edward R. T. Tiekink. Metallotherapeutic Drugs and Metal-Based Diagnostic Agents (англ.). — Wiley, 2005. — P. 298.
- ↑ Steven L. Soignet et al. United States Multicenter Study of Arsenic Trioxide in Relapsed Acute Promyelocytic Leukemia (англ.) // Journal of Clinical Oncology (англ.)русск. : journal. — 2001. — Vol. 19, no. 18. — P. 3852—3860.
- ↑ Antman, K. H. Introduction: The history of arsenic trioxide in cancer therapy (англ.) // Oncologist : journal. — 2001. — Vol. 6(Suppl. 2), no. 1—2. — P. 2006.
- ↑ Jun Zhu, Zhu Chen,Valérie Lallemand-Breitenbach, Hugues de Thé “How Acute Promyelocytic Leukaemia Revived Arsenic, ” Nature Reviews Cancer 2002, volume 2, 1-9.
- ↑ Bobé Pierre, Bonardelle Danielle, Benihoud Karim, Opolon Paule, Chelbi-Alix Mounira. Arsenic trioxide: A promising novel therapeutic agent for lymphoproliferative and autoimmune syndromes in MRL/lpr mice (англ.) // Blood (англ.)русск. : journal. — American Society of Hematology (англ.)русск., 2006. — Vol. 108, no. 13. — P. 3967—3975..
- ↑ Lu J., Chew E. H., Holmgren A. Targeting thioredoxin reductase is a basis for cancer therapy by arsenic trioxide (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2007. — Vol. 104, no. 30. — P. 12288—12293. — doi:10.1073/pnas.0701549104. — PMID 17640917.
- ↑ Stanton v Benzler 9716830. U.S. 9th Circuit Court of Appeals (17 июня 1998). — «(…) convicted by a jury of first degree murder for poisoning her ex-husband. Her ex-husband’s body was found with traces of arsenic trioxide in it.». Дата обращения 9 июня 2008. Архивировано 2 апреля 2012 года.
- ↑ 1 2 Emsley, John. Arsenic // The Elements of Murder: A History of Poison (англ.). — Oxford University Press, 2006. — P. 93 —197. — ISBN 9780192806000.
- ↑ Madame Bovary by Flaubert
- ↑ Arsenic Eaters — New York Times July 26, 1885
- ↑ Richard M. Allesch. Arsenik. Seine Geschichte in Österreich. 54. Band. Klagenfurt: Kleinmayr 1959.
- ↑ G. Przygoda, J. Feldmann, W. R. Cullen. The arsenic eaters of Styria: a different picture of people who were chronically exposed to arsenic (англ.) // Applied Organometallic Chemistry (англ.)русск. : journal. — 2001. — Vol. 15, no. 6. — P. 457—462. — doi:10.1002/aoc.126.
Ссылки[править | править код]
На английском языке
- Solubility of As2O3 in water as function of temperature
- Case Studies in Environmental Medicine: Arsenic Toxicity
- IARC Monograph — Arsenic and Arsenic Compounds
- International Chemical Safety Card 0378
- NIOSH Pocket Guide to Chemical Hazards
- NTP Report on Carcinogens — Inorganic Arsenic Compounds
- Use of Arsenic Trioxide in Multiple Myeloma Treatment
- The use of Arsenic trioxide in medicine.
- Institute of Chemistry Austria, speciallised on arsenic and various arsenic compounds
Источник
№33 Мышьяк

Соединения мышьяка (англ. и франц. Arsenic, нем. Arsen) известны очень давно. Так уже в I в.
древнегреческий военный врач, фармаколог и натуралист Диоскорид описал обжигание аурипигмента (сульфида мышьяка) с образованием при этом белого мышьяка (Аs2O3).
Когда именно впервые был получен металлический мышьяк неизвестно, обычно это приписывается Альберту великому (ХIII в.). В названии «мышьяк» предположительно отражены ядовитые свойства соединений элемента и их применение (от «мышь-яд»).
Нахождение в природе, получение:
мышьяка в земной коре 1,7·10-4% по массе. Это рассеяный элемент, известно около 200 мышьяксодержащих минералов, часто содержится в свинцовых, медных и серебряных рудах.
Наиболее известны два природных соединения мышьяка с серой: оранжево-красный прозрачный реальгар AsS и лимонно-жёлтый аурипигмент As2S3. Главный промышленный минерал мышьяка — арсенопирит FeAsS.
Мышьяк получают как сопутствующий продукт при переработке содержащих его золотых, свинцово-цинковых, медноколчеданных и других руд. При их обжиге образуется летучий оксид мышьяка(III), который конденсируют и восстанавливают углем.
Физические свойства:
Мышьяк существует в нескольких аллотропных формах и в этом отношении весьма напоминает фосфор. Самая устойчивая из них — серый мышьяк, весьма хрупкое вещество, но имеет металлический блеск и электропроводно (отсюда название «металлический мышьяк»).
При быстром охлаждении паров мышьяка получается прозрачное мягкое вещество желтого цвета, состоящее из молекул As4, имеющих форму тетраэдра. Существует также черный мышьяк — аллотропная модификация с аморфным строением.
Мышьяк при нагревании возгоняется, расплавить его можно только в запаянных ампулах под давлением (817°C, 3,6МПа).
Химические свойства:
Мышьяк химически активен. При нагревании на воздухе сгорает с образованием оксида мышьяка(III), с фтором и хлором самовоспламеняется, взаимодействует с халькогенами: серой, селеном, теллуром, образуя различные соединения.
Взаимодействует с водородом, образуя газ арсин AsH3.
Разбавленная азотная кислота окисляет мышьяк до H3AsO3, концентрированная — до H3AsO4:
As + 5HNO3 = H3AsO4 + 5NO2 + H2O
Мышьяк нерастворим, не взаимодействует с водой и растворами щелочей.
Важнейшие соединения:
Оксид мышьяка(III), As2O3 — простейшая формула As4O6 — истинная, белые крист., ядовит, при растворении образует мышьяковистые кислоты. Реагирует с конц.
соляной кислотой с образованием хлорида мышьяка(III): As2O3 + 6HCl = 2AsCl3 + 3H2O
Метамышьяковистая и ортомышьяковистая кислоты — HAsO2 и H3AsO3, очень слабые, соли — арсениты.
Сильные восстановители
Оксид мышьяка(V), As2O5, получают при осторожном обезвоживании мышьяковой кислоты или окислением оксида мышьяка(III) озоном, азотной кислотой. При небольшом нагревании распадается на As2O3 и кислород.
Растворяется в воде с образованием мышьяковой кислоты.
Мышьяковая кислота — H3AsO4, белые крист., к-та средней силы, соли — арсенаты, гидро- и дигидроарсенаты. Качественная реакция — образование арсената серебра Ag3AsO4 (осадок, цвет «кофе с молоком»)
Сульфиды мышьяка, As2S3 — темно-жёлтые крист. (минерал аурипигмент), As2S5 — ярко-жёлтые крист., не растворимы. При взаимодействии с растворами сульфидов щелочных металлов или аммония растворяются, образуя соли соотв. тиокислот: As2S3 + 3(NH4)2S = 2(NH4)3AsS3 (тиоарсенит аммония),
As2S5 + 3(NH4)2S = 2(NH4)3AsS4 (тиоарсенат аммония).Растворяются и в щелочах, образуя смеси солей соответствующих кислот, например:
As2S3 + 6KOH = K3AsO3 + K3AsS3 + 3H2O
Хлорид мышьяка(III) — AsCl3, бесцветная маслянистая жидкость, на воздухе дымится. Водой разлагается: AsCl3 + 3H2O = H3AsO3 + 3HCl.
Арсин — AsH3, мышьяковистый водород, бесцв. очень токсичный газ, чесночный запах обусловлен примесями продуктов окисления.Сильный восстановитель. Образуется при восстановлении многих мышьяковистых соединений цинком в кислой среде по схеме: (As) + Zn + HCl => AsH3 + ZnCl2 + … .
На этом основана высокочувствительная качественная реакция на мышьяк — реакция Марша, поскольку выделяющийся арсин при пропускании через нагреваемую стеклянную трубку разлагается, образуя на ее стенках черный зеркальный налет.
Мышьяк используется в металлургии, как компонент, улучшающий свойства некоторых специальных сплавов.
Важной областью применения является также синтез соединений с полупроводниковыми свойствами (GaAs — арсенид галия, третий в масштабах применения полупроводник после кремния и германия).
По-прежнему, многие соединения мышьяка используют для борьбы с насекомыми и грызунами (As2O3, Ca3As2, парижская зелень), для изготовления некоторых медицинских препаратов.
Арапова К., Хабарова М.
ХФ ТюмГУ, 561 группа.
Источники: Википедия: Мышьяк
Популярная библиотека химических элементов. Мышьяк
Оксид мышьяка: получение и свойства

В таблице Менделеева такой химический элемент, как мышьяк, занимает позицию на границе металл — неметалл. По своей активности он находится между водородом и медью.
Неметаллический характер проявляется в том, что он способен проявлять степень окисления -3 (AsH3 — арсин).
Соединения с положительной степенью окисления +3 обладают амфотерными свойствами, а со степенью +5 проявляются его кислотные свойства. Что представляет собой оксид мышьяка?
Оксиды и гидроксиды
Существуют следующие оксиды мышьяка: As2О3 и As2О5. Также есть соответствующие гидроксиды:
- Метамышьяковистая кислота HAsO2.
- Ортомышьяковистая кислота H3AsO3.
- Метамышьяковая кислота HAsO3.
- Ортомышьяковая кислота H3AsO4.
- Пиромышьяковая кислота H4As2O7.
Что такое триоксид мышьяка?
Мышьяк образует два оксида, из которых As2О3 имеет название триоксид. Это вещество, которое часто используется для лечения, но это не совсем безобидный химикат.
Это неорганическое соединение, которое является основным источником органоарсенических соединений (соединений, содержащих химическую связь c углеродом) и многих других.
Многие применения As2О3 являются спорными из-за токсичной природы элемента. Торговым названием этого соединения является Trisenox.
Химическая формула триоксида мышьяка имеет следующий вид As2О3. Молекулярная масса этого соединения составляет 197,841 г/моль. Существует много способов получения этого оксида. Одним из них них является обжиг сульфидной руды. Химическая реакция происходит следующим образом:
2As2О3 + 9O2 → 2As2О3 + 6SO2
Большинство оксидов может быть получено в качестве побочного продукта переработки других руд. Арсенопирит является общей примесью в золоте и меди, и он высвобождает триоксид мышьяка при нагревании в присутствии воздуха. Это может привести к серьезному отравлению.
Структура триоксида мышьяка
Триоксид мышьяка имеет формулу As4O6 в жидкой и газовой фазах (ниже 800°C). В этих фазах он является изоструктурным с фосфоровым триоксидом (P4O6). Но при температуре выше 800°C As4O6 разрушается до молекулярного As2O3.
В этой фазе он является изоструктурным с триоксидом диизотрона (N2O3). В своем твердом состоянии это соединение показывает полиморфную способность (способность существовать в двух или более формах кристаллической структуры).
Свойства триоксида мышьяка
Некоторые из основных свойств триоксида мышьяка заключаются в следующем:
- Растворы триоксида образуют слабые кислоты с водой. Это связано с тем, что соединение представляет собой амфотерный оксид мышьяка.
- Он растворим в щелочных растворах и дает арсенаты.
- Триоксид мышьяка обладает высокой растворимостью в соляной кислоте (HCl) и, наконец, дает трихлорид мышьяка и концентрированную кислоту.
- Он дает пентаоксид (As2O5) в присутствии сильных окислителей, таких как пероксид водорода, озон и азотная кислота.
- Он почти нерастворим в органических растворителях.
- Он выглядит как белое твердое тело в нормальном физическом состоянии.
- Он имеет температуру плавления 312,2°C и температуру кипения 465°C.
- Плотность этого вещества составляет 4,15 г/см3.
Применение триоксида мышьяка в медицине
Это химическое вещество относится к классу противоопухолевых средств и применяется при лечении рака. Токсичность мышьяка хорошо известна.
Но триоксид мышьяка является химиотерапевтическим препаратом и используется для лечения определенных видов рака в течение многих лет. Решение, используемое для этой обработки, называется раствором Фаулера.
В 1878 году Бостонская городская больница сообщила, что этот раствор может быть эффективным в снижении количества лейкоцитов у человека.
В результате As2O3 был главным образом использован для лечения лейкемии до тех пор, пока его не заменила лучевая терапия. Но после 1930-х годов он постепенно восстановил свою популярность в лечении лейкемии, до тех пор, пока не появилась современная химиотерапия.
Этот оксид мышьяка считался лучшим методом лечения хронической миелогенной лейкемии. Даже сегодня это вещество используется для лечения конкретного типа острого промиелоцитарного лейкоза при неудачной ретиноидной или антрациклиновой химиотерапии.
Он также используется для лечения хронического миелоидного лейкоза, множественной миеломы, острого миелоидного лейкоза, лимфомы, рака лимфатической системы.
Использование триоксида
Триоксид мышьяка широко используется в производстве бесцветного стекла. Это соединение также полезно в области электроники для создания полупроводников и некоторых сплавов. Он используется и в красках. Триоксид мышьяка может оказаться эффективным средством лечения опухоли головного мозга.
В прошлом это вещество использовалось в стоматологии, но поскольку это высокотоксичное соединение, его применение современными стоматологами было прекращено. Оксид мышьяка (формула As2O3) используется также в качестве консерванта для древесины, но такие материалы запрещены во многих частях мира. В сочетании с ацетатом меди трехокись мышьяка дает яркий пигмент зеленого цвета.
Высокотоксичное вещество
Сам по себе триоксид обладает высоким уровнем токсичности. Поэтому всегда необходимо принять необходимые меры предосторожности, прежде чем его использовать. Он может быть очень опасным в следующих случаях:
- Прием пищи. Если As2O3 случайно попадает в пищеварительный тракт, нужно немедленно обратитесь к врачу. Не рекомендуется пытаться вызвать рвоту, прежде чем обращаться за медицинской помощью. Нужно убрать любую плотную одежду, снять галстук, расстегнуть воротник, пояс и т. д.
- Контакт с кожей. В случае соприкосновения с любой поверхностью тела стоит немедленно промыть пораженный участок большим количеством воды. Зараженная одежды и обувь должны быть немедленно удалены, и их следует вымыть перед повторным использованием. В случае серьезного контакта с кожей вам следует немедленно обратиться за медицинской помощью. Может быть полезно промывание зараженной области дезинфицирующим мылом и применение антибактериального крема.
- Попадание в глаза. Если As2O3 вступает в контакт с глазами, первое, что нужно сделать, это удалить любые контактные линзы и промывать глаза большим количеством воды в течение 15 минут. Рекомендуется использовать холодную воду. Параллельно с этим кто-то должен вызвать скорую.
- Ингаляция. Люди, которые вдыхали этот газ, должны быть помещены в другое место со свежим воздухом. А также нужно немедленно обратиться за медицинской помощью. Если трудно дышать, следует незамедлительно вводить кислород. Если пострадавший не в состоянии дышать самостоятельно, необходимо сделать искусственное дыхание.
- Это соединение может оказывать ядовитое воздействие на человека. В случае попадания в организм чрезмерного его количества триоксид мышьяка может даже привести к смерти. Защитные очки и перчатки всегда должны использоваться во время работы с As2O3. Работа всегда должна выполняться в хорошо проветриваемом помещении.
Побочные эффекты
Общие побочные эффекты этого вещества включают в себя такие симптомы, как:
- плохой аппетит;
- рвота;
- тошнота;
- боль в животе;
- запор;
- головная боль;
- усталость;
- головокружение;
- лихорадка;
- проблемы с дыханием;
- высокий уровень лейкоцитов;
- высокий уровень сахара в крови;
- кожная сыпь.
Менее распространенные побочные эффекты включают в себя:
- сухость во рту;
- сбивчивое дыхание;
- боль в груди;
- низкий уровень лейкоцитов;
- мышечную и костную боль;
- опухание лица и глаз;
- понос;
- тремор;
- низкий уровень сахара в крови;
- низкий уровень кислорода в крови.
Редкие побочные эффекты As2O3:
- нерегулярное сердцебиение (это может даже привести к смерти);
- увеличение веса;
- обморок;
- рассеянность;
- кома;
- распухший живот;
- потемнение кожи.
Опасные для жизни симптомы воздействия триоксида мышьяка — это увеличение веса, лихорадка, сложность дыхания, одышка, грудная боль, кашель.
Триоксид мышьяка является высокотоксичным веществом, которое может даже привести к гибели человека. Тем не менее, он имеет свою полезность в медицинской области. Всегда должны приниматься меры предосторожности.
Химические реакции
Триоксид мышьяка представляет собой амфотерный высший оксид мышьяка, и его водные растворы являются слабокислотными. Таким образом, он легко растворяется в щелочных растворах для получения арсенатов. Он менее растворим в кислотах, за исключением соляной.
Только с сильными окислителями, такими как озон, перекись водорода и азотная кислота, из него образуется пента-оксид мышьяка с +5 степенью кислотности As2O5. Что касается устойчивости к окислению, триоксид мышьяка отличается от триоксида фосфора, который легко сгорает до пятиокиси фосфора. Редукция дает элементный мышьяк или арсин (AsH3).
Пентаоксид мышьяка
Химической формулой пентаоксида является As2O5. Его молярная масса составляет 229,8402 г/моль. Это белый гигроскопичный порошок с плотностью 4,32 г/см3. Температура плавления достигает 315°C, при которой он начинает разлагаться. Вещество имеет хорошую растворимость в воде и спирте.
Свойства оксида мышьяка делают его очень токсичным и опасным для окружающей среды. Это неорганическое соединение, которое является менее распространенным, высокотоксичными и, следовательно, находит лишь ограниченное коммерческое применение, в отличие от высшего оксида мышьяка (формула As2O3).
Мышьяк известен в первую очередь как яд и канцероген. Его триоксид — это водорастворимый порошок, который производит бесцветный, безвкусный и без запаха раствор. Это был популярный способ убийства в средние века. Его использование продолжается и сегодня, но уже в мирных целях и в небольшом количестве.
Источник
