Какая аминокислота обладает гидрофильными свойствами

К гидрофильным относятся аминокислоты, содержащие в боковой цепи карбоксильную или аминогруппу. Обе эти группы при физиологических значениях pH ионизированы.
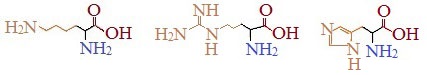
Аспарагиновая и глутаминовая кислоты – кислые аминокислоты, лизин и аргинин – сильно основные, а гистидин – слабо основная аминокислота. Кольцевая структура в молекуле гистидина называется имидазольным кольцом.

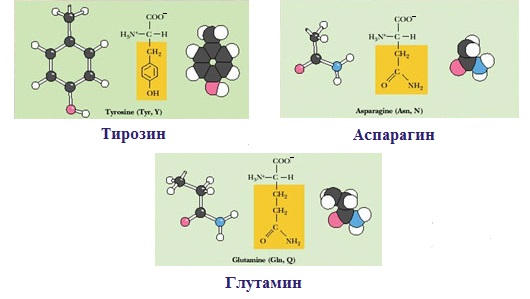
Аспарагиновая и глутаминовая аминокислоты в белках представлены также и своими амидами – аспарагином и глутамином.

К гидрофильным относятся также гидроксилсодержащие аминокислоты:

Цистеин, как и серин, содержит тиольную группу -SH вместо гидроксильной -ОН. Его специфическая роль в белках двояка: благодаря цистеину в активные центры белков могут быть введены тиольные группы, а два остатка цистеина в белках могут соединяться ковалентной связью -S-S-.

Пролин примечателен тем, что его остаток вызывает излом пептидной цепи. В отличие от других аминокислот свободный пролин содержит не амино-, а иминогруппу.
Аминокислоты – амфотерные электролиты (амфолиты) обладают свойствами как кислот, так и оснований. На основании положений физической химии, аминокислоты принадлежат к слабым электролитам и в водных растворах в зависимости от pH среды несут на себе различный заряд в соответствии с уравнением равновесия (константы равновесия Ка, Ка2 и KaR):

И, как видно из табл. 3.1, боковые функциональные группы ряда аминокислот также обладают кислотно-основными свойствами: рKaR – это константа кислотности для боковой цепи аминокислоты, имеющей функциональные группы с кислотно-основными свойствами. Например, в боковой цепи глутаминовой кислоты имеется функциональная группа -СООН, для которой при определенных условиях характерно кислотно-основное равновесие

Электрический заряд на функциональной группе определяется соотношением между значениями рКа этой группы и pH раствора, описываемым уравнением Гендерсона-Гассельбаха (2.4). Каждая способная к ионизации группа аминокислоты может находиться в одном из двух состояний – заряженном или нейтральном. Анион СОО- обладает основными свойствами (принимает ион Н+), а катион NH3+ – свойствами кислоты (отдает ион Н+).
Значение pH, при котором аминокислота находится в растворе только в виде цвиттер-иона (суммарно электрически нейтральна), называют изоэлектрической точкой (ИЭТ) аминокислоты. В ИЭТ растворимость аминокислот минимальна, и в электрическом поле постоянного тока аминокислоты остаются неподвижными. В изо- электрическом состоянии аминокислоты обладают повышенной плотностью, высокой точкой плавления (свыше 200 °С). Растворы аминокислот обладают более высокой диэлектрической постоянной, чем вода, причем максимум значения достигается в ИЭТ. Значение pH в изоэлектрической точке (pi) для моноаминокарбо- новых кислот (кислоты, у которых боковые цепи не имеют функциональных групп, способных к ионизации, иными словами, не содержат амино- и карбоксильных групп) можно определить следующим образом: р! = (Ка + Каг)/2.
Таблица 3.1
Характеристика аминокислот1
Наименование | Сокращения, принятые в литературе | Краткая характеристика химических свойств боковых цепей | рКа бок. цепей | Примечание | |
Глицин* | Gly | G | Выступает в роли простейшего связующего звена в цепи белка | Участвует в синтезе креатина, пиррола, в обезвреживании ряда ядовитых веществ | |
Аминокислоты с углеводородными боковыми цепями | |||||
Аланин* | Ala | A | Служат для гидрофобной стабилизации белка и для формирования центров свя- зывания в ферментах | ||
Валин** | Val | V | |||
Лейцин** | Leu | L | |||
Изолейцин** | lie | 1 | Имеется еще один хиральный центр | ||
Ароматические аминокислоты | |||||
Фенилаланин** | Phe | F | Способен образовывать гидрофобные связи и эффективно связываться с другими плоскими молекулами | ||
Тирозин* (из фенилаланина) | Tyr | Способен образовывать гидрофобные связи и эффективно связываться с другими плоскими молекулами | – 10,1 | Концентрируется в тканях щитовидной железы | |
Триптофан** | Trp | W | Способен образовывать гидрофобные связи и эффективно связываться с другими плоскими молекулами | ||
Аминокислоты – спирты | |||||
Серин* | Ser | S | -ОН группа имеет очень слабые кислотные свойства | – 13,6 | |
Треонин** | Thr | T | |||
Окончание табл. 3.1
Наименование | Сокращения, принятые в литературе | Краткая характеристика химических свойств боковых цепей | PКо бок. цепей | Примечание | ||
Аминокислоты с кислыми свойствами боковых цепей | ||||||
Аспарагиновая кислота* | Asp | D | При нейтральных pH карбоксильные группы диссоциированы | ~ 3,9 | Играет важную роль в процессах обмена | |
Глутаминовая кислота* | Glu | E | 4.3-4,7 | |||
Аминокислоты с основными свойствами боковых цепей | ||||||
Лизин** | Lys | К | Гибкая боковая цепь с реакционно- способной аминогруппой на конце | – 10,5 | ||
Аргинин** | Arg | R | Гуанидиниевая группа протонирована | -12,5 | Arg богаты ядра клеток, а также белки растущих тканей (эмбриональная ткань, опухоли) | |
Гистидин** | His | H | Основная группа несет положительный заряд и может служить акцептором протона | -6,1 | ||
Амиды аспарагиновой и глутаминовой кислот | ||||||
Аспарагин* | Asn | N | Амидная группа не обладает кислотными свойствами, но полярна и может участвовать в образовании водородных связей | |||
Глутамин* | Gin | Q | Встречается во всех тканях организма в свободном состоянии | |||
Серосодержащие аминокислоты | |||||
Метионин** | Met | М | -СН3 в организме участвует в метилировании различных соединений | ||
Цистеин* (из метионина) | Cys | С | Самопроизвольно окисляется в присутствии О2 с образованием «двойной аминокислоты» – цистина | – 10,3 | Кератин волос богат этой аминокислотой |
Кислота, содержащая имино- вместо аминогруппы | |||||
Пролин* | Pro | [р | Боковая цепь замыкается на аминогруппу | ||
* – аминокислоты, синтезируемые организмом. ** – аминокислоты, поступающие в организм только с пищей. | |||||
1 Если неизвестно, какая аминокислота стоит в боковой цепи белка – аспарагин или аспарагиновая кислота, ис пользуют обозначение Asx или В. В случае глутамина или глутаминовой кислоты применяется Glx или Z.
Зоны буферного действия у аминокислот очень малы. Значения рКаи рКа2, pi для аминокислот определяют, как правило, методом потенциометрического титрования. На рис. 3.1 представлена типичная кривая титрования аминокислоты.

Рис. 3.1. Кривая титрования аминокислоты
Значения рКаи рКа2> рКая, pi для каждой аминокислоты индивидуальны. В табл. 3.2 представлены значения этих параметров для некоторых аминокислот.
Значения pKal, рКа2, рKaR, pi для некоторых аминокислот
Таблица 3.2
Аминокислота | P^i | Р KaR | Pi | |
Аспарагиновая кислота | 1,99 | 9,90 | 3,90 | 3,0 |
Глутаминовая кислота | 2,10 | 9,47 | 4,07 | 3,2 |
Цистеин | 1,92 | 10,70 | 8,37 | 5,1 |
Тирозин | 2,20 | 9,21 | 10,46 | 5,7 |
Г истидин | 1,80 | 9,33 | 6,04 | 7,6 |
Лизин | 2,16 | 9,06 | 10,54 | 9,7 |
Аргинин | 1,82 | 8,99 | 12,48 | 10,8 |
Аланин | 2,35 | 9,87 | 6,02 | |
Глутамин | 2,17 | 9,13 | ||
Глицин | 2,35 | 9,78 | ||
Серин | 2,19 | 9,21 | ||
Лейцин | 2,33 | 9,74 | ||
Треонин | 2,09 | 9,10 | ||
Аспарагин | 2,14 | 8,12 | ||
Валин | 2,29 | 9,74 | ||
Пролин | 1,95 | 10,64 |
Из данных, приведенных в табл. 3.2, видно, что буферными свойствами при значениях pH, близких к pH крови и межклеточной жидкости, обладает практически только одна аминокислота – гистидин, так как для нее величина рKaR = 6,04. Это свойство гистидина в организме используется следующим образом: гемоглобин характеризуется высоким содержанием гистидина, что очень важно для создания высокой буферной емкости при pH, близкой к 7, для переноса кислорода и углекислого газа. Зоны буферного действия аминокислот очень малы.
Аминокислоты при значениях pH, отличающихся от значения их pH в ИЭТ (pi), несут суммарный электрический заряд, который в зависимости от pH может быть как положительным, так и отрицательным. При любом значении pH, превышающем значение pi, суммарный заряд молекулы отрицательный, и в электрическом поле она движется в сторону положительного электрода {анода). Соответственно при pH ниже значения pi молекула аминокислоты несет положительный заряд и в электрическом поле движется к катоду. Чем больше значения pH отличаются от значения pi, тем больший суммарный заряд несет молекула и тем выше скорость ее движения к электроду. Данные свойства молекул аминокислот широко используются для их разделения и анализа в смесях, например, методами электрофореза и ионнообменной хроматографии.
Для разделения применяют препаративные методики получения относительно больших количеств чистого материала, который может быть в дальнейшем использован для различных целей.
Для анализа применяют аналитические методики, направленные на контроль качества, определение состава смеси компонентов, определение их заряда и т. п.
Источник
Аминокислоты классифицируют по следующим структурным признакам.
I. Классификация по взаимному положения функциональных групп
В зависимости от взаимного расположения амино- и карбоксильной групп аминокислоты подразделяют на α- , b- , g- , d- , e- и т. д.
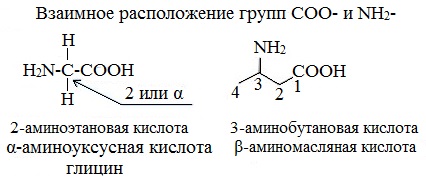
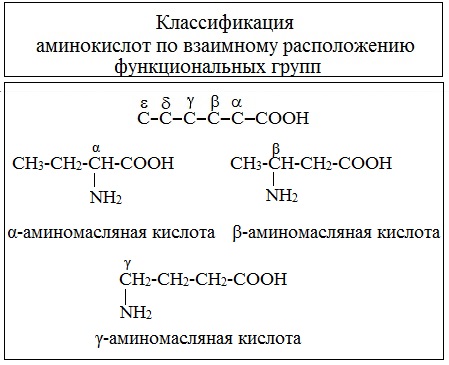
Греческая буква при атоме углерода обозначает его удаленность от карбоксильной группы.
II. Классификация по строению бокового радикала (функциональным группам)
Алифатические аминокислоты
Моноаминомонокарбоновые кислоты: глицин, аланин, валин, изолейцин, лейцин.
Оксимоноаминокарбоновые кислоты (содержат-ОН-группу): серин, треонин.
Моноаминодикарбоновые кислоты (содержат СООН-группу): аспартат, глутамат (за счёт второй карбоксильной группы несут в растворе отрицательный заряд).
Амиды моноаминодикарбоновых кислоты (содержат NH2СО-группу): аспарагин, глутамин.
Диаминомонокарбоновые кислоты (содержат NH2-группу): лизин, аргинин (за счёт второй аминогруппы несут в растворе положительный заряд).
Серусодержащие кислоты: цистеин, метионин.
Ароматические аминокислоты: фенилаланин, тирозин, триптофан.
Гетероциклические аминокислоты: триптофан, гистидин, пролин.
Иминокислоты: пролин.
Важнейшие α–аминокислоты
III. Классификация по полярности бокового радикала (по Ленинджеру)
Выделяют четыре класса аминокислот, содержащих радикалы следующих типов.
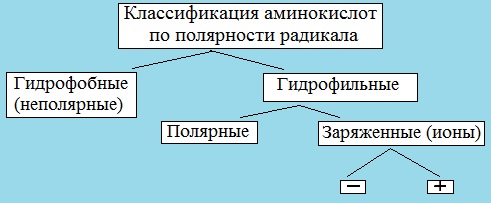
Гидрофобные аминокислоты располагаются внутри молекулы белка, тогда как гидрофильные – на внешней поверхности, что делает гидрофильными и хорошо растворимыми в воде молекулы белка.
Благодаря этому свойству белки хорошо связывают воду, удерживая жидкость в крови, в межклеточном пространстве и внутри клеток.
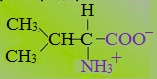
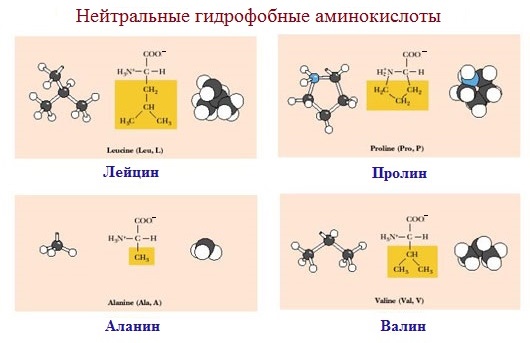
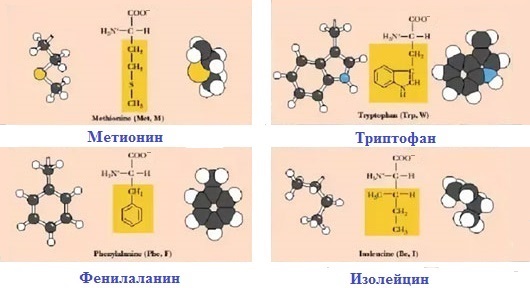
1. Неполярные (гидрофобные)
К неполярным (гидрофобным) относятся аминокислоты с неполярными R-группами и одна серусодержащая аминокислота:
— алифатические: аланин, валин, лейцин, изолейцин
— ароматические: фенилаланин, триптофан.
— серусодержащие: метионин
— иминокислота: пролин.
2. Полярные незаряженные
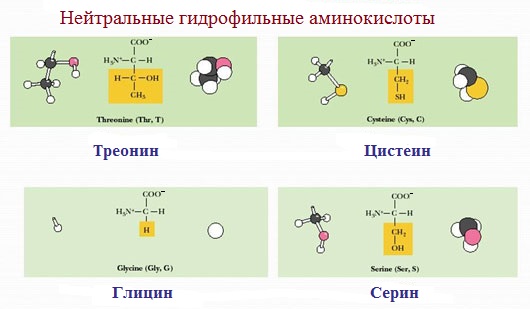
Полярные незаряженные аминокислоты по сравнению с неполярными лучше растворяются в воде, более гидрофильны, так как их функциональные группы образуют водородные связи с молекулами воды.
К ним относятся аминокислоты, содержащие:
— полярную ОН-группу (оксиаминокислоты): серин, треонин и тирозин
— HS-группу: цистеин
— амидную группу: глутамин, аспарагин
— и глицин (R-группа глицина, представленная одним атомом водорода, слишком мала, чтобы компенсировать сильную полярность a-аминогруппы и a-карбоксильной группы).
3. Заряженные отрицательно при рН-7 (кислые)
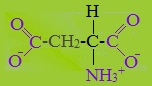
Аспарагиновая и глутаминовая кислоты относятся к отрицательно заряженным аминокислотам.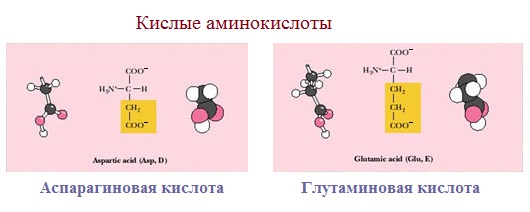
Они содержат по две карбоксильные и по одной аминогруппе, поэтому в ионизированном состоянии их молекулы будут иметь суммарный отрицательный заряд:
4. Заряженные положительно при рН-7 (основные)
К положительно заряженным аминокислотам принадлежат лизин, гистидин и аргинин.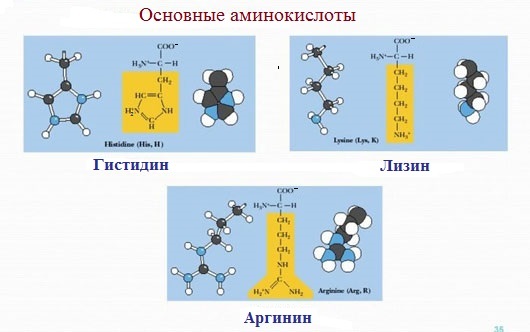
В ионизированном виде они имеют суммарный положительный заряд:
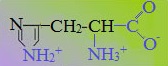
В зависимости от характера радикалов природные аминокислоты также подразделяются на нейтральные, кислые и основные. К нейтральным относятся неполярные и полярные незаряженные, к кислым – отрицательно заряженные, к основным – положительно заряженные.
IV. Классификация по кислотно-основным свойствам
В зависимости от количества функциональных групп различают кислые, нейтральные и основные аминокислоты.
Основные
Аминокислоты, в которых число аминогрупп превышает число карбоксильных групп, называют основными аминокислотами: лизин, аргинин, гистидин:
Кислые
Если в аминокислотах имеется избыток кислотных групп, их называют кислыми аминокислотами: аспарагиновая и глутаминовая кислоты:
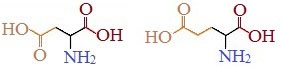
Все остальные аминокислоты относятся к нейтральным.
V. По числу функциональных групп
Аминокислоты по числу функциональных групп можно разделить моноаминомонокарбоновые, моноаминодикарбоновые, диаминомонокарбоновые:

VI.Биологическая классификация (по способности синтезироваться в организме человека и животных)
Заменимые аминокислоты – десять из 20 аминокислот, входящих в состав белков, могут синтезироваться в организме человека. К ним относятся: глицин (гликокол), аланин, серин, цистеин, тирозин, аспарагиновая и глутаминовая кислоты, аспарагин, глутамин, пролин.
Незаменимые аминокислоты (8 аминокислот) – не могут синтезироваться в организме человека и животных и должны поступать в организм в составе белковой пищи.
Абсолютно незаменимых аминокислот восемь: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан.
Незаменимые аминокислоты входят часто в состав пищевых добавок, используются в качестве лекарственных препаратов.
Условно незаменимые (2 аминокислоты) — синтезируются в организме, но в недостаточном количестве, поэтому частично должны поступать с пищей. Такими аминокислотами являются гистидин, аргинин.
Для детей также незаменимыми являются гистидин и аргинин.

Для человека одинаково важны оба типа аминокислот: и заменимые, и незаменимые. Большая часть аминокислот идет на построение собственных белков организма, но без незаменимых аминокислот организм существовать не сможет.
При недостатке каких-либо аминокислот в организме человека в течение непродолжительного времени могут разрушаться белки соединительной ткани, крови, печени и мышц, а полученный из них «строительный материал» — аминокислоты идут на поддержание нормальной работы наиболее важных органов — сердца и мозга.
Дефицит аминокислот приводит к ухудшению аппетита, задержке роста и развития, жировой дистрофии печени и другим тяжелым нарушениям.
При этом наблюдается снижение аппетита, ухудшение состояния кожи, выпадение волос, мышечная слабость, быстрая утомляемость, снижение иммунитета, анемия.
Избыток аминокислот может вызвать развитие тяжелых заболеваний, особенно у детей и в юношеском возрасте. Наиболее токсичными являются метионин (провоцирует риск развития инфаркта и инсульта), тирозин (может спровоцировать развитие артериальной гипертонии, привести к нарушению работы щитовидной железы) и гистидин (может способствовать возникновению дефицита меди в организме и привести к заболеваниям суставов, ранней седине, тяжелым анемиям).
В условиях нормального функционирования организма, когда присутствует достаточное количество витаминов (В6, В12, фолиевой кислоты) и антиоксидантов (витамины А, Е, С и селен), избыток аминокислот не наносит вред организму.
Продукты с повышенным содержанием отдельных незаменимых аминокислот
Качество некоторых пищевых белков относительно белков женского молока
Аминокислоты
Источник
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 7 июня 2020; проверки требуют 3 правки.
Аминокисло́ты (аминокарбо́новые кисло́ты; АМК) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы. Основные химические элементы аминокислот — это углерод (C), водород (H), кислород (O) и азот (N), хотя другие элементы также встречаются в радикале определенных аминокислот. Известны около 500 встречающихся в природе аминокислот (хотя только 20 используются в генетическом коде).
[1]
Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминогруппы.
История[править | править код]
Большинство из около 500 известных аминокислот были открыты после 1953 года, в том числе во время поиска новых антибиотиков в среде микроорганизмов, грибов, семян, растений, фруктов и жидкостях животных. Примерно 240 из них встречаются в природе в свободном виде, а остальные только как промежуточные элементы обмена веществ.[1]
Открытие аминокислот в составе белков[править | править код]
| Аминокислота | Аббревиатура | Год | Источник | Впервые выделен[2] |
|---|---|---|---|---|
| Глицин | Gly, G | 1820 | Желатин | А. Браконно |
| Лейцин | Leu, L | 1820 | Мышечные волокна | А. Браконно |
| Тирозин | Tyr, Y | 1848 | Казеин | Ю. фон Либих |
| Серин | Ser, S | 1865 | Шёлк | Э. Крамер |
| Глутаминовая кислота | Glu, E | 1866 | Растительные белки | Г. Риттхаузен[de] |
| Глутамин | Gln, Q | |||
| Аспарагиновая кислота | Asp, D | 1868 | Конглутин, легумин (ростки спаржи) | Г. Риттхаузен[en] |
| Аспарагин | Asn, N | 1806 | Сок спаржи | Л.-Н. Воклен и П. Ж. Робике |
| Фенилаланин | Phe, F | 1881 | Ростки люпина | Э. Шульце, Й. Барбьери |
| Аланин | Ala, A | 1888 | Фиброин шёлка | А. Штреккер, Т. Вейль |
| Лизин | Lys, K | 1889 | Казеин | Э. Дрексель |
| Аргинин | Arg, R | 1895 | Вещество рога | С. Гедин |
| Гистидин | His, H | 1896 | Стурин, гистоны | А. Коссель[3], С. Гедин |
| Цистеин | Cys, C | 1899 | Вещество рога | К. Мёрнер |
| Валин | Val, V | 1901 | Казеин | Э. Фишер |
| Пролин | Pro, P | 1901 | Казеин | Э. Фишер |
| Гидроксипролин | Hyp, hP | 1902 | Желатин | Э. Фишер |
| Триптофан | Trp, W | 1902 | Казеин | Ф. Хопкинс, Д. Кол |
| Изолейцин | Ile, I | 1904 | Фибрин | Ф. Эрлих |
| Метионин | Met, M | 1922 | Казеин | Д. Мёллер |
| Треонин | Thr, T | 1925 | Белки овса | С. Шрайвер и другие |
| Гидроксилизин | Hyl, hK | 1925 | Белки рыб | С. Шрайвер и другие |
Жирным шрифтом выделены незаменимые аминокислоты.
Физические свойства[править | править код]
По физическим свойствам аминокислоты резко отличаются от соответствующих кислот и оснований. Все они кристаллические вещества, лучше растворяются в воде, чем в органических растворителях, имеют достаточно высокие температуры плавления; многие из них имеют сладкий вкус. Эти свойства отчётливо указывают на солеобразный характер этих соединений. Особенности физических и химических свойств аминокислот обусловлены их строением — присутствием одновременно двух противоположных по свойствам функциональных групп: кислотной и основной.
Общие химические свойства[править | править код]
Все аминокислоты — амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы —COOH, так и основные свойства, обусловленные аминогруппой —NH2. Аминокислоты взаимодействуют с кислотами и щелочами:
NH2 —CH2 —COOH + HCl → HCl • NH2 —CH2 —COOH (Хлороводородная соль глицина)
NH2 —CH2 —COOH + NaOH → H2O + NH2 —CH2 —COONa (натриевая соль глицина)
Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов, то есть находятся в состоянии внутренних солей.
NH2 —CH2COOH N+H3 —CH2COO-
Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.
Этерификация:
NH2 —CH2 —COOH + CH3OH → H2O + NH2 —CH2 —COOCH3 (метиловый эфир глицина)
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона.
Реакция образования пептидов:
HOOC —CH2 —NH —H + HOOC —CH2 —NH2→ HOOC —CH2 —NH —CO —CH2 —NH2 + H2O
Изоэлектрической точкой аминокислоты называют значение pH, при котором максимальная доля молекул аминокислоты обладает нулевым зарядом. При таком pH аминокислота наименее подвижна в электрическом поле, и данное свойство можно использовать для разделения аминокислот, а также белков и пептидов.
Цвиттер-ионом называют молекулу аминокислоты, в которой аминогруппа представлена в виде -NH3+, а карбоксигруппа — в виде -COO−. Такая молекула обладает значительным дипольным моментом при нулевом суммарном заряде. Именно из таких молекул построены кристаллы большинства аминокислот.
Некоторые аминокислоты имеют несколько аминогрупп и карбоксильных групп. Для этих аминокислот трудно говорить о каком-то конкретном цвиттер-ионе.
Получение[править | править код]
Большинство аминокислот можно получить в ходе гидролиза белков или как результат химических реакций:
CH3COOH + Cl2 + (катализатор) → CH2ClCOOH + HCl; CH2ClCOOH + 2NH3→ NH2 —CH2COOH + NH4Cl
Оптическая изомерия[править | править код]
Все входящие в состав живых организмов α-аминокислоты, кроме глицина, содержат асимметрический атом углерода (треонин и изолейцин содержат два асимметрических атома) и обладают оптической активностью. Почти все встречающиеся в природе α-аминокислоты имеют L-конфигурацию, и лишь L-аминокислоты включаются в состав белка, синтезируемых на рибосомах.
D-Аминокислоты в живых организмах[править | править код]
Аспарагиновые остатки в метаболически неактивных структурных белках претерпевают медленную самопроизвольную неферментативную рацемизацию: в белках дентина и эмали зубов L-аспартат переходит в D-форму со скоростью ~0,1 % в год[4], что может быть использовано для определения возраста млекопитающих. Рацемизация аспартата также отмечена при старении коллагена; предполагается, что такая рацемизация специфична для аспарагиновой кислоты и протекает за счёт образования сукцинимидного кольца при внутримолекулярном ацилировании атома азота пептидной связи свободной карбоксильной группой аспарагиновой кислоты[5].
С развитием следового аминокислотного анализа D-аминокислоты были обнаружены сначала в составе клеточных стенок некоторых бактерий (1966), а затем и в тканях высших организмов.[6] Так, D-аспартат и D-метионин предположительно являются нейромедиаторами у млекопитающих[7].
В состав некоторых пептидов входят D-аминокислоты, образующиеся при посттрансляционной модификации. Например, D-метионин и D-аланин входят в состав опиоидных гептапептидов кожи южноамериканских амфибий филломедуз (дерморфина, дермэнкефалина и делторфинов). Наличие D-аминокислот определяет высокую биологическую активность этих пептидов как анальгетиков.
Сходным образом образуются пептидные антибиотики бактериального происхождения, действующие против грамположительных бактерий — низин, субтилин и эпидермин.[8]
Гораздо чаще D-аминокислоты входят в состав пептидов и их производных, образующихся путём нерибосомного синтеза в клетках грибов и бактерий. Видимо, в этом случае исходным материалом для синтеза служат также L-аминокислоты, которые изомеризуются одной из субъединиц ферментного комплекса, осуществляющего синтез пептида.
Протеиногенные аминокислоты[править | править код]
Основная статья: Белки
В процессе биосинтеза белка в полипептидную цепь включаются 20 α-аминокислот, кодируемых генетическим кодом. Помимо этих аминокислот, называемых протеиногенными, или стандартными, в некоторых белках присутствуют специфические нестандартные аминокислоты, возникающие из стандартных в процессе посттрансляционных модификаций. В последнее время к протеиногенным аминокислотам иногда причисляют трансляционно включаемые селеноцистеин (Sec, U) и пирролизин (Pyl, O).[9][10] Это так называемые 21-я и 22-я аминокислоты.[11]
Вопрос, почему именно эти 20 аминокислот стали «избранными», остаётся нерешённым[12]. Не совсем ясно, чем эти аминокислоты оказались предпочтительнее других похожих. Например, ключевым промежуточным метаболитом пути биосинтеза треонина, изолейцина и метионина является α-аминокислота гомосерин. Очевидно, что гомосерин — очень древний метаболит, но для треонина, изолейцина и метионина существуют аминоацил-тРНК-синтетазы, тРНК, а для гомосерина — нет.
Структурные формулы 20 протеиногенных аминокислот обычно приводят в виде так называемой таблицы протеиногенных аминокислот:
Классификация[править | править код]
| Аминокислота | 3-буквы[13] | 1-буква[13] | аминокислот | мнемоническое правило[14] | Полярность[15] | радикалу | Mr | Vw (Å3) | pI | шкала гидрофобности[16] | частота в белках (%)[17] |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Глицин | Gly | G | GGU, GGC, GGA, GGG | Glycine | Неполярные | Алифатические | 75,067 | 48 | 6,06 | −0,4 | 7,03 |
| Аланин | Ala | A | GCU, GCC, GCA, GCG | Alanine | Неполярные | Алифатические | 89,094 | 67 | 6,01 | 1,8 | 8,76 |
| Валин | Val | V | GUU, GUC, GUA, GUG | Valine | Неполярные | Алифатические | 117,148 | 105 | 6,00 | 4,2 | 6,73 |
| Изолейцин | Ile | I | AUU, AUC, AUA | Isoleucine | Неполярные | Алифатические | 131,175 | 124 | 6,05 | 4,5 | 5,49 |
| Лейцин | Leu | L | UUA, UUG, CUU, CUC, CUA, CUG | Leucine | Неполярные | Алифатические | 131,175 | 124 | 6,01 | 3,8 | 9,68 |
| Пролин | Pro | P | CCU, CCC, CCA, CCG | Proline | Неполярные | Гетероциклические | 115.132 | 90 | 6,30 | −1,6 | 5,02 |
| Серин | Ser | S | UCU, UCC, UCA, UCG, AGU, AGC | Serine | Полярные | Оксимоноаминокарбоновые | 105,093 | 73 | 5,68 | −0,8 | 7,14 |
| Треонин | Thr | T | ACU, ACC, ACA, ACG | Threonine | Полярные | Оксимоноаминокарбоновые | 119,119 | 93 | 5,60 | −0,7 | 5,53 |
| Цистеин | Cys | C | UGU, UGC | Cysteine | Полярные | Серосодержащие | 121,154 | 86 | 5,05 | 2,5 | 1,38 |
| Метионин | Met | M | AUG | Methionine | Неполярные | Серосодержащие | 149,208 | 124 | 5,74 | 1,9 | 2,32 |
| Аспарагиновая кислота | Asp | D | GAU, GAC | asparDic acid | Полярные заряженные отрицательно | заряженные отрицательно | 133,104 | 91 | 2,85 | −3,5 | 5,49 |
| Аспарагин | Asn | N | AAU, AAC | asparagiNe | Полярные | Амиды | 132,119 | 96 | 5,41 | −3,5 | 3,93 |
| Глутаминовая кислота | Glu | E | GAA, GAG | gluEtamic acid | Полярные заряженные отрицательно | заряженные отрицательно | 147,131 | 109 | 3,15 | −3,5 | 6,32 |
| Глутамин | Gln | Q | CAA, CAG | Q-tamine | Полярные | Амиды | 146,146 | 114 | 5,65 | −3,5 | 3,9 |
| Лизин | Lys | K | AAA, AAG | before L | Полярные | заряженные положительно | 146,189 | 135 | 9,60 | −3,9 | 5,19 |
| Аргинин | Arg | R | CGU, CGC, CGA, CGG, AGA, AGG | aRginine | Полярные | заряженные положительно | 174.203 | 148 | 10,76 | −4,5 | 5,78 |
| Гистидин | His | H | CAU, CAC | Histidine | Полярные заряженные положительно | Гетероциклические | 155,156 | 118 | 7,60 | −3,2 | 2,26 |
| Фенилаланин | Phe | F | UUU, UUC | Fenylalanine | Неполярные | Ароматические | 165,192 | 135 | 5,49 | 2,8 | 3,87 |
| Тирозин | Tyr | Y | UAU, UAC | tYrosine | Полярные | Ароматические | 181,191 | 141 | 5,64 | −1,3 | 2,91 |
| Триптофан | Trp | W | UGG | tWo rings | Неполярные | Ароматические, Гетероциклические | 204,228 | 163 | 5,89 | −0,9 | 6,73 |
По радикалу[править | править код]
- Неполярные: глицин, аланин, валин, изолейцин, лейцин, пролин
- Полярные незаряженные (заряды скомпенсированы) при pH=7: серин, треонин, цистеин, метионин, аспарагин, глутамин
- Ароматические: фенилаланин, триптофан, тирозин
- Полярные заряженные отрицательно при pH=7: аспартат, глутамат
- Полярные заряженные положительно при pH=7: лизин, аргинин, гистидин[15]
По функциональным группам[править | править код]
- Алифатические
- Моноаминомонокарбоновые: глицин, аланин, валин, изолейцин, лейцин
<
