Как определить у какого оксида сильнее выражены кислотные свойства

Оксиды – сложные вещества, состоящие из двух элементов, один из которых кислород. В названиях оксидов сначала указывают слово оксид, затем название второго элемента, которым он образован. Какие особенности имеют кислотные оксиды, и чем они отличаются от других видов оксидов?

Классификация оксидов
Оксиды делятся на солеобразующие и несолеобразующие. Уже по названию ясно, что несолеобразующие не образуют солей. Таких оксидов немного : это вода H2 O, фторид кислорода OF2 (если условно его считать оксидом), угарный газ, или оксид углерода (II), монооксид углерода CO; оксиды азота (I) и (II): N2 O (оксид диазота, веселящий газ) и NO (монооксид азота).
Солеобразующие оксиды образуют соли при взаимодействии с кислотами или щелочами. В качестве гидроксидов им соответствуют основания, амфотерные основания и кислородосодержащие кислоты. Соответственно они называются основными оксидами (например, CaO), амфотерными оксидами (Al2 O3 ) и кислотными оксидами, или ангидридами кислот (CO2).
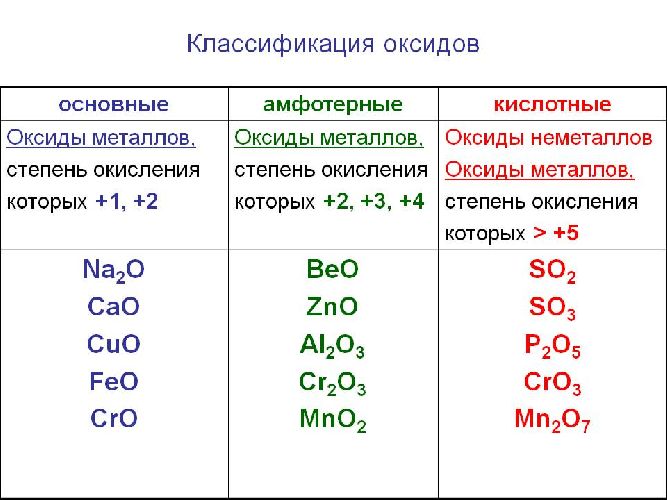
Рис. 1. Виды оксидов.
Часто перед учащимися встает вопрос, как отличить основной оксид от кислотного. Прежде всего необходимо обратить внимание на второй элемент рядом с кислородом. Кислотные оксиды – содержат неметалл или переходный металл (CO2 , SO3 , P2 O5 ) основные оксиды – содержат металл (Na2 O, FeO, CuO).
Основные свойства кислотных оксидов
Кислотные оксиды (ангидриды) – вещества, которые проявляют кислотные свойства и образуют кислородосодержащие кислоты. Следовательно, кислотным оксидам соответствуют кислоты. Например, кислотным оксидам SO2 ,SO3 соответствуют кислоты H2 SO3 и H2 SO4 .
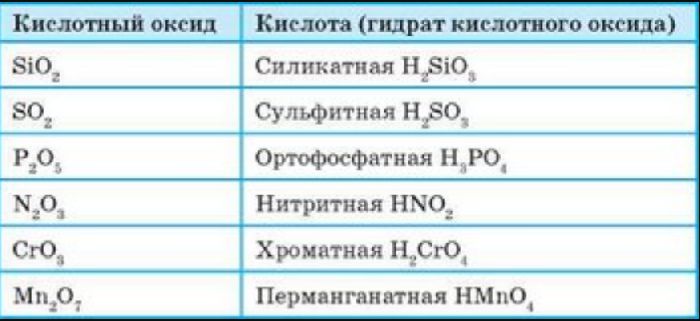
Рис. 2. Кислотные оксиды с соответствующими кислотами.
Кислотные оксиды, образуемые неметаллами и металлами с переменной валентностью в высшей степени окисления (например, SO3 , Мn2 O7 ), реагируют с основными оксидами и щелочами, образуя соли:
SO3 (кислотный оксид)+CaO (основной оксид)=СaSO4 (соль);
Типичными реакциями являются взаимодействие кислотных оксидов с основаниями в результате чего образуется соль и вода:
Mn2 O7 (кислотный оксид)+2KOH (щелочь)=2KMnO4 (соль)+H2O (вода)
Все кислотные оксиды, кроме диоксида кремния SiO2 (кремниевый ангидрид, кремнезем), реагируют с водой, образуя кислоты:
SO3 (кислотный оксид)+H2O (вода)=H2SO4 (кислота)
Кислотные оксиды образуются при взаимодействии с кислородом простых и сложных веществ (S+O2 =SO2 ), либо при разложении в результате нагревания сложных веществ, содержащих кислород, – кислот, нерастворимых оснований, солей (H2 SiO3 =SiO2 +H2 O).
Список кислотных оксидов:
| Название кислотного оксида | Формула кислотного оксида | Свойства кислотного оксида |
| Оксид серы (IV) | SO2 | бесцветный токсичный газ с резким запахом |
| Оксид серы (VI) | SO3 | легколетучая безцветная токсичная жидкость |
| Оксид углерода (IV) | CO2 | бесцветный газ без запаха |
| Оксид кремния (IV) | SiO2 | бесцветные кристаллы, обладающие прочностью |
| Оксид фосфора (V) | P2 O5 | белый легковозгораемый порошок с неприятным запахом |
| Оксид азота (V) | N2 O5 | вещество, состоящее из бесцветных летучих кристаллов |
| Оксид хлора (VII) | Cl2 O7 | бесцветная маслянистая токсичная жидкость |
| Оксид марганца (VII) | Mn2 O7 | жидкость с металлическим блеском, являющаяся сильным окислителем. |

Рис. 3. Примеры кислотные оксиды.
Что мы узнали?
Кислотные оксиды относятся к солеобразующим оксидам и образуются с помощью кислот. Кислотные оксиды вступают в реакции с основаниями и водой, а их образование происходит при нагревании и разложении сложных веществ.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
-

Polina Malchikova
9/10

Дима Кулагин
10/10

Сергей Ефремов
9/10

Артём Макушенко
10/10

Наталия Григорьева
10/10

Данила Волков
9/10
Оценка доклада
Средняя оценка: 4.5. Всего получено оценок: 902.
Источник
Подробно про оксиды, их классификацию и способы получения можно прочитать здесь.
1. Взаимодействие с водой. С водой способны реагировать только основные оксиды, которым соответствуют растворимые гидроксиды (щелочи). Щелочи образуют щелочные металлы (литий, натрий, калий, рубидий и цезий) и щелочно-земельные (кальций, стронций, барий). Оксиды остальных металлов с водой химически не реагируют. Оксид магния реагирует с водой при кипячении.
CaO + H2O → Ca(OH)2
CuO + H2O ≠ (реакция не идет, т.к. Cu(OH)2 — нерастворимый гидроксид)
2. Взаимодействие с кислотными оксидами и кислотами. При взаимодействии основным оксидов с кислотами образуется соль этой кислоты и вода. При взаимодействии основного оксида и кислотного образуется соль:
основный оксид + кислота = соль + вода
основный оксид + кислотный оксид = соль
При взаимодействии основных оксидов с кислотами и их оксидами работает правило:
Хотя бы одному из реагентов должен соответствовать сильный гидроксид (щелочь или сильная кислота).
Иными словами, основные оксиды, которым соответствуют щелочи, реагируют со всеми кислотными оксидами и их кислотами. Основные оксиды, которым соответствуют нерастворимые гидроксиды, реагируют только с сильными кислотами и их оксидами (N2O5, NO2, SO3 и т.д.).
| Основные оксиды, которым соответствуют щелочи | Основные оксиды, которым соответствуют нерастворимые основания |
| Реагируют со всеми кислотами и их оксидами | Реагируют только с сильными кислотами и их оксидами |
| Na2O + SO2 → Na2SO3 | CuO + N2O5 → Cu(NO3)2 |
3. Взаимодействие с амфотерными оксидами и гидроксидами.
При взаимодействии основных оксидов с амфотерными образуются соли:
основный оксид + амфотерный оксид = соль
С амфотерными оксидами при сплавлении взаимодействуют только основные оксиды, которым соответствуют щелочи. При этом образуется соль. Металл в соли берется из более основного оксида, кислотный остаток — из более кислотного. В данном случае амфотерный оксид образует кислотный остаток.
K2O + Al2O3 → 2KAlO2
CuO + Al2O3 ≠ (реакция не идет, т.к. Cu(OH)2 — нерастворимый гидроксид)
(чтобы определить кислотный остаток, к формуле амфотерного или кислотного оксида добавляем молекулу воды: Al2O3 + H2O = H2Al2O4 и делим получившиеся индексы пополам, если степень окисления элемента нечетная: HAlO2. Получается алюминат-ион AlO2—. Заряд иона легко определить по числу присоединенных атомов водорода — если атом водорода 1, то заряд аниона будет -1, если 2 водорода, то -2 и т.д.).
Амфотерные гидроксиды при нагревании разлагаются, поэтому реагировать с основными оксидами фактически не могут.
4. Взаимодействие оксидов металлов с восстановителями.
При оценке окислительно-восстановительной активности металлов и их ионов можно использовать электрохимический ряд напряжений металлов:

Восстановительные свойства (способность отдавать электроны) у простых веществ-металлов здесь увеличиваются справа налево, окислительные свойства ионов металлов — увеличиваются наоборот, слева направо. При этом некоторые ионы металлов в промежуточных степенях окисления могут проявлять также восстановительные свойства (например ион Fe2+ можно окислить до иона Fe3+).
Более подробно про окислительно-восстановительные реакции можно прочитать здесь.
Таким образом, ионы некоторых металлов — окислители (чем правее в ряду напряжений, тем сильнее). При взаимодействии с восстановителями металлы переходят в степень окисления 0.
4.1. Восстановление углем или угарным газом.
Углерод (уголь) восстанавливает из оксидов до простых веществ только металлы, расположенные в ряду активности после алюминия. Реакция протекает только при нагревании.
FeO + C = Fe + CO

Активные металлы, расположенные в ряду активности левее алюминия, активно взаимодействуют с углеродом, поэтому при взаимодействии их оксидов с углеродом образуются карбиды и угарный газ:
CaO + 3C = CaC2 + CO
Угарный газ также восстанавливает из оксидов только металлы, расположенные после алюминия в электрохимическом ряду:
Fe2O3 + CO = Al2O3 + CO2
CuO + CO = Cu + CO2

4.2. Восстановление водородом.
Водород восстанавливает из оксидов только металлы, расположенные в ряду активности правее алюминия. Реакция с водородом протекает только в жестких условиях – под давлением и при нагревании.
CuO + H2 = Cu + H2O

4.3. Восстановление более активными металлами (в расплаве или растворе, в зависимости от металла)
При этом более активные металлы вытесняют менее активные. То есть добавляемый к оксиду металл должен быть расположен левее в ряду активности, чем металл из оксида. Реакции, как правило, протекают при нагревании.
Например, оксид цинка взаимодействует с алюминием:
3ZnO + 2Al = Al2O3 + 3Zn
но не взаимодействует с медью:
ZnO + Cu ≠
Восстановление металлов из оксидов с помощью других металлов — это очень распространенный процесс. Часто для восстановления металлов применяют алюминий и магний. А вот щелочные металлы для этого не очень подходят – они слишком химически активны, что создает сложности при работе с ними.
Например, цезий взрывается на воздухе.
Алюмотермия – это восстановление металлов из оксидов алюминием.
Например: алюминий восстанавливает оксид меди (II) из оксида:
3CuO + 2Al = Al2O3 + 3Cu
Магниетермия – это восстановление металлов из оксидов магнием.
CuO + Mg = Cu + MgO

Железо можно вытеснить из оксида с помощью алюминия:
2Fe2O3 + 4Al → 4Fe + 2Al2O3
При алюмотермии образуется очень чистый, свободный от примесей углерода металл.
4.4. Восстановление аммиаком.
Аммиаком можно восстанавливать только оксиды неактивных металлов. Реакция протекает только при высокой температуре.
Например, аммиак восстанавливает оксид меди (II):
3CuO + 2NH3 = 3Cu + 3H2O + N2
5. Взаимодействие оксидов металлов с окислителями.
Под действием окислителей некоторые основные оксиды (в которых металлы могут повышать степень окисления, например Fe2+, Cr2+, Mn2+ и др.) могут выступать в качестве восстановителей.
Например, оксид железа (II) можно окислить кислородом до оксида железа (III):
4FeO + O2 = 2Fe2O3
Источник
Кислотными свойствами называют те, которые наиболее сильно проявляются в данной среде. Их существует целый ряд. Необходимо уметь определять кислотные свойства спиртов и других соединений не только для выявления содержания в них соответствующей среды. Это также важно для распознавания изучаемого вещества.

Существует множество тестов на наличие кислотных свойств. Наиболее элементарный – погружение в вещество индикатора – лакмусовой бумаги, которая реагирует на содержание водорода, розовея или краснея. Причем более насыщенный цвет демонстрирует более сильную кислоту. И наоборот.
Кислотные свойства усиливаются вместе с увеличением радиусов отрицательных ионов и, следовательно, атома. Это обеспечивает более легкое отщепление частиц водорода. Это качество является характерным признаком сильных кислот.
Существуют наиболее характерные кислотные свойства. К ним относятся:
– диссоциация (отщепление катиона водорода);
– разложение (образование кислотного оксида и воды под воздействием температуры и кислорода);
– взаимодействие с гидроксидами (в результате которого образуются вода и соль);
– взаимодействие с оксидами (в результате также образуются соль и вода);
– взаимодействие с металлами, предшествующими водороду в ряду активности (образуется соль и вода, иногда с выделением газа);
– взаимодействие с солями (только в том случае, если кислота сильнее той, которой образована соль).

Часто химикам приходится самостоятельно получать кислоты. Для их выведения существует два способа. Один из них – смешение кислотного оксида с водой. Этот способ используется наиболее часто. А второй – взаимодействие сильной кислоты с солью более слабой. Его используют несколько реже.
Известно, что кислотные свойства проявляются и у многих органических веществ. Они могут быть выражены сильнее или слабее в зависимости от строения ядер атомов. К примеру, кислотные свойства спиртов проявляются в способности отщеплять катион водорода при взаимодействии с щелочами и металлами.
Алкоголяты – соли спиртов – способны гидролизоваться под действием воды и выделять спирт с гидроксидом металла. Это доказывает, что кислотные свойства этих веществ слабее, чем у воды. Следовательно, среда выражена в них сильнее.
Кислотные свойства фенола гораздо сильнее в связи с повышенной полярностью ОН-соединения. Поэтому данное вещество может реагировать также с гидроксидами щелочноземельных и щелочных металлов. В результате образуются соли – феноляты. Чтобы выявить фенол, наиболее эффективно использовать качественную реакцию с хлоридом железа (III), в которой вещество приобретает сине-фиолетовую окраску.

Итак, кислотные свойства в различных соединениях проявляются одинаково, но с разной интенсивностью, что зависит от строения ядер и полярности водородных связей. Они помогают определять среду вещества и его состав. Наряду с данными свойствами, существуют также и основные, которые усиливаются с ослаблением первых.
Все эти характеристики проявляются в большинстве сложных веществ и составляют важную часть окружающего нас мира. Ведь именно за их счет проходят многие процессы не только в природе, но и в живых организмов. Поэтому кислотные свойства крайне важны, без них была бы невозможна жизнь на земле.
Источник
Оксиды — это неорганические соединения, состоящие из двух химических элементов, одним из которых является кислород в степени окисления -2. Единственным элементом, не образующим оксид, является фтор, который в соединении с кислородом образует фторид кислорода. Это связано с тем, что фтор является более электроотрицательным элементом, чем кислород.
![]() Данный класс соединений является очень распространенным. Каждый день человек встречается с разнообразными оксидами в повседневной жизни. Вода, песок, выдыхаемый нами углекислый газ, выхлопы автомобилей, ржавчина — все это примеры оксидов.
Данный класс соединений является очень распространенным. Каждый день человек встречается с разнообразными оксидами в повседневной жизни. Вода, песок, выдыхаемый нами углекислый газ, выхлопы автомобилей, ржавчина — все это примеры оксидов.
Классификация оксидов
Все оксиды, по способности образовать соли, можно разделить на две группы:
- Солеобразующие оксиды (CO2, N2O5,Na2O, SO3 и т. д.)
- Несолеобразующие оксиды(CO, N2O,SiO, NO и т. д.)
В свою очередь, солеобразующие оксиды подразделяют на 3 группы:
- Основные оксиды — (Оксиды металлов — Na2O, CaO, CuO и т д)
- Кислотные оксиды — (Оксиды неметаллов, а так же оксиды металлов в степени окисления V-VII — Mn2O7,CO2, N2O5, SO2, SO3 и т д)
- Амфотерные оксиды (Оксиды металлов со степенью окисления III-IV а так же ZnO, BeO, SnO, PbO)
Данная классификация основана на проявлении оксидами определенных химических свойств. Так, основным оксидам соответствуют основания, а кислотным оксидам — кислоты. Кислотные оксиды реагируют с основными оксидами с образованием соответствующей соли, как если бы реагировали основание и кислота, соответствующие данным оксидам: Аналогично, амфотерным оксидам соответствуют амфотерные основания, которые могут проявлять как кислотные, так и основные свойства:
Аналогично, амфотерным оксидам соответствуют амфотерные основания, которые могут проявлять как кислотные, так и основные свойства: Химические элементы проявляющие разную степень окисления, могут образовывать различные оксиды. Чтобы как то различать оксиды таких элементов, после названия оксиды, в скобках указывается валентность.
Химические элементы проявляющие разную степень окисления, могут образовывать различные оксиды. Чтобы как то различать оксиды таких элементов, после названия оксиды, в скобках указывается валентность.
CO2 – оксид углерода (IV)
N2O3 – оксид азота (III)
Физические свойства оксидов
Оксиды весьма разнообразны по своим физическим свойствам. Они могут быть как жидкостями (Н2О), так и газами (СО2, SO3) или твёрдыми веществами (Al2O3, Fe2O3). Приэтом оснОвные оксиды, как правило, твёрдые вещества. Окраску оксиды также имеют самую разнообразную — от бесцветной (Н2О, СО) и белой (ZnO, TiO2) до зелёной (Cr2O3) и даже чёрной (CuO).
Химические свойства оксидов
Основные оксиды
Некоторые оксиды реагируют с водой с образованием соответствующих гидроксидов (оснований):![]() Основные оксиды реагируют с кислотными оксидами с образованием солей:
Основные оксиды реагируют с кислотными оксидами с образованием солей:![]() Аналогично реагируют и с кислотами, но с выделением воды:
Аналогично реагируют и с кислотами, но с выделением воды:![]() Оксиды металлов, менее активных чем алюминий, могут восстанавливаться до металлов:
Оксиды металлов, менее активных чем алюминий, могут восстанавливаться до металлов:![]()
Кислотные оксиды
Кислотные оксиды в реакции с водой образуют кислоты:![]() Некоторые оксиды (например оксид кремния SiO2) не взаимодействуют с водой, поэтому кислоты получают другими путями.
Некоторые оксиды (например оксид кремния SiO2) не взаимодействуют с водой, поэтому кислоты получают другими путями.
Кислотные оксиды взаимодействуют с основными оксидами, образую соли:![]() Таким же образом, с образование солей, кислотные оксиды реагируют с основаниями:
Таким же образом, с образование солей, кислотные оксиды реагируют с основаниями:![]() Если данному оксиду соответствует многоосновная кислота, то так же может образоваться кислая соль:
Если данному оксиду соответствует многоосновная кислота, то так же может образоваться кислая соль:![]() Нелетучие кислотные оксиды могут замещать в солях летучие оксиды:
Нелетучие кислотные оксиды могут замещать в солях летучие оксиды:![]()
Амфотерные оксиды
Как уже говорилось ранее, амфотерные оксиды, в зависимости от условий, могут проявлять как кислотные, так и основные свойства. Так они выступают в качестве основных оксидов в реакциях с кислотами или кислотными оксидами, с образованием солей: ![]() И в реакциях с основаниями или основными оксидами проявляют кислотные свойства:
И в реакциях с основаниями или основными оксидами проявляют кислотные свойства:
Получение оксидов
Оксиды можно получить самыми разнообразными способами, мы приведем основные из них.
Большинство оксидов можно получить непосредственным взаимодействием кислорода с химических элементом:  При обжиге или горении различных бинарных соединений:
При обжиге или горении различных бинарных соединений:![]() Термическое разложение солей, кислот и оснований :
Термическое разложение солей, кислот и оснований : Взаимодействие некоторых металлов с водой:
Взаимодействие некоторых металлов с водой:![]()
Применение оксидов
 Оксиды крайне распространены по всему земному шару и находят применение как в быту, так и в промышленности. Самый важный оксид — оксид водорода, вода — сделал возможной жизнь на Земле. Оксид серы SO3 используют для получения серной кислоты, а также для обработки пищевых продуктов — так увеличивают срок хранения, например, фруктов.
Оксиды крайне распространены по всему земному шару и находят применение как в быту, так и в промышленности. Самый важный оксид — оксид водорода, вода — сделал возможной жизнь на Земле. Оксид серы SO3 используют для получения серной кислоты, а также для обработки пищевых продуктов — так увеличивают срок хранения, например, фруктов.
Оксиды железа используют для получения красок, производства электродов, хотя больше всего оксидов железа восстанавливают до металлического железа в металлургии.
Оксид кальция, также известный как негашеная известь, применяют в строительстве. Оксиды цинка и титана имеют белый цвет и нерастворимы в воде, потому стали хорошим материалом для производства красок — белил.
Оксид кремния SiO2 является основным компонентом стекла. Оксид хрома Cr2O3 применяют для производства цветных зелёных стекол и керамики, а за счёт высоких прочностных свойств — для полировки изделий (в виде пасты ГОИ).
Оксид углерода CO2, который выделяют при дыхании все живые организмы, используется для пожаротушения, а также, в виде сухого льда, для охлаждения чего-либо.
Источник

На сильные и слабые эти субстанции подразделяются в зависимости от возможности отдавать ионы водорода во время взаимодействия с металлами.
Общие свойства
Все кислоты содержат атомы водорода, которые способны вступать в реакцию. Таким образом, кислота представляет собой сложное вещество, молекулы которого состоят из разного количества атомов водорода и кислотного остатка. Эти соединения обладают кислым и зачастую слегка металлическим вкусом. При контакте с ними индикаторы приобретают другой оттенок вплоть до кардинальной смены цвета.
Химические свойства, являющиеся общими для всех кислот:

- Все вещества, содержащие кислород, в процессе разложения образуют воду и кислотный оксид.
- Бескислородные соединения распадаются на простые элементы.
- Окислители вступают в реакцию со всеми расположенными слева от H металлами из ряда активности.
- Кислоты взаимодействуют с солями, образованными более слабым соединением.
Физические свойства веществ могут кардинально отличаться. Например, одни из них имеют запах, у других он отсутствует совершенно.
Кислоты могут быть жидкими, газообразными и твёрдыми. К твёрдым соединениям относятся, например, C2H204 и H3BO3.
Концентрация вещества
Зачастую химикам приходится решать задачи на определение количества чистой кислоты, находящейся в растворе, в процентах. В таких случаях искомым значением является концентрация.
Это величина, позволяющая определять количественный состав жидкого химического вещества. К примеру, для того, чтобы узнать, сколько чистой серной кислоты находится в разбавленном растворе, необходимо небольшое количество смеси налить в мерный стакан, взвесить и определить искомое значение по таблице плотности. Указанная таблица используется при вычислениях, так как плотность неразрывно связана с концентрацией.
Основная классификация
Чаще всего кислые вещества разделяют на кислородосодержащие и бескислородные. Состав последних соединений отличается тем, что в них нет кислорода, но есть водород. В связи с этим их названия всегда дополнены словом «водородная». Например, хлороводородная, сероводородная.
Кроме того, кислоты имеют классификацию по количеству атомов водорода.
Так, они подразделяются на следующие типы:
- одноосновные;
- двухосновные;
- трехосновные.
Но также существуют органические кислоты, то есть органические вещества, которые проявляют свойства, присущие кислотным соединениям. Из них наиболее известны уксусная, щавелевая, муравьиная, лимонная, молочная и яблочная.
Все кислые вещества и основания подразделяются на сильные и слабые. Но необходимо понять, что эти понятия никак не связаны с концентрацией соединений. Сила кислоты определяется её способностью вступать в химическую реакцию, отдавая водородные ионы.
Так, вещество считается сильным, если этот процесс проходит легко.
Сильные и слабые реагенты
Если реагент в водном растворе полностью распадается на ионы, то есть диссоциирует, то оно является сильным, поскольку слабые химические соединения никогда не растворяются до конца.

Кроме того, отличить слабую кислоту можно посредством измерения её проводимости. Сильные соединения являются хорошими электролитами. Сильные основания при попадании в воду также распадаются. Следует отметить, что основания также называют гидроксидами или гидроокисями.
Существует специальные перечни слабых и сильных кислот и оснований. Таблица, приведённая ниже, также может использоваться для классификации реагентов.
| Сильная кислота | Слабая кислота | Сильное основание | Слабое основание |
|---|---|---|---|
| HCI соляная или хлороводородная | HF фтороводородная | NaOH гидроокись натрия | Mg(OH)2 гидроокись магния |
| HBr бромоводородная | CH3COOH уксусная | KOH гидроокись калия | Fe(OH)2 гидроокись железа (II) |
| HI йодоводородная | H2SO3 сернистая | Ca(OH)2 гидроокись кальция | Zn(OH)2 гидроокись цинка |
| HNO3 азотная | H2S сероводородная | Ba(OH)2 гидроокись бария | NH4OH гидроокись аммония |
| HClO4 хлорная | HNO2 азотистая | LiOH гидроокись лития | Fe(OH)3 гидроокись железа (III) |
| H2SO4 серная | H2SiO3 кремниевая |
А также следует отметить, что кислородсодержащая угольная (H2CO3) и ортофосфорная (H3PO4) или фосфорная кислоты — слабые. К сильным же необходимо добавить хромовую, которая является средней по силе.
Кроме того, нужно учитывать, что современная химия позволяет учёным создавать новые соединения. В связи с этим список кислот, как сильных, так и слабых, постоянно пополняется.
Химические реакции
При соединении сильной кислоты с таким же основанием получится нейтральный раствор. Произошедшая в этом случае химическая реакция называется нейтрализацией. Если же заменить основание на слабое, то полностью диссоциирует только кислое вещество.

Второй компонент не распадается на ионы полностью.
Слабое основание лишь незначительно вступает в реакцию со слабой кислотой.
Когда кислотное соединение реагирует с сильным основанием, то первый реагент проходит частичную диссоциацию, второй же полностью диссоциирует.
Полученный в результате раствор обладает слабыми свойствами основания.
Водородный показатель
При проведении диссоциирующих реакций важно правильно определить уровень кислотности воды. Для его количественного выражения применяется величина pH, называющаяся силой, весом или потенциалом водорода. Она позволяет измерить активность ионов водорода. Если уровень pH превышает 7, то у вещества присутствуют кислотные свойства, если же этот показатель меньше 7, то свойства являются основными.
Способы определения
Результаты химических реакций, в которых участвует любое вещество, напрямую зависят от уровня его кислотности. А потому химики всегда измеряют этот показатель.
Существует несколько методов определения pH:
- Инструментальный способ. В этом случае применяется pH-метр. Этот прибор трансформирует концентрацию протонов в какой-либо жидкости в электрический сигнал.
- Индикаторы. Это вещества, изменяющие оттенок цвет в зависимости от показателя pH. Использование различных индикаторов позволяет получить довольно точные данные об уровне кислотности.
- Соль. Соль представляет собой соединение ионов, которое полностью диссоциирует в слабом водном растворе. Для определения кислотно-щелочных свойств соляного раствора, прежде всего, нужно установить и изучить свойства ионов, находящиеся в растворе.
Буферный раствор
Буферным раствором называется вещество, отличающееся наличием постоянной концентрации ионов водорода.

При добавлении сильной кислоты или такого же основания в небольших дозах эти растворы сохраняют изначальный уровень кислотности.
Для приготовления такой смеси нужно смешать слабое кислое вещество или основание с соответствующей солью.
При изготовлении буферного раствора необходимо учитывать следующие факторы:
- Интервал уровня кислотности, в котором вещество станет эффективным.
- Ёмкость раствора, то есть какой объём сильного кислотного соединения или основания можно добавить в смесь, не изменив её pH.
- При соединении веществ не должно быть реакций, способных повлиять на состав раствора.
Самые опасные кислотные соединения
На сегодняшний день самой сильной кислотой в мире считается пентафторид сурьмы фтористоводородной кислоты. Её химическая формула — HFSbF5. Не существует точных данных об активности этого соединения, но установлено, что его 55-процентный раствор почти в миллион раз сильнее концентрированной серной кислоты.
Следующим по силе является карборановое кислотное соединение. Это вещество разрешается хранить только в специальной ёмкости. Она также во много раз опаснее серной и растворяет даже стекло.
Ещё одной суперкислотой является плавиковая. Она не имеет цвета и, подобно предыдущему веществу, способна разъедать стекло. Для перевозки этого едкого соединения применяют полиэтилен. Вещество прекрасно вступает в реакцию с большинством металлов, но не взаимодействует с парафином. Соединение токсично, даже его пары опасны для здоровья. Кислота обладает эффектом наркотика.

Самое известное сильное вещество — серная кислота. Из-за больших производственных объёмов некоторые химики считают именно её самой опасной в мире. По мере того как увеличивается концентрация реагента, растёт и его опасность для здоровья человека, хотя даже растворы серного кислотного соединения могут нанести серьёзный вред. Это вещество окисляет металлы и является крайне едким, даже пары реагента очень опасны. При контакте происходит поражение кожи и слизистых оболочек, органов дыхания, а также внутренних органов человека.
Часто используемая в быту муравьиная кислота тоже относится к ядовитым химикатам. Эта ситуация объясняется тем, что опасность возникает только при высокой концентрации вещества. В обычных условиях оно бесцветно, легко образует водные растворы, а также успешно растворяется в ацетоне.
При концентрации меньше 10% реагент вызывает только раздражение. Если же этот показатель повышен, то соединение может разъесть ткани и множество других веществ. Его пары повреждают глаза, слизистые оболочки и дыхательные пути. При попадании внутрь организма наступает серьёзное отравление. Но в минимальных концентрациях реагент успешно перерабатывается и выводится из организма. В небольших дозах оно присутствует во фруктах, выделениях насекомых, крапиве.
Мощным ядом является азотная кислота. В разных пропорциях она прекрасно смешивается с водой. Реагент крайне опасен для человека. Его пары наносят серьёзный вред органам дыхания и слизистым оболочкам. Кожный покров при попадании кислоты становится жёлтым, на нём остаются язвы. Пострадавшие места требуют длительного восстановительного процесса.
При воздействии высокой температуры или света азотная кислота распадается, превращаясь в довольно токсичный газ. У вещества не возникает химической реакции со стеклом, а потому этот материал применяют для хранения реагента. Создателем ядовитого соединения является алхимик Джабир.
Кривые титрования
К?
