Энергия ионизации и какие свойства элементов она характеризует
Энергия ионизации – это количество энергии, которое изолированный атом в основном электронном состоянии должен поглотить для освобождения электрона, в результате чего образуется ион.
Эта величина обычно выражается в кДж/моль или количество, необходимое для того, чтобы потерять один электрон.
Образование ионов
Ионы – это атомы, которые получили или потеряли электроны. Образуется ионизирующее излучение со своими положительными и отрицательными особенностями для человека. При рассмотрении первоначально нейтрального атома, вытеснение первого электрона потребует меньше работы, чем вытеснение второго, второй потребует меньше, чем третьего и так далее. Для вытеснение каждого последующего электрона требуется больше работы. Это происходит потому, что после потери первой отрицательно заряженной элементарной частицы общий заряд атома становится положительным, а отрицательные силы будут притягиваться к положительному заряду новообразованного иона.
При рассмотрении первоначально нейтрального атома, вытеснение первого электрона потребует меньше работы, чем вытеснение второго, второй потребует меньше, чем третьего и так далее. Для вытеснение каждого последующего электрона требуется больше работы. Это происходит потому, что после потери первой отрицательно заряженной элементарной частицы общий заряд атома становится положительным, а отрицательные силы будут притягиваться к положительному заряду новообразованного иона.
Чем больше отрицательно заряженных элементарных частиц потеряно, тем более положительным будет этот ион, тем труднее отделить другие электроны от этого атома.
В общем, чем дальше электрон от ядра, тем легче его изгнать. Другими словами, энергия ионизации является функцией атомного радиуса: чем больше радиус, тем меньше количество работы, необходимой для удаления электрона с внешней орбитали. Например, было бы гораздо легче забрать электроны от более крупного элемента Ca (кальция), чем от того, где они крепче удерживаются к ядру как Cl (хлор).
В химической реакции, понимание энергии ионизации важно для того, чтобы понять поведение различных атомов при связях друг с другом.
Например, энергия ионизации натрия (щелочного металла) составляет 496 кДж/моль, тогда как хлора – 1251,1 кДж/моль.
Элементы, находящиеся близко друг к другу в периодической таблице, или элементы, не имеющие большой разницы в энергии ионизации, образуют полярные ковалентные или ковалентные связи. Например, углерод и кислород делают СО2 (углекислый газ) находящиеся близко один к другому на периодической таблице. Они поэтому формируют ковалентное скрепление. Углерод и хлор образуют CCl4 (четыреххлористый углерод) другой молекулой, которая ковалентно связана.
Периодическая таблица и тренд ионизации
Энергия ионизации зависит от атомного радиуса. Так как идя справа налево по периодической таблице, атомный радиус увеличивается, а энергия ионизации уменьшается слева направо в периодах и вниз по группам.
Объяснение шаблона в первых нескольких элементах
Водород имеет электронную структуру 1s1. Это очень маленький атом, и электрон приближается к ядру и, следовательно, притягивает. Нет электронов, экранирующих его от ядра, поэтому энергия ионизации высока 1310 кДж моль-1.
Гелий имеет структуру 1s2. Электрон удаляется с той же орбиты, что и в случае с водородом он близок к ядру. Значение 2370 кДж моль-1 намного выше, чем у водорода, потому что ядро теперь имеет 2 протона, притягивающие их вместо 1.
Литий – 1s22s1. Свой внешний электрон находится на втором энергетическом уровне, гораздо более удаленнее от ядра. Можно утверждать, что это было бы компенсировано дополнительным протоном в ядре, но электрон не чувствует полной тяги ядра – он экранируется.
Если сравнить литий с водородом (а не с гелием), электрон водорода также чувствует тягу 1+ от ядра, но расстояние намного больше с литием. Первая энергия ионизации лития падает до 519 кДж моль-1, тогда как водород составляет 1310 кДж моль-1.
Исключения из этой тенденции наблюдаются для щелочноземельных металлов (группа 2: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba), радий (Ra), унбинилий (Ubn) и элементов группы азота (группа 5: азот (N); фосфор (P); мышьяк (As); сурьма (Sb); висмут (Bi)). Группы 2 и 5 имеют полностью и наполовину заполненную электронную конфигурацию соответственно, поэтому для удаления отрицательно заряженных элементарных частиц из полностью заполненных орбиталей требуется больше работы, чем из неполнозаполненных.
Щелочные металлы (группа I) обладают малой энергией ионизации, особенно по сравнению с галогенами или группой VII.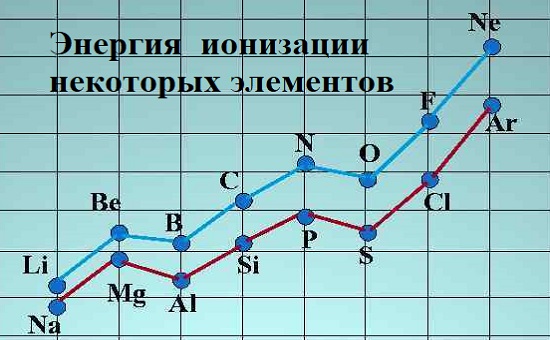
В дополнение к радиусу (расстоянию между ядром и электронами на самой внешней орбите), количество электронов между ядром, в самой внешней оболочке, также влияет на энергию ионизации.
Этот эффект, при котором полный положительный заряд ядра не ощущается внешними электронами из-за отрицательных зарядов внутренних, частично отменяющих положительный заряд, называется экранированием.
Чем больше электронов защищает внешнюю электронную оболочку от ядра, тем меньше работы требуется для вытеснения отрицательно заряженной элементарной частицы из указанного атома.
Чем выше эффект экранирования требуется меньше приложить работы. Из-за экранирующего эффекта энергия ионизации уменьшается сверху вниз в группе. Из таблицы Менделеева видно что Цезий имеет низкую, а фтор самую высокую энергию ионизации (за исключением гелия и неона).
Для чего необходимо знать про эту величину
Падение энергии ионизации при движении вниз таблицы приводит к снижению энергии активации и, следовательно, к более быстрым реакциям.
Энергия ионизации являются одним из наиболее важных факторов, которые необходимо учитывать при оценке прочности химических связей и прогнозировании того, как химические вещества будут связываться друг с другом. Но это не свободная энергия.
Источник
Такие свойства
атомов, как их размер, энергия ионизации,
сродство к электрону, электроотрицательность,
связаны с электронной конфигурацией
атома. В их изменении с увеличением
порядкового номера элемента наблюдается
периодичность.
Радиус атома –
важная характеристика. Чем больше
атомный радиус, тем слабее удерживаются
внешние электроны. И наоборот, с
уменьшением атомного радиуса электроны
притягиваются к ядру сильнее.
В периоде атомный
радиус в общем уменьшается слева направо.
Это объясняется ростом силы притяжения
электронов с ростом заряда ядра. В
подгруппах сверху вниз атомный радиус
возрастает, так как в результате
прибавления дополнительного электронного
слоя увеличивается объем атома, а значит,
и его радиус.
Энергия ионизации
– это энергия,
необходимая для отрыва наиболее слабо
связанного электрона от атома. При
отрыве электрона от атома образуется
соответствующий катион.
Энергия ионизации
для элементов одного периода возрастает
слева направо с возрастанием заряда
ядра. В подгруппе она уменьшается сверху
вниз вследствие увеличения расстояния
электрона от ядра.
Атомы могут не
только отдавать, но и присоединять
электроны. При этом образуется
соответствующий анион. Энергия, которая
выделяется при присоединение к атому
одного электрона, называется сродством
к электрону.
Определение
электроотрицательности дал американский
ученый Л. Полинг. Он же предложил и первую
шкалу электроотрицательности. Согласно
Полингу,
Электроотрицательность
есть способность атома в соединении
притягивать к себе электроны.
Вопрос№11. Химическая связь, её основные характеристики: длина, валентный угол, энергия и полярность.
Длина связи
– это межъядерное расстояние. Химическая
связь тем прочнее, чем меньше ее длина.
Однако мерой прочности связи является
энергия связи.
Энергия связи
определяется количеством энергии,
которое необходимо для разрыва связи.
Углы между связями
называются валентными.
Полярность
химических связей
— характеристика химической связи,
показывающая изменение распределения
электронной плотности в пространстве
вокруг ядер.
Вопрос№12. Ковалентная связь. Два способа её образования. Свойства ковалентной связи. Направленность и насыщаемость связи. Сигма и Пи связи.
Ковалентная
связь, один
из видов химической связи между двумя
атомами, которая осуществляется общей
для них электронной парой.
Механизм образования
ковалентной связи рассмотрим на примере
образования молекулы водорода.
Ядро свободного
атома водорода окружено электронным
облаком, образованным 1s-электроном. При
взаимодействии атомов происходит
частичное перекрывание их электронных
облаков (орбиталей). В результате
возникает общее электронное облако.
Образование химической связи происходит
за счет неспаренных электронов каждого
атома. Неспаренные электроны связываются
в общую пару электронов, которую называют
неподеленной парой.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Такие свойства атомов, как их размер, энергия ионизации, сродство к электрону, электроотрицательность, степень окисления, связаны с электронной конфигурацией атома. В их изменении с увеличением порядкового номера элемента наблюдается периодичность.
Атомы не имеют строго определенных границ, что обусловлено волновой природой электронов. В расчетах пользуются так называемыми эффективными или кажущимися радиусами, т. е. радиусами шарообразных атомов, сближенных между собой при образовании кристалла. Обычно их рассчитывают из рентгенометрических данных.
Радиус атома — важная его характеристика. Чем больше атомный радиус, тем слабее удерживаются внешние электроны. И, наоборот, с уменьшением атомного радиуса электроны притягиваются к ядру сильнее.
В периоде атомный радиус в общем уменьшается слева направо. Это объясняется ростом силы притяжения электронов с ростом заряда ядра. В подгруппах сверху вниз атомный радиус возрастает, так как в результате прибавления дополнительного электронного слоя увеличивается объем атома, а значит, и его радиус.
Энергия ионизации — это энергия, необходимая для отрыва наиболее слабо связанного электрона от атома. Она обычно выражается в электрон-вольтах. При отрыве электрона от атома образуется соответствующий катион.
Энергия ионизации для элементов одного периода возрастает слева направо с возрастанием заряда ядра. В подгруппе она уменьшается сверху вниз вследствие увеличения расстояния электрона от ядра. Энергия ионизации связана с химическими свойствами элементов. Так, щелочные металлы, имеющие небольшие энергии ионизации, обладают ярко выраженными металлическими свойствами. Химическая инертность благородных; газов связана с их высокими значениями энергии ионизации.
Атомы могут не только отдавать, но и присоединять электроны. При этом образуется соответствующий анион. Энергия, которая выделяется при присоединении к атому одного электрона, называется сродством к электрону. Обычно сродство к электрону, как и энергия ионизации, выражается в электрон-вольтах. Значения сродства к электрону известны не для всех элементов; измерять их весьма трудно. Наиболее велики они у галогенов, имеющих на внешнем уровне по 7 электронов. Это говорит об усилении неметаллических свойств элементов по мере приближения к концу периода.
Определение электроотрицательности дал американский ученый Л. Полинг в 1932 г. Он же предложил и первую шкалу электроотрицательности. Согласно Полингу, электроотрицательность – это способность атома в соединении притягивать к себе электроны. Имеются в виду валентные электроны, т. е. электроны, которые участвуют в образовании химической связи. Очевидно, у благородных газов электроотрицательность отсутствует, так как внешний уровень в их атомах завершен и устойчив.
Сопоставляя значения электроотрицательностей элементов от франция (0,86) до фтора (4,10), легко заметить, что относительная электроотрицательность подчиняется периодическому закону: в периоде она растет с увеличением номера элемента, в группе — уменьшается. Ее значения служат мерой неметалличности элементов. Очевидно, чем больше относительная электроотрицательность, тем сильнее элемент проявляет неметаллические свойства. Неметаллы характеризуются большой относительной электроотрицательностью, а металлы — небольшой. При химическом взаимодействии элементов электроны смещаются от атома с меньшей к атому с большей относительной электроотрицательностью.
3. Развитие представления о строении атома: планетарная модель Резерфорда, теория Бора, квантовая теория строения атома.
Суть планетарной модели строения атома (Э.Резерфорд, 1911 г.) можно свести к следующим утверждениям:
1. В центре атома находится положительно заряженное ядро, занимающее ничтожную часть пространства внутри атома.
2. Весь положительный заряд и почти вся масса атома сосредоточены в его ядре (масса электрона равна 1/1823 а.е.м.).
3. Вокруг ядра вращаются электроны. Их число равно положительному заряду ядра.
Эта модель оказалась очень наглядной и полезной для объяснения многих экспериментальных данных, но она сразу обнаружила и свои недостатки. В частности, электрон, двигаясь вокруг ядра с ускорением (на него действует центростремительная сила), должен был бы, согласно электромагнитной теории, непрерывно излучать энергию. Это привело бы к тому, что электрон должен был бы двигаться вокруг ядра по спирали и в конце концов упасть на него. Никаких доказательств того, что атомы непрерывно исчезают, не было, отсюда следовало, что модель Резерфорда в чем-то ошибочна.
Теория Бора. В 1913 г. датский физик Н.Бор предложил свою теорию строения атома. Как и Резерфорд, он считал, что электроны двигаются вокруг ядра подобно планетам, движущимся вокруг Солнца. Однако к этому времени уже доказали дискретность энергии электрона в атоме и это позволило Бору положить в основу новой теории два необычных предположения (постулата):
1. Электрон может вращаться вокруг ядра не по произвольным, а только по строго определенным (стационарным) круговым орбитам.
2. При движении по стационарным орбитам электрон не излучает и не поглощает энергии.
Таким образом, Бор предположил, что электрон в атоме не подчиняется законам классической физики. Согласно Бору, излучение или поглощение энергии определяется переходом из одного состояния в другое, что соответствует переходу электрона с одной стационарной орбиты на другую. При таком переходе излучается или поглощается энергия.
Бор рассчитал частоты линий спектра атома водорода, которые очень хорошо согласовывались с экспериментальными значениями, но было обнаружено также и то, что для других атомов эта теория не давала удовлетворительных результатов.
Квантовая модель строения атома. В последующие годы некоторые положения теории Бора были переосмыслены и дополнены. Наиболее существенным нововведением явилось понятие об электронном облаке, которое пришло на смену понятию об электроне только как частице. Теорию Бора сменила квантовая теория, которая учитывает волновые свойства электрона и других элементарных частиц, образующих атом.
Свойства элементарных частиц, образующих атом
| Частица | Заряд | Масса | ||
| Кл | условн. ед. | г | а.е.м. | |
| Электрон | -1,6∙10-19 | -1 | 9,10∙10-28 | 0,00055 |
| Протон | 1,6∙10-19 | +1 | 1,67∙10-24 | 1,00728 |
| Нейтрон | 1,67∙10-24 | 1,00866 |
В основе современной теории строения атома лежат следующие основные положения:
1. Электрон имеет двойственную (корпускулярно-волновую) природу. Он может вести себя и как частица, и как волна, подобно частице, электрон обладает определенной массой и зарядом; в то же время, движущийся электрон проявляет волновые свойства, например, характеризуется способностью к дифракции. Длина волны электрона λ и его скорость v связаны соотношением де Бройля:
λ = h / mv, где m — масса электрона.
2. Для электрона невозможно одновременно точно, измерить координату и скорость. Чем точнее мы измеряем скорость, тем больше неопределенность в координате, и наоборот.(принцип неопределённости Гейзенберга). Математическим выражением принципа неопределенности служит соотношение
∆x∙m∙∆v > ћ/2, где ∆х — неопределенность положения координаты, ∆v — погрешность измерения скорости.
3. Электрон в атоме не движется по определенным траекториям, а может находиться в любой части около ядерного пространства, однако вероятность его нахождения в разных частях этого пространства неодинакова. Пространство вокруг ядра, в котором вероятность нахождения электрона достаточно велика, называют орбиталью.
4. Ядра атомов состоят из протонов и нейтронов (общее название — нуклоны). Число протонов в ядре равно порядковому номеру элемента, а сумма чисел протонов и нейтронов соответствует его массовому числу.
Различные виды атомов имеют общее название — нуклиды. Нуклиды достаточно характеризовать любыми двумя числами из трех фундаментальных параметров: А — массовое число, Z — заряд ядра, равный числу протонов, равный порядковому номеру в таблице, равный числу электронов и N — число нейтронов в ядре. Эти параметры связаны между собой соотношениями: Z = А – N, N = А – Z, А= Z + N.
Нуклиды с одинаковым Z, но различными А и N, называют изотопами.
Сформулированные выше положения составляют суть новой теории, описывающей движение микрочастиц, — квантовой механики
Источник
Эне́ргией сродства́ а́тома к электро́ну, или просто его сродством к электрону (ε), называют энергию, выделяющуюся в процессе присоединения электрона к свободному атому Э в его основном состоянии с превращением его в отрицательный ион Э− (сродство атома к электрону численно равно, но противоположно по знаку энергии ионизации соответствующего изолированного однозарядного аниона).
Э + e− = Э− + ε
Сродство к электрону выражают в килоджоулях на моль (кДж/моль) или в электронвольтах на атом (эВ/атом).
В отличие от ионизационного потенциала атома, имеющего всегда эндоэнергетическое значение, сродство атома к электрону описывается как экзоэнергетическими, так и эндоэнергетическими значениями (см. табл.).
Зависимость сродства к электрону атома от атомного номера элемента (экзоэффект указан со знаком минус, эндоэффект со знаком плюс)
| Таблица 1 Энергия сродства некоторых атомов к электрону, эВ | |||||
| Элемент | ε | Элемент | ε | Элемент | ε |
| H | -0,75 | Na | -0,78 | K | -0,92 |
| He | 0,30 | Mg | 0,32 | Ca | 0,40 |
| Li | -0,58 | Al | -0,52 | Sc | 0,14 |
| Be | 0,19 | Si | -1,39 | Ti | -0,40 |
| B | -0,33 | P | -0,78 | V | -0,94 |
| C | -1,12 | S | -2,07 | Cr | -0,98 |
| N | 0,27 | Cl | -3,61 | Mn | 1,07 |
| О | -1,47 | Br | -3,36 | Fe | -0,58 |
| F | -3,45 | I | -3,06 | Co | -0,94 |
| Ne | 0,55 | Ni | -1,28 | ||
| Cu | -1,80 |
Наибольшим сродством к электрону обладают p-элементы VII группы. Наименьшее сродство к электрону у атомов с конфигурацией s2 (Be, Mg, Zn) и s2p6 (Ne, Ar) или с наполовину заполненными p-орбиталями (N, P, As):
| Таблица 2 | ||||||||
| Li | Be | B | C | N | O | F | Ne | |
| Электронная конфигурация | s1 | s2 | s2p1 | s2p2 | s2p3 | s2p4 | s2p5 | s2p6 |
| ε, эВ | -0,59 | 0,19 | -0,30 | -1,27 | 0,21 | -1,47 | -3,45 | 0,22 |
Небольшие расхождения в цифрах между табл. 1 и табл. 2 обусловлены тем, что данные взяты из разных источников, а также погрешностью измерений.
Электроотрицательность. Понятие электроотрицательности(ЭО) позволяет оценить способность атома данного элемента к оттягиванию на себя электронной плотности по сравнению сдругими элементами соединения. Очевидно, что эта способность зависит от энергии ионизации атома и его сродства к электрону. Согласно одному из определений (Малликен)электроотрицательность атома х может быть выражена как полусумма его энергии ионизации и сродства к электрону.
Электроотрицательность — это количественная характеристика способности атома в молекуле притягивать к себе электроны. Она равна полусумме энергии ионизации и сродства атома к электрону. Зависимость электроотрицательности отпорядкового номера элемента носит периодический характерэлектроотрицательность возрастает внутри периода и уменьшается внутри группы периодической системы элементов. На практике пользуются относительными значениямиэлектроотрицательности (ОЭО), принимая за единицу электроотрйцательность лития
Основные тенденции периодического изменения свойств элементов следующие. В группе элементов вертикальная периодичность) при возрастании порядкового номерапроисходит увеличение размеров атомов и уменьщениеихэнергии ионизации и сродства к электрону,электроотрицательности элементов и т. п. Вдоль периодаэлементов горизонтальная периодичность) при возрастаниипорядкового номера происходит периодическое увеличениеэнергии ионизации атомов и их сродства к электрону,электроотрицательности элементов с одновременным уменьщением размеров их атомов. Изменение эффективности атомного номера (эффективного заряда ядра 2 ), ровное вдоль периода, несмотря на разное число элементов в периодах.
Неметаллические элементы отличаются от металлическихэлементов более высокими значениями энергии ионизации, сродства к электрону и электроотрицательностей.
Электроотрицательность. Понятие злектроотрицательности (ЭО) позволяет оценить способность атома данного элемента к оттягиванию на себя электронной плотности по сравнению сдругими элементами соединения. Очевидно, что эта способность зависит от энергии ионизации атома и его сродства к электрону. Согласно одному из определений (Малликен)электроотрицателыюсть атома / может быть выражена как полусумма его энергии ионизации и сродства к электрону X 2 (/ + Р)- Имеется около 20 шкал электроотрнцатель-нссти, в основу расчета значений которых положены разные свойства в(ществ.Значенияэлектроотрицательностей разных шкал отли- [c.36]
В каждом периоде периодической таблицы наблюдаетсяобщая тенденция к возрастанию энергии ионизации с увеличением порядкового номера элемента. Сродство к электрону оказывается наибольшим у кислорода и галогенов. Атомы с устойчивыми орбитальными конфигурациями.(s , s p , s p ) имеют очень небольшое (часто отрицательное) сродство к электрону. Расстояние между ядрами двух связанных атомов называется длиной связи. Атомный радиус водорода Н равенполовине длины связи в молекуле Hj- В каждом периоде периодической таблицы наблюдается в общем закономерноеуменьшение атомного радиуса с ростом порядкового номера элемента.
БИЛЕТ 13
Периодический закон. В чем причина периодического изменения свойств элементов с увеличением заряда ядра? Короткопериодный вариант периодической системы элементов. Изменение свойств элементов в периодах и группах.
Периодические изменения свойств химических элементов обусловлены правильным повторением электронной конфигурации внешнего энергетического уровня (валентных электронов) их атомов с увеличением заряда ядра.
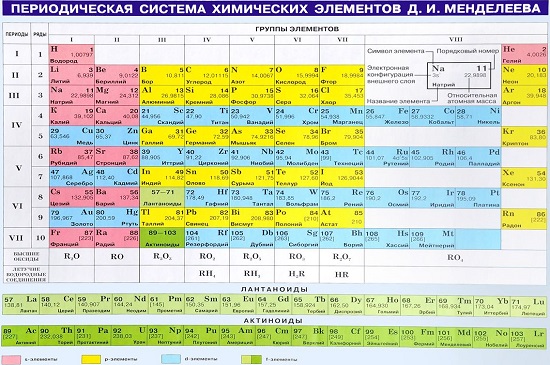
Графическим изображением периодического закона является периодическая таблица. Она содержит 7 периодов и 8 групп.
Период – горизонтальные ряды элементов с одинаковым максимальным значением главного квантового числа валентных электронов.
Номер периода обозначает число энергетических уровней в атоме элемента.
Периоды могут состоять из 2 (первый), 8 (второй и третий), 18 (четвертый и пятый) или 32 (шестой) элементов, в зависимости от количества электронов на внешнем энергетическом уровне. Последний, седьмой период незавершен.
Все периоды (кроме первого) начинаются щелочным металлом (s-элементом), а заканчиваются благородным газом (ns2 np6).
Металлические свойства рассматриваются, как способность атомов элементов легко отдавать электроны, а неметаллические – присоединять электроны из-за стремления атомов приобрести устойчивую конфигурацию с заполненными подуровнями. Заполнение внешнего s- подуровня указывает на металлические свойства атома, а формирование внешнего p- подуровня – на неметаллические свойства. Увеличение числа электронов на p- подуровне (от 1 до 5) усиливает неметаллические свойства атома. Атомы с полностью сформированной, энергетически устойчивой конфигурацией внешнего электронного слоя (ns2 np6) химически инертны.
В больших периодах переход свойств от активного металла к благородному газу происходит более плавно, чем в малых периодах, т.к. происходит формирование внутреннего (n – 1) d- подуровня при сохранении внешнего ns2 – слоя. Большие периоды состоят из четных и нечетных рядов.
У элементов четных рядов на внешнем слое ns2 – электроны, поэтому преобладают металлические свойства и их ослабление с ростом заряда ядра невелико; в нечетных рядах формируется np- подуровень, что объясняет значительное ослабление металлических свойств.
Группы – вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы. Различают главные и побочные подгруппы.
Главные подгруппы состоят из элементов малых и больших периодов, валентные электроны которых расположены на внешних ns- и np- подуровнях.
Побочные подгруппы состоят из элементов только больших периодов. Их валентные электроны находятся на внешнем ns- подуровне и внутреннем (n – 1) d- подуровне (или (n – 2) f- подуровне).
В зависимости от того, какой подуровень (s-, p-, d- или f-) заполняется валентными электронами, элементы периодической системы подразделяются на: s- элементы (элементы главной подгруппы I и II групп), p- элементы (элементы главных подгрупп III – VII групп), d- элементы (элементы побочных подгрупп), f- элементы (лантаноиды, актиноиды).
В главных подгруппах сверху вниз металлические свойства усиливаются, а неметаллические ослабевают. Элементы главных и побочных групп сильно отличаются по свойствам.
Номер группы показывает высшую валентность элемента (кроме O, F, элементов подгруппы меди и восьмой группы).
Общими для элементов главных и побочных подгрупп являются формулы высших оксидов (и их гидратов). У высших оксидов и их гидратов элементов I – III групп (кроме бора) преобладают основные свойства, с IV по VIII – кислотные.
Для элементов главных подгрупп общими являются формулы водородных соединений. Элементы главных подгрупп I – III групп образуют твердые вещества – гидриды (водород в степени окисления – 1), а IV – VII групп – газообразные. Водородные соединения элементов главных подгрупп IV группы (ЭН4) – нейтральны, V группы (ЭН3) – основания, VI и VII групп (Н2Э и НЭ) – кислоты.
От положения элементов в периодической системе зависят свойства атома, связанные с его электронной конфигурацией: атомный радиус – по периоду слева направо уменьшается, а в подгруппе сверху вниз возрастает; энергия ионизации – по периоду возрастает, а в подгруппе уменьшается; электроотрицательность – по периоду увеличивается, а в подгруппе уменьшается.
В периодах отначалак периода к концу (слева направо) усиливаются кислотные (неметаллические) свойства и ослабевают основные (металлические) свойства в связи с увеличением количества электронов на внешнем электронном уровне. В группах от начала к концу (сверху вниз) усиливаются металлические (основные) свойства и ослабевают неметаллические (кислотные свойства) в связи с увеличением электронных уровней и меньшим притяжение электронов внешнего уровня к ядру
Короткая форма периодической системы элементов восходит к первоначальной версии таблицы Менделеева:[1] Короткая форма таблицы Менделеева основана на параллелизме степеней окисления элементов главных и побочных подгрупп: например, максимальная степень окисления ванадия равна +5, как у фосфора и мышьяка, максимальная степень окисления хрома равна +6, как у серы и селена, и т. д. В таком виде таблица была опубликована Менделеевым в 1878 году (до этого группы группировались в ряды, а не в колонки)
Изменение свойств элементов
По периоду слева направо:
заряд ядра атома – увеличивается;
радиус атома – уменьшается;
количество электронов на внешнем уровне – увеличивается;
электроотрицательность – увеличивается;
отдача электронов – уменьшается;
прием электронов – увеличивается.
По группе сверху вниз:
заряд ядра атома – увеличивается;
радиус атома – увеличивается;
количество электронов на внешнем уровне – не изменяется;
электроотрицательность – уменьшается;
отдача электронов – увеличивается;
прием электронов – уменьшается.
Причина изменения свойств также объясняется строением атомов химических элементов.
Каждый период начинается элементом щелочным металлом (исключение – первый период), в атомах которых на внешнем энергетическом уровне имеются один s – электрон. Общая электронная формула строения внешнего энергетического уровня щелочных металлов ns1, где n – номер периода.
Каждый период заканчивается элементом благородным газом. В атомах элементов благородных газов на внешнем энергетическом уровне имеются два s- и шесть p-электронов. Общая электронная формула строения внешнего энергетического уровня благородных газов ns2np6, где n – номер периода (исключение: гелий He – ns2).
Период – это горизонтальная последовательность элементов по возрастанию порядкового (атомного) номера элемента, атомы которых имеют одинаковое число энергетических уровней, численно равное номеру периода.
В периодах металлические свойства уменьшаются, а неметаллические свойства увеличиваются.
В больших периодах изменения свойств происходят медленнее, что объясняется появлением десяти d-элементов (4-й, 5-й периоды) и четырнадцати f-элементов (6-й, 7-й периоды).
По группам (в главных подгруппах) металлические свойства увеличиваются, а неметаллические уменьшаются.
Группа – это вертикальная последовательность элементов по возрастанию порядкового (атомного) номера, обладающая схожими свойствами.
Главная подгруппа – это вертикальная последовательность s- и p-элементов с одинаковым числом электронов на внешнем энергетическом уровне, равным номеру группы.
Побочная подгруппа – это вертикальная последовательность d- и f-элементов, которые имеют одинаковое суммарное количество валентных электронов.
Следовательно, возможна третья формулировка Периодического закона, которая отражает причину периодического изменения свойств.
Свойства химических элементов и образованных ими соединений находятся в периодической зависимости от строения внешних энергетических уровней атомов.
Билет №14
Ковалентная химическая связь. Ее характерные особенности: насыщаемость, полярность и направленность. Определение элементов по методу валентных связей. Рассмотреть на примере 26 и 35 элементов.
Ковалентная связь – химическая связь между атомами, осуществляемая обобществленными электронами. Ковалентная связь является универсальным типом химической связи. Ковалентная связь существует между атомами как в молекулах, так и в кристаллах. Она возникает как между одинаковыми атомами ( например, в молекулах , в кристалле алмаза), так и между разными атомами (например, в молекулах и , в кристаллах SiC). Почти все связи в молекулах органических соединений являются ковалентными. (С-С, С-Н, С-N и др.).
Характерными особенностями ковалентной связи является ее насыщаемость и направленность.
Насыщаемость ковалентных связей обусловлена тем, что при химическом взаимодействии участвуют электроны только внешних энергетических уровней, т.е. ограниченное число электронов.
Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов.
Химическая связь, образованная путем обобществления пары электронов двумя атомами, называется ковалентной. Объяснение химической связи возникновением общих электронных пар между атомами легло в основу спиновой теории валентности, инструментом которой является метод валентных связей (МВС), открытый Льюисом в 1916 г.
Основные принципы образования химической связи по МВС:
1. Химическая связь образуется за счет валентных (неспаренных) электронов.
2. Электроны с антипараллельными спинами, принадлежащие двум различным атомам, становятся общими.
3. Химическая связь образуется только в том случае, если при сближении двух и более атомов полная энергия системы понижается.
4. Основные силы, действующие в молекуле, имеют электрическое, кулоновское происхождение.
5. Связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
Существует два механизма образования ковалентной связи
Обменный механизм. Связь образована путем обобществления валентных электронов двух нейтральных атомов. Каждый атом дает по одному неспаренному электрону в общую электронную пару:
а) б)
Рис. Обменный механизм образования ковалентной связи: а – неполярной; б – полярной
Донорно-акцепторный механизм. Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь. Соединения, образованные по донорно-акцепторному механизму, относятся к комплексным соединениям
Согласно МВС валентность электронов определяется числом неспаренных электронов, находящихся в атоме, причем для s и p элементов это электроны, находящиеся на внешнем и предвнешнем электронных слоях.
Билет №15
Полярность связи. Дипольный момент и единицы его измерения. Отличаются ли полярность связи и молекул? Приведите примеры.
Полярность химических связей — характеристика химической связи (как правило ковалентной), показывающая изменение распределения электронной плотности в пространстве вокруг ядер в сравнении с распределением электронной плотности в образующих данную связь нейтральных атомах.
Если молекула образована одинаковыми атомами (O2, H2, Cl2), то между ними образуется неполярная ковалентная связь. В таком случае валентные электроны притягиваются атомами с равной силой, поэтому общее электронное облако расположено симметрично относительно обоих атомов. Электронная пара, образующая связь, в равной степени принадлежит обоим атомам.
Если ковалентную связь в молекуле образуют атомы разных элементов, то она будет полярной. В полярной ковалентной связи электронная пара смещена к атому с большей электроотрицательностью, то есть к тому, который сильнее притяги
