Хлорид натрия номер пищевой добавки
Оказывается, в соль тоже стали добавлять добавки! Да, вы не ослышались! Я когда узнал, я тоже не поверил!
Казалось бы, соль это такой продукт, который не портится и может храниться тысячу лет, максимум — упаковка пожелтеет и развалится за это время. Но нет, нашлись умники, решившие позаботиться о нашем здоровье и добавившие в соль E551, E535, Е536, E554. Это называется — антислеживатель.
Без соли и хлеб не естся.
Мы стараемся делать закрутки на зиму, готовить различные продукты, чтобы накормить наших детей и внуков вкусной и полезной пищей, а о том, чтобы мы продолжали есть химическую еду, как оказывается, уже позаботились многоуважаемые производители соли.
Иностранные производители тоже добавляют в соль добавки.
Давайте разбираться в свойствах этих добавок.
E551 — диоксид кремния, также в международном обозначении носит название Silicon Dioxide.
Пожалуй, это самая безвредная добавка из рассматриваемых нами. Как указывается в описании к добавке диоксид кремния: “в данном виде он не особо опасный”. Добавка легально используется всеми странами, и хотя она не относится к опасному веществу, граничная доза составляет 30 граммов на килограмм готового продукта.
Также применяется в строительстве, стекольной промышленности, в производстве резины и других отраслях.
E535 — ферроцианид натрия, Sodium ferrocyanide, жёлтая кровяная соль (ЖКС). Представляет собой добавку к пищевым продуктам из разряда антикомкователей, включён в список разрешённых добавок.
Из химических свойств главным является низкий уровень токсичности, но свойство выделять ядовитые газы во время взаимодействия Е535 с водой делает это вещество достаточно опасным для здоровья человека. Тот, кто её утвердил к применению, должно быть считает, что газы выветрятся.
Помимо соли, добавку Е535 добавляют в порошковые кофейные напитки, горячий шоколад, какао, сухие сливки и сухое молоко. С помощью этой добавки продукт дольше хранится и сохраняет товарный вид.
Точного влияния на организм человека добавки Е535 не установлено. Поэтому, чтобы снизить уровень риска различных осложнений, для пищевых производств была установлена максимальная суточная дозировка потребления данного вещества – она составляет 25 мг на каждый кг массы тела взрослого человека (или ребёнка).
Полезных свойств для здоровья человека в добавке под номером Е535 не обнаружено и не выявлено. В Австралии и некоторых Европейских странах эта добавка запрещена для использования в пищу.
E536. В пищевой промышленности ферроцианид калия (также принято называть жёлтой кровяной солью). Используют в производстве для “сыпучести” продукта, хорошо препятствует слипанию, комкованию и слёживанию.
Раньше на промышленных предприятиях получали цианистые соединения весьма простыми методами. В чугунных котлах спекалась железная стружка с карбонатом калия и азотсодержащими животными отходами (рога, копыта, обрезки кожи, сухой крови). У кристаллов, которые образовались из застывшего сплава, был желтый цвет. За это веществу и дали название “жёлтая кровяная соль”.
Сегодня в промышленных масштабах E536 получается путём обработки раствором железного купороса смеси цианидов и хлоридов натрия и кальция. Как результат — цианиды переходят в ферроцианиды. Из них получают чистые соли разложением карбонатами натрия и калия.
Е554 – натриевая соль алюмокремниевой кислоты. Как и все силикаты, продукт применяют для “защиты” продуктов от комкования.
Биологической пользы алюмосиликат не приносит. Из организма
выводится почками. Тут никаких “почек” не напасёшься.
Нет данных и о безопасном суточном количестве этого вещества. Вместо него указан международный индекс PTWI — временно допустимая недельная доза. Она составляет 2 мг/кг массы человека. Ученые честно предупреждают: цифры условные и обозначают общее количество алюминия, поступившего в организм человека.
Употребление продуктов с большим количеством пищевых добавок постепенно сказывается на состоянии здоровья. Обостряются хронические заболевания желудочно-кишечного тракта, появляется аллергическая сыпь, ухудшается память и концентрация внимания. При систематическом употреблении таких продуктов лечение не будет давать видимых результатов, а здоровье будет продолжать ухудшаться. Единственное правильное решение в наше время — внимательно изучать состав продуктов. Особенно состав соли — её мы потребляем постоянно.
Если Вам понравилась статья, или вы хотите узнать, как самому приготовить вино, самогон, квас, пиво, коньяк, газировку с газом и другие напитки, рецепты смотрите на нашем канале YouTube
Подписывайтесь, чтобы не пропустить новые рецепты и статьи. Поделитесь этой статьёй, ведь началось время заготовок на зиму, а люди не знают про добавки в соли.
Рекомендуем Водка на черноплодной рябине с красным перцем рецепт.
Источник
Соли – это обширный класс химических соединений, и чаще всего выпадение солёного осадка является свидетельством прохождения реакции обмена между щелочью и кислотой. Соли, согласно общепринятой номенклатуре ИЮПАК, являются соединениями положительных и отрицательных ионов – катионов и анионов, соответственно. В зависимости от того, из каких ионов состоит соль, её свойства могут сильно отличаться. Так, например, соли калия окрашивают пламя в фиолетовый цвет, соли меди – в синий. Одним из самых распространенных соединений из класса солей являются соли хлорида натрия. Каковы же свойства и особенности этого продукта, в быту называемого поваренной солью?
Хлористый натрий в природе
В природе соль встречается на мелководье, на берегах солёных озер, в виде залежей минеральных горных пород, таких как галит, на стенках кратеров некоторых вулканов. В одной тонне океанической воды растворено примерно полтора килограмма чистого хлорида натрия. Стоит отметить, что морскую соль заприметили ещё древние люди. Впервые они познакомились с ней на берегах соляных озёр, где вода очень активно испарялась при температуре 20-35 градусов Цельсия, оставляя после себя кристаллы соли. Состав такого осадка может варьироваться в зависимости от условий окружающей среды и наличия в воде тех или иных микроэлементов. Например, горько-солёный вкус морской воды объясняется высокой концентрацией в ней солей магния. Значит, при испарении такой воды останется осадок с высокой концентрацией хлорида и сульфата магния.
История производства пищевой соли
В промышленности получение поваренной соли чаще всего осуществляется из других минералов и микроэлементов: йода, магния, калия. Йодированную соль обычно добывают из Мертвого моря, ведь именно там концентрация йода выше, чем в других водоёмах. Также соль с высоким содержанием йода можно получить обработкой обычной поваренной соли йодирующими добавками, например, введением йодистого калия с тиосульфатом натрия. Но как получить обычную поваренную соль, которую люди используют в повседневной деятельности? Ведь в кристаллическом состоянии она находится в горных породах, смешанная с большим количеством других полезных ископаемых. Этим вопросом впервые задались жители новокаменного века, неолита. Первые солеварни, согласно данным археологических раскопок, были найдены в прибрежном болгарском городе Провадии-Солницате, где добывать соль научились еще в 5500 году до нашей эры. Суть процесса заключалась в выпаривании источниковой воды в глиняных куполообразных печах. Солеварение на Руси появилась много позже – первое упоминание о нём датируется началом XII века нашей эры.
На данный момент изобретены более оптимальные способы добычи соли – например, бассейный способ, который заключается в садке солей на территории искусственно образованных плоских бассейнов. Выпускают соль в виде рассолов, зёрен и брикетов с микродобавками для скота. Лидерами по производству соли являются Соединенные Штаты Америки, Китай, Индия, Канада и Австралия. Россия находится на 14-ом месте в списке соледобыдчиков.
Применение соли в промышленности
Благодаря своим консервирующим свойствам, соль часто используется в пищевом производстве не только в качестве вкусовых добавок, но и в виде ингредиента, предохраняющего продукт от скорой порчи. Для добавления в продукт поваренная соль должна содержать в себе не менее 97 процентов хлорида натрия и соответствовать второму сорту качества. Если на банке соли написано «Сорт экстра», то содержание хлористого натрия в ней составляет 99,5 процента.
В медицине 0,9-процентный раствор соли, также называемый физиологическим раствором, применяется в случае обезвоживания для восстановления нормальной работы систем организма. 10-процентным гипертензирующим раствором при введении внутрь соли можно уменьшить скорость кровотечения. Этот же раствор используют для внешней обработки гноящихся ран.
Соль вместе с известняками, серой и каменным углем является одним из самых важных продуктов для химической промышленности. Она участвует в получении соды, металлического натрия, хлорида водорода и других полезных соединений.
Приборы для измерения концентрации соли в растворах
При измерении концентрации соли в образцах можно пользоваться всем известными из школьного курса химии формулами, однако это не всегда даёт точный результат, поэтому были разработаны приборы, позволяющие сделать это гораздо точнее и, что немаловажно, быстрее, будь то поваренная соль или другие минеральные соединения. Одним из таких приборов является солемер – прибор для анализа гидрофизических характеристик морской воды. Его работа основана на действии электромагнитной индукции – в зависимости от концентрации соли в растворе его электропроводность меняется. Так как показания прибора могут разниться в зависимости от температуры воды, солемеры должны удовлетворять жёстким требованиям термостатирования.
Еще один распространённый прибор для измерения концентрации соли в растворе – это рефрактометр. Это прибор, действие которого основано на оптических свойствах среды. Принцип его работы заключается в том, что, соприкасаясь с поверхностью образца, луч света преломляется и попадает на размеченную сетку прибора, указывая на определенное значение концентрации.
Также для определения солёности растворов часто используют ион-селективные электроды (ISE) и метод титрования.
Источник
| Хлорид натрия | |
|---|---|
 | |
| Систематическое наименование | Хлорид натрия |
| Традиционные названия | Соль, поваренная соль, столовая соль, пищевая соль, каменная соль, галит |
| Хим. формула | NaCl |
| Молярная масса | 58,44277 г/моль |
| Плотность | 2,165 г/см³ |
| Температура | |
| • плавления | 800,8 °C |
| • кипения | 1465 °C |
| Мол. теплоёмк. | 50,8 Дж/(моль·К) |
| Энтальпия | |
| • образования | −234,8 кДж/моль |
| Удельная теплота испарения | 170,85 кДж/моль |
| Удельная теплота плавления | 28,68 кДж/моль |
| Растворимость | |
| • в воде | 35,6 г/100 мл (0 °C) 35,9 г/100 мл (+25 °C) 39,1 г/100 мл (+100 °C) |
| • в метаноле | 1,49 г/100 мл |
| • в аммиаке | 21,5 г/100 мл |
| Показатель преломления | 1,544202 (589 нм) |
| Координационная геометрия | Октаэдральная (Na +) Октаэдральная (Cl -) |
| Кристаллическая структура | гранецентрированная кубическая, cF8 |
| Рег. номер CAS | 7647-14-5 |
| PubChem | 5234 |
| Рег. номер EINECS | 231-598-3 |
| SMILES | [Na+].[Cl-] |
| InChI | 1S/ClH.Na/h1H;/q;+1/p-1 FAPWRFPIFSIZLT-UHFFFAOYSA-M |
| RTECS | VZ4725000 |
| ChEBI | 26710 |
| ChemSpider | 5044 |
| ЛД50 | 3000–8000 мг/кг |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |

Также смотрите статью – поваренная соль
Хлорид натрия или хлористый натрий (NaCl) — натриевая соль соляной кислоты. Известен в быту под названием поваренной соли, основным компонентом которой и является. Хлорид натрия в значительном количестве содержится в морской воде. Встречается в природе в виде минерала галита (каменной соли). Чистый хлорид натрия представляет собой бесцветные кристаллы, но с различными примесями его цвет может принимать голубой, фиолетовый, розовый, жёлтый или серый оттенок.

Нахождение в природе и производство
В природе хлорид натрия встречается в виде минерала галита, который образует залежи каменной соли среди осадочных горных пород, прослойки и линзы на берегах солёных озёр и лиманов, соляные корки в солончаках и на стенках кратеров вулканов и в сольфатарах. Огромное количество хлорида натрия растворено в морской воде. Мировой океан содержит 4 × 1015 тонн NaCl, то есть из каждой тонны морской воды можно получить в среднем 1,3 кг хлорида натрия. Следы NaCl постоянно содержатся в атмосфере в результате испарения брызг морской воды. В облаках на высоте полтора километра 30 % капель, больших 10 мкм по размеру, содержат NaCl. Также он найден в кристаллах снега.
Наиболее вероятно, что первое знакомство человека с солью произошло в лагунах тёплых морей или на соляных озёрах, где на мелководье солёная вода интенсивно испарялась под действием высокой температуры и ветра, а в осадке накапливалась соль. По образному выражению Пифагора, «соль была рождена благородными родителями: солнцем и морем».
Галит
В природе хлорид натрия чаще всего встречается в виде минерала галита. Он имеет гранецентрированную кубическую решётку и содержит 39,34 % Na, 60,66 % Cl. Другими химическими элементами, входящими в состав примесей, являются: Br, N, H, Mn, Cu, Ga, As, I, Ag, Ba, Tl, Pb, K, Ca, S, O. Плотность 2,1—2,2 г/см³, а твёрдость по шкале Мооса — 2. Бесцветный прозрачный минерал со стеклянным блеском. Распространённый минерал соленосных толщ. Образуется при осаждении в замкнутых водоёмах, а также как продукт сгона на стенках кратеров вулканов. Составляет пласты в осадочных породах лагунных и морских фаций, штокоподобные тела в соляных куполах и тому подобных.
Каменная соль
Каменной солью называют осадочную горную породу из группы эвапоритов, состоящую более чем на 90 % из галита. Галит также часто называют каменной солью. Эта осадочная горная порода может быть бесцветной или снежно-белой, но чаще она окрашена примесями глин, талька (серый цвет), оксидами и гидроксидами железа (жёлтый, оранжевый, розовый, красный), битумами (бурая). Каменная соль содержит хлориды и сульфаты натрия, калия, магния и кальция, бромиды, йодиды, бораты, гипс, примеси карбонатно-глинистого материала, доломита, анкериту, магнезита, битумов и так далее.
По условиям формирования месторождений каменную соль подразделяют на следующие виды:
- рассолы современных соляных бассейнов
- соляные подземные воды
- залежи минеральных солей современных соляных бассейнов
- ископаемые залежи (важнейшие для промышленности).
Морская соль
Морская соль является смесью солей (хлориды, карбонаты, сульфаты и т. д.), образующейся при полном испарении морской воды. Среднее содержание солей в морской воде составляет:
| Соединение | Масс. доля, % |
|---|---|
| NaCl | 77,8 |
| MgCl2 | 10,9 |
| MgSO4 | 4,7 |
| KCl | 2,5 |
| K2SO4 | 2,5 |
| CaCO3 | 0,3 |
| Ca(HCO3)2 | 0,3 |
| другие соли | 0,2 |

Очищенная кристаллическая морская соль
При испарении морской воды при температуре от +20 до +35 °C в осадке сначала кристаллизуются наименее растворимые соли — карбонаты кальция и магния и сульфат кальция. Затем выпадают более растворимые сульфаты натрия и магния, хлориды натрия, калия и магния, и после них — сульфаты калия и магния. Последовательность кристаллизации солей и состав осадка может несколько варьироваться в зависимости от температуры, скорости испарения и других условий. В промышленности морскую соль получают из морской воды, в основном методом обычного выпаривания. Она отличается от каменной соли значительно большим содержанием других химических солей, минералов и различных микроэлементов, в первую очередь йода, калия, магния и марганца. Соответственно, она отличается от хлорида натрия и по вкусу — горько-солёный привкус ей придают соли магния. Она используется в медицине: при лечении кожных заболеваний, таких как псориаз. Как лечебное вещество в аптечной и обычной торговой сети, распространённым продуктом является соль из Мёртвого моря. В очищенном виде этот вид соли также предлагается в продуктовой торговой сети — как натуральная и богатая йодом пищевая.
Залежи
Залежи каменной соли найдены во всех геологических системах. Важнейшие из них сосредоточены в кембрийских, девонских, пермских и третичных отложениях. Каменная соль составляет мощные пластовые залежи и ядра сводчатых структур (соляных куполов и штоков), образует прослойки, линзы, гнезда и вкрапления в других породах. Среди озёрных месторождений России крупнейшие — Эльтонское, Баскунчак в Прикаспии, Кучукское озеро, Кулундинское озеро, Эбейты и другие озёра в Западной Сибири.
Производство
В древности технология добычи соли заключалась в том, что соляную рапу (раствор) вытаскивали лошадиным приводом из шахт, которые назывались «колодцами» или «окнами», и были достаточно глубокими — 60—90 м. Извлечённый солевой раствор выливали в особый резервуар — творило, откуда она через отверстия стекала в нижний резервуар, и системой жёлобов подавалась в деревянные башни. Там её разливали в большие чаны, на которых соль вываривали.
На Руси поморы вываривали соль на побережье Белого моря и называли её морянка. В 1137 году новгородский князь Святослав определил налог на соляные варницы.
Беломорской солью, называемой «морянкой», торговали по всей Российской империи до начала XX века, пока её не вытеснила более дешёвая поволжская соль.
Современная добыча хлорида натрия механизирована и автоматизирована. Соль массово добывается выпариванием морской воды (тогда её называют морской солью) или рассола с других ресурсов, таких как соляные источники и соляные озера, а также разработкой соляных шахт и добычей каменной соли.
Для добычи хлорида натрия из морской воды необходимы условия жаркого климата с низкой влажностью воздуха, наличие значительных низменных территорий, лежащих ниже уровня моря, или затопляемых приливом, слабая водопроницаемость почвы испарительных бассейнов, малое количество осадков в течение сезона активного испарения, отсутствие влияния пресных речных вод и наличие развитой транспортной инфраструктуры.
Мировое производство соли в 2009 году оценивается в 260 миллионов тонн. Крупнейшими мировыми производителями являются Китай (60,0 млн тонн), США (46,0 млн тонн), Германия (16,5 млн тонн), Индия (15,8 млн тонн) и Канада (14 млн тонн).
Добыча соли в южной части Мертвого моря, Израиль
Плантация морской соли в Дакаре
Соляные кучи на солончаке Уюни, Боливия
Применение
В пищевой промышленности и кулинарии

В пищевой промышленности и кулинарии используют хлорид натрия, чистота которого должна быть не менее 97 %. Его применяют как вкусовую добавку и для консервирования пищевых продуктов. Такой хлорид натрия имеет товарное название поваренная соль, порой также употребляются названия пищевая, столовая, а также уточнение названия в зависимости от её происхождения — каменная, морская, и по составу добавок — йодированная, фторированная и т. д. Такая соль является кристаллическим сыпучим продуктом с солёным вкусом без привкуса, без запаха (за исключением йодированной соли), в котором не допускаются посторонние примеси, не связанные с методом добывания соли. Кроме хлорида натрия, поваренная соль содержит небольшое количество солей кальция, магния, калия, которые придают ей гигроскопичности и жёсткости. Чем меньше этих примесей в соли, тем выше её качество.
Выделяют сорта: экстра, высший, первый и второй. Массовая доля хлористого натрия в сортах, %:
- экстра — не менее 99,5;
- высший — 98,2;
- первый — 97,5;
- второй — 97,0.
Массовая доля влаги в выварочной соли сорта «экстра» 0,1 %, в высшем сорте — 0,7 %. Допускают добавки йодида калия (йодистого калия), йодата калия, фторидов калия и натрия. Массовая доля йода должна составлять (40,0 ± 15,0) × 10−4 %, фтора (25,0 ± 5,0) × 10−3 %. Цвет экстра и высшего сортов — белый, однако для первого и второго допускается серый, желтоватый, розовый и голубоватый оттенки в зависимости от происхождения соли. Пищевую поваренную соль производят молотой и сеяной. По размеру зёрен молотую соль подразделяют на номера: 0, 1, 2, 3. Чем больше номер, тем больше зерна соли.
В кулинарии хлорид натрия потребляют как важнейшую приправу. Соль имеет характерный вкус, без которого пища кажется человеку пресной. Такая особенность соли обусловлена физиологией человека. Однако зачастую люди потребляют соли больше, чем нужно для физиологических процессов.
Хлорид натрия имеет слабые антисептические свойства — 10-15%-ное содержание соли предотвращает размножение гнилостных бактерий. Этот факт обусловливает её широкое применение как консерванта.
В медицине
Изотонический раствор хлорида натрия в воде (0,9 %) применяется как дезинтоксикационное средство, для коррекции состояния систем организма в случае обезвоживания, как растворитель других лекарственных препаратов. Гипертонические растворы (10 % раствор) используют как вспомогательный осмотический диуретик при отёке головного мозга, для поднятия давления при кровотечениях, в состояниях, характеризующихся дефицитом ионов натрия и хлора, при отравлении нитратом серебра, для обработки гнойных ран (местно). В офтальмологии как местное средство раствор хлорида натрия обладает противоотёчным действием.
В коммунальном хозяйстве. Техническая соль
Зимой хлорид натрия, смешанный с другими солями, песком или глиной — так называемая техническая соль — применяется как антифриз против гололёда. Ею посыпают тротуары, хотя это отрицательно влияет на кожаную обувь и техническое состояние автотранспорта ввиду коррозийных процессов.

Регенерация Nа-катионитовых фильтров
Nа-катионитовые фильтры широко применяются в установках умягчения воды всех мощностей при водоподготовке. Катионитным материалом на современных водоподготовительных установках служат в основном глауконит, полимерные ионообменные смолы и сульфированные угли. Наиболее распространены сульфокатионитные ионообменные смолы.
Регенерацию Nа-катионитовых фильтров осуществляют 6—10%-м раствором поваренной соли, в результате катионит переводится в Na-форму, регенерируется. Реакции идут по уравнениям:
CaR2 + 2 NaCl → 2NaR + CaCl2 MgR2 + 2 NaCl → 2 NaR + MgCl2
Химическая промышленность
Соль, наряду с каменным углём, известняками и серой, образует «большую четвёрку» продуктов минерального сырья, которые являются важнейшими для химической промышленности. Из неё получают соду, хлор, соляную кислоту, гидроксид натрия, сульфат натрия и металлический натрий. Кроме этого соль используется также для промышленного получения легкорастворимого в воде хлората натрия, который является средством для уничтожения сорняков. Суммарное уравнение реакции электролиза горячего раствора хлорида натрия:
NaCl + 3H2O → NaClO3 + 3H2
Получение хлора и гидроксида натрия
В промышленности путём электролиза раствора хлорида натрия получают хлор. Процессы, происходящие на электродах:
- на катоде как побочный продукт выделяется водород вследствие восстановления ионов H+, образованных в результате электролитической диссоциации воды:
H2O ⇄ H+ + OH− 2 H+ + 2e− → H2
- поскольку (вследствие практически полной электролитической диссоциации NaCl), хлор в растворе находится в виде хлорид-ионов, они окисляются на аноде до свободного хлора в виде газа:
NaCl → Na+ + Cl− 2 Cl− → Cl2 + 2e−
- суммарная реакция:
2 NaCl + 2H2O → 2 NaOH + Cl2↑ + H2↑
Как видно из уравнения суммарной реакции, ещё одним продуктом является гидроксид натрия. Расход электроэнергии на 1 т хлора составляет примерно 2700 кВт × час. Полученный хлор при повышенном давлении сжижается в жёлтую жидкость уже при обычной температуре.
Если между анодом и катодом нет диафрагмы, то растворённый в воде хлор начинает реагировать с гидроксидом натрия, образуя хлорид и гипохлорит натрия NaClO:
2 NaOH + Cl2 → NaCl + NaOCl + H2O
Поэтому для получения гидроксида натрия применяют диафрагму и соответствующий метод получения NaOH называют диафрагменным. В качестве диафрагмы применяют асбестовый картон. В процессе электролиза раствор хлорида натрия постоянно подаётся в анодное пространство, а из катодного пространства непрерывно вытекает раствор хлорида и гидроксида натрия. Во время выпаривания последнего хлорид кристаллизуется, поскольку его растворимость в 50 % растворе NaOH крайне мала (0,9 %). Полученный раствор NaOH выпаривают в железных чанах, затем сухой остаток переплавляют.
Для получения чистого гидроксида натрия (без добавок хлорида натрия) применяют ртутный метод, где используют графитовый анод и ртутный катод. Вследствие того, что перенапряжение выделения водорода на ртути очень большое, на ней вновь появляются ионы натрия и образуется амальгама натрия:
Na+ + e− → Na(Hg)
Амальгаму позже разлагают горячей водой с образованием гидроксида натрия и водорода, а ртуть перекачивают насосом обратно в электролизер:
2Na(Hg) + 2H2O → 2 NaOH + H2↑
Суммарная реакция процесса такая же, как и в случае диафрагменного метода.
Получение металлического натрия
Металлический натрий получают электролизом расплава хлорида натрия. Происходят следующие процессы:
- на катоде выделяется натрий:
Na+ + e− → Na
- на аноде выделяется хлор (как побочный продукт):
2 Cl− → Cl2 + 2e−
- суммарная реакция:
2 Na+ + 2 Cl− → 2 Na + Cl2
Ванна электролизера состоит из стального кожуха с футеровкой, графитового анода и кольцевого железного катода. Между катодом и анодом располагается сетчатая диафрагма. Для снижения температуры плавления NaCl (+800 °C), электролитом является не чистый хлорид натрия, а его смесь с хлоридом кальция CaCl 2 (40:60) с температурой плавления +580 °C. Металлический натрий, который собирается в верхней части катодного пространства, содержит до 5 % примесь кальция, но последний со временем почти полностью отделяется, поскольку его растворимость в жидком натрии при температуре его плавления (+371 K = 98 °C) составляет всего 0,01 %. С расходованием NaCl его постоянно добавляют в ванну. Затраты электроэнергии составляют примерно 15 кВт × ч на 1 кг натрия.
Получение соляной кислоты и сульфата натрия
Среди многих промышленных методов получения соляной кислоты, то есть водного раствора хлороводорода (HCl), применяется реакция обмена между твёрдым хлоридом натрия и концентрированной серной кислотой:
NaCl + H2SO4 →t<110oC NaHSO4 + HCl ↑ NaCl + NaHSO4 →450−800oC Na2SO4 + HCl ↑
Первая реакция происходит в значительной степени уже при обычных условиях, а при слабом нагреве идёт почти до конца. Вторая происходит лишь при высоких температурах. Процесс осуществляется в специальных механизированных печах большой мощности. Хлороводород, который выделяется, обеспыливают, охлаждают и поглощают водой с образованием соляной кислоты. Как побочный продукт образуется сульфат натрия Na2SO4.
Этот метод применяется также для получения хлороводорода в лабораторных условиях.
Физические и физико-химические свойства
Температура плавления +800,8 °С, кипения +1465 °С.
Умеренно растворяется в воде, растворимость мало зависит от температуры: коэффициент растворимости NaCl (в граммах на 100 г воды) равен 35,9 при +21 °C и 38,1 при +80 °C. Растворимость хлорида натрия существенно снижается в присутствии хлороводорода, гидроксида натрия, солей — хлоридов металлов. Растворяется в жидком аммиаке, вступает в реакции обмена. В чистом виде хлорид натрия не гигроскопичен. Однако соль часто бывает загрязнена примесями (преимущественно ионами Ca2+, Mg2+ и SO2−
4), и такая соль на воздухе сыреет. Кристаллогидрат NaCl · 2H2O можно выделить при температуре ниже +0,15 °C.
Смесь измельчённого льда с мелким порошком хлорида натрия является эффективным охладителем. Так, смесь состава 30 г NaCl на 100 г льда охлаждается до температуры −20 °C. Это происходит потому, что водный раствор соли замерзает при температуре ниже 0 °C. Лёд, имеющий температуру около 0 °C, плавится в таком растворе, поглощая тепло окружающей среды.
| Термодинамические характеристики | |
|---|---|
| ΔfH0g | −181,42 кДж/моль |
| ΔfH0l | −385,92 кДж/моль |
| ΔfH0s | −411,12 кДж/моль |
| ΔfH0aq | −407 кДж/моль |
| S0g, 1 bar | 229,79 Дж/(моль·K) |
| S0l, 1 bar | 95,06 Дж/(моль·K) |
| S0s | 72,11 Дж/(моль·K) |
Диэлектрическая проницаемость NaCl — 6,3
Плотность и концентрация водных растворов NaCl
| Концентрация, % | Концентрация, г/л | Плотность, г/мл |
|---|---|---|
| 1 | 10,05 | 1,005 |
| 2 | 20,25 | 1,012 |
| 4 | 41,07 | 1,027 |
| 6 | 62,47 | 1,041 |
| 8 | 84,47 | 1,056 |
| 10 | 107,1 | 1,071 |
| 12 | 130,2 | 1,086 |
| 14 | 154,1 | 1,101 |
| 16 | 178,5 | 1,116 |
| 18 | 203,7 | 1,132 |
| 20 | 229,5 | 1,148 |
| 22 | 256 | 1,164 |
| 24 | 283,2 | 1,18 |
| 26 | 311,2 | 1,197 |
Лабораторное получение и химические свойства
При действии концентрированной серной кислоты на твёрдый хлорид натрия выделяется хлороводород:
2 NaCl + H2SO4 →t>110oC Na2SO4 + 2 HCl ↑
С раствором нитрата серебра образует белый осадок хлорида серебра (качественная реакция на хлорид-ион):
NaCl + AgNO3 → NaNO3 + AgCl ↓
При смешивании с сульфатом меди в растворе получается тетрахлоркупрат натрия, при этом синий раствор зеленеет из-за преобладания гидратированного иона [CuCl4(H2O)2]2− :
CuSO4 + 4 NaCl ⇄ Na2[CuCl4] + Na2SO4
Учитывая огромные природные запасы хлорида натрия, необходимости в его промышленном или лабораторном синтезе нет. Однако, его можно получить различными химическими методами как основной или побочный продукт.
- получение из простых веществ натрия и хлора является экзотермической реакцией:
2 Na + Cl2 → 2 NaCl + 410 kJ/mol
- нейтрализация щелочи гидроксида натрия соляной кислотой:
NaOH + HCl → NaCl + H2O
Поскольку хлорид натрия в водном растворе почти полностью диссоциирован на ионы:
NaCl → Na+ + Cl−
Его химические свойства в водном растворе определяются соответствующими химическими свойствами катионов натрия и хлорид-анионов.
Структура

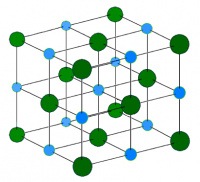
Кристаллическая решётка хлорида натрия.
Голубой цвет = Na+
Зелёный цвет = Cl−
Хлорид натрия образует бесцветные кристаллы кубической сингонии, пространственная группа Fm3m, параметры ячейки a = 0,563874 нм, d = 2,17 г/см3. Каждый из ионов Cl− окружён шестью ионами Na+ в октаэдрической конфигурации, и наоборот. Если мысленно отбросить, например, ионы Na+, то останется плотно упакованная кубическая структура ионов Cl−, называемая гранецентрированной кубической решёткой. Ионы Na+ тоже образуют плотно упакованную кубическую решётку. Таким образом, кристалл состоит из двух подрешёток, сдвинутых друг относительно друга на полупериод. Такая же решётка характерна для многих других минералов.
В кристаллической решётке между атомами преобладает ионная химическая связь, что является следствием действия электростатического взаимодействия противоположных по заряду ионов.
Источник
