Что такое водородная связь какие свойства спиртов обусловлены ее образованием
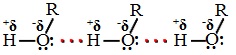
Метиловый спирт (метанол, карбинол, древесный спирт) – простейший одноатомный спирт, бесцветная жидкость (tкип= 64,5; tпл= -97; ρ= 0,793г/см3), с запахом алкоголя, хорошо растворяется в воде, горюч. Пары метанола взрывоопасны. Пары метанола взрывоопасны. Сильный яд!
Метанол вызывает слепоту (достаточно 10 мл). При употреблении внутрь 70 мл и более наступает летальный исход. Смерть наступает от паралича верхних дыхательных путей.
Действие метанола на организм

Этиловый спирт (этанол, винный спирт) – бесцветная жидкость, с запахом спирта, хорошо смешивается с водой, ядовитое наркотическое вещество. Кипит при 78,30С, замерзает при -1140С. Горит слабо светящимся пламенем. В виде ректификата (спирта, очищенного перегонкой) он содержит 95,6 % спирта и 4,4% воды.
Винный спирт – исторически сложившееся название, которое отражает, что этанол является основным компонентом винной продукции.
Этиловый спирт разрушает кровеносную, нервную, пищеварительную системы. Вызывает сильное привыкание и деградацию личности. При употреблении 300 мл, в перерасчете на чистый спирт, может вызвать смертельный исход.
Так как метанол и этанол фактически не отличить друг от друга, то большинство отравления суррогатным алкоголем связано с употреблением продукции, содержащей метиловый спирт вместо этилового.
Действие этанола на организм
А знаете ли вы?
Одноатомным спиртом является и холестерин. Его еще называют холестеролом. Холестерин – компонент желчи, играет важную роль в организме, из него синтезируются многие биологически активные соединения. Он участвует в обмене желчных кислот, в синтезе гормонов коры надпочечников и половых желез. Отложение холестерина на стенках сосудов приводит к атеросклерозу, а в желчном пузыре – к образованию желчных камней.
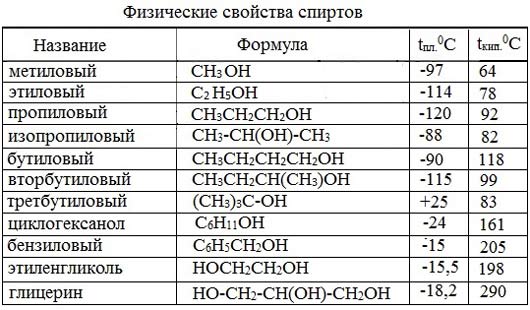
Низшие члены ряда предельных одноатомных спиртов, содержащие от одного до десяти атомов углерода, — жидкости. Высшие спирты (начиная с С11Н23ОН) при комнатной температуре — твёрдые вещества. Все алканолы легче воды, бесцветны. Низшие спирты имеют характерный алкогольный запах и жгучий вкус. 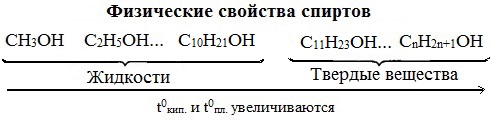
Полярность связи О-Н и наличие неподеленных пар электронов на атоме кислорода определяют физические свойства спиртов.
Температуры кипения спиртов больше температуры кипения соответствующих алканов с тем же числом атомов углерода. Это объясняется ассоциацией молекул спиртов вследствие образования межмолекулярных водородных связей.
Водородные связи возникают при взаимодействии частично положительно заряженного атома водорода одной молекулы спирта и частично отрицательно заряженного атома кислорода другой молекулы. 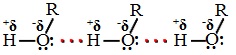
Ассоциация молекул R-OH
Из-за способности образовывать водородные связи в гомологическом ряду спиртов нет газообразных веществ.
В водных растворах водородные связи образуются не только между молекулами спиртов, но также между молекулами спиртов и воды. Образованием водородных связей между молекулами спирта и воды объясняется их хорошая растворимость в воде.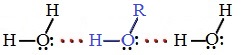
Гидратация молекул R-OH
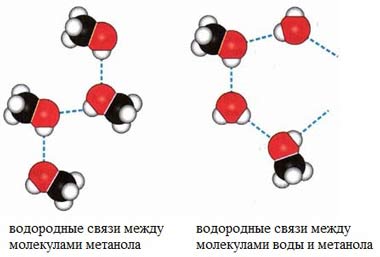
Водородные связи не прочны и при испарении спиртов легко разрываются.
Видеоопыт «Физические свойства спиртов»
С увеличением углеводородного радикала растворимость спиртов в воде уменьшается. Высшие спирты практически нерастворимы в воде. Метиловый, этиловый, н-пропиловый, изопропиловый спирты, а также этиленгликоль и глицерин смешиваются с водой в любых отношениях. Растворимость фенола в воде ограничена.
Предельные одноатомные спирты
Источник
Урок№29. Свойства спиртов. Водородная связь. Физиологическое действие спиртов на организм человека.
Физические свойства
МЕТАНОЛ (древесный спирт) – жидкость (tкип=64,5; tпл=-98; ρ =
0,793г/см3), с запахом алкоголя, хорошо растворяется в воде. Ядовит
– вызывает слепоту, смерть наступает от паралича верхних дыхательных путей.
ЭТАНОЛ (винный спирт) – б/цв жидкость, с запахом
спирта, хорошо смешивается с водой.
Первые представители гомологического ряда спиртов —
жидкости, высшие — твердые вещества. Метанол и этанол смешиваются с водой в
любых соотношениях. С ростом молекулярной массы растворимость спиртов в воде
падает. Высшие спирты практически нерастворимы в воде.
Видео-опыт: Физические свойства
спиртов
Особенности строения спиртов – спирты образуют водородные связи (обозначают точками) за
счёт функциональной группы (-ОН)
А) Водородная связь между молекулами спиртов |
Б) Водородная связь между молекулами спирта и воды |
Вывод:
1) В результате у всех спиртов более высокая
температура кипения, чем у соответствующих углеводородов, например, Т. кип.
этанола +78° С,
а Т. кип. этана –88,63° С; Т. кип. бутанола и бутана
соответственно +117,4° С и –0,5° С.
2) Способность спиртов образовывать межмолекулярные
водородные связи не только влияет на их температуры кипения, но и увеличивает
их растворимость в воде. Все алканы нерастворимы в воде, а низкомолекулярные
спирты (метиловый, этиловый, н-пропиловый и изопропиловый) растворяются
в воде неограниченно.
3) Отсутствие газов в гомологическом ряду предельных
одноатомных спиртов.
Физиологическое действие
спиртов на организм человека
ЦОР:
Действие метанола на организм
Действие этанола на организм
Образование водородных связей между молекулами спирта
ХИМИЧЕСКИЕ СВОЙСТВА:
В
химических реакциях гидроксисоединений возможно разрушение одной из двух
связей:
·
С–ОН
с отщеплением ОН-группы
·
О–Н
с отщеплением водорода
Это
могут быть реакции замещения, в которых происходит замена ОН или Н, или
реакция отщепления (элиминирования), когда образуется двойная связь.
Полярный
характер связей С–О и О–Н способствует гетеролитическому их разрыву и
протеканию реакций по ионному механизму. При разрыве связи О–Н с
отщеплением протона (Н+) проявляются кислотные свойства
гидроксисоединения, а при разрыве связи С–О – свойства основания и
нуклеофильного реагента.
С
разрывом связи О–Н идут реакции окисления, а по связи С–О – восстановления.
Таким образом, гидроксисоединения могут вступать в многочисленные реакции,
давая различные классы соединений. Вследствие доступности гидроксильных
соединений, в особенности спиртов, каждая из этих реакций является одним из
лучших способов получения определенных органических соединений.
I. Кислотно-основные
RO– + H+ ↔ ROH ↔ R+ + OH-
алкоголят-ион
Кислотные свойства
уменьшаются в ряду, а основные возрастают:
HOH → R-CH2-OH →
R2CH-OH → R3C-OH
вода первичный вторичный третичный
Кислотные свойства
С активными щелочными металлами:
2C2H5OH + 2 Na → 2C2H5ONa + H2
этилат натрия
Алкоголяты подвергаются гидролизу, это доказывает,
что у воды более сильные кислотные свойства
C2H5ONa + H2O ↔ C2H5OH +
NaOH
Основные свойства
С галогенводородными кислотами:
C2H5OH + HBr
H2SO4(конц)↔ C2H5Br
+ H2O
бромэтан
Лёгкость протекания реакции зависит от природы галогенводорода и спирта – увеличение реакционной
способности происходит в следующих рядах:
HF < HCl < HBr < HI
первичные <
вторичные < третичные
II. Окисление
1). В присутствии
окислителей [O] – K2Cr2O7
или KMnO4 спирты окисляются до карбонильных
соединений:
Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот.
При окислении вторичных спиртов образуются кетоны.
Третичные спирты более устойчивы к
действию окислителей. Они окисляются только в жестких условиях (кислая
среда, повышенная температура), что приводит к разрушению углеродного
скелета молекулы и образованию смеси продуктов (карбоновых кислот и
кетонов с меньшей молекулярной массой).
В кислой среде:
Для первичных и
вторичных одноатомных спиртов качественной реакцией является взаимодействие их
с кислым раствором дихромата калия. Оранжевая окраска гидратированного иона Cr2O72-
исчезает и появляется зеленоватая окраска, характерная для иона Cr3+ .
Эта смена окраски позволяет определять даже следовые количества спиртов.
CH3- OH + K2Cr2O7 + 4H2SO4
→ CO2 + K2SO4 + Cr2(SO4)3
+ 6H2O
3CH3-CH2-OH + K2Cr2O7
+ 4H2SO4 → 3CH3COH + K2SO4
+ Cr2(SO4)3 + 7H2O
В более жёстких
условиях окисление первичных спиртов идёт сразу до карбоновых кислот:
3CH3-CH2-OH + 2K2Cr2O7
+ 8H2SO4 t→ 3CH3COOH + 2K2SO4
+ 2Cr2(SO4)3 + 11H2O
Третичные спирты
устойчивы к окислению в щелочной и нейтральной среде. В жёстких условиях (при
нагревании, в кислой среде) они окисляются с расщеплением связей С-С и
образованием кетонов и карбоновых кислот.
В нейтральной среде:
CH3 – OH + 2KMnO4 →K2CO3 + 2MnO2 + 2H2O, а остальные спирты до солей соответствующих
карбоновых кислот.
2). Качественная реакция на первичные спирты!
СH3-CH2-OH
+ CuO 300°,Cu → CH3-C=O
+ Cu + H2O
│
H
(ацетальдегид
– запах листвы)
3). Горение(с увеличением массы углеводородного радикала –
пламя становится всё более коптящим)
CnH2n+1-OH
+ O2t → CO2
+ H2O + Q
III. Реакции
отщепления
1)
Внутримолекулярная дегидратация
CH3-CH2-CH(OH)-CH3 t>140,H2SO4(к)→ CH3-CH=CH-CH3 + H2O
бутанол-2 бутен-2
В тех случаях, когда возможны 2 направления реакции,
например:
дегидратация
идет преимущественно в направлении I, т.е. по правилу Зайцева – с образованием более замещенного алкена. Правило
Зайцева: Водород отщепляется от
наименее гидрированного атома углерода соседствующего с углеродом, несущим
гидроксил.
2) Межмолекулярная дегидратация
2C2H5OH t<140,H2SO4(к)→ С2H5-O-C2H5 + H2O
простой эфир
– при переходе
от первичных спиртов к третичным увеличивается склонность к отщеплению воды и образованию алкенов;
уменьшается способность образовывать простые эфиры.
3)
Реакция дегидрирование и дегидратация предельных одноатомных спиртов – реакция С.В.
Лебедева
2C2H5OH 425,ZnO,Al2O3→ CH2=CH-CH=CH2 + H2
+ 2H2O
IV. Реакции
этерификации
Спирты
вступают в реакции с минеральными и органическими кислотами, образуя сложные
эфиры. Реакция обратима (обратный процесс – гидролиз сложных эфиров).
ЦОР:
Качественная реакция на многоатомные спирты
ТРЕНАЖЁРЫ:
Химические свойства предельных одноатомных спиртов
Видео-опыты:
Горение спиртов
Взаимодействие этилового спирта с металлическим натрием
Взаимодействие этилового спирта с бромоводородом
Качественная реакция на
этанол
Окисление этилового спирта
оксидом меди (II)
Окисление этилового спирта
раствором перманганата калия
Окисление этилового спирта
кристаллическим перманганатом калия
Каталитическое окисление
этанола
Окисление этанола (тест на
алкоголь)
ВАРИАНТ проведения урока:
1.Организационный
момент: класс разбивается на группы
4-5человек.
Каждая группа получает карточку с
понятием
классификация спиртов
номенклатура (дать название по формуле)
номенклатура (составить формулу по
названию)изомерия.
Строение.
изученном на прошлом уроке и готовит
к нему презентацию на доске или листе
формата А3.После повторения темы прошлого урока
переходим к изучению нового материала.
2. Из строения молекул вытекают физические
свойства спиртов с которыми мы с вами
сейчас познакомимся по слайдам данной
презентации.
Первый вариант: В молекулах У атома О есть свободная Второй вариант: https://files.school-collection.edu.ru/dlrstore/bed30093-8cff-11db-b606-0800200c9a66/ch10_17_08.swf Водородная связь приблизительно | Слайд 17 ЦОР |
Изучив физические свойства Однако это соответствие Например, t0 Такое различие в значениях | Слайд 18 |
Все спирты легче воды. Высшие Метанол Единая Высшие Спирты Бутанол-1 2-метилпропанол | Слайд 19 ЦОР |
Основными Метанол смерть Этанол с | Слайд20 |
Изучение Каждая группа 1.Кислотные 2.Основные 3.Окисление 4.Дегидратация 5.Этерификация Подведение 1.Окисление https://files.school-collection.edu.ru/dlrstore/e4ae4b80-78f8-6aa5-1967-3de11a099cf3/index.htm 2.Окисление https://files.school-collection.edu.ru/dlrstore/00fce0c1-7bc5-f654-ebed-e5ed0d2c3ef2/index.htm 3.Взаимодействие https://files.school-collection.edu.ru/dlrstore/cfc4d7ea-bf4c-2822-0d33-b25b526dac4a/index.htm 4.Взаимодействие https://files.school-collection.edu.ru/dlrstore/2e02dc8c-ac9d-7c17-cb97-f894219639f2/index.htm 5. https://files.school-collection.edu.ru/dlrstore/32bf0bfc-40fa-3878-6d92-593fd826df31/index.htm 6.Получение https://files.school-collection.edu.ru/dlrstore/2638df79-e8e5-0109-e2e2-cd2fa153a7bb/index.htm Проверку https://files.school-collection.edu.ru/dlrstore/bed30095-8cff-11db-b606-0800200c9a66/ch10_17_10.swf | Работа в группах ЦОР |
Метанол | Слайд 21 |
Этиловый Алкоголь желудок При Экспериментами и наблюдениями над Смертельный Если сделать подсчёт для водки (40°), | Слайд 22 |
Домашнее
задание: §21 (без получения и
применения), упр.9 и 11, задачи 2, 4*, с. 88.
Источник
