Что такое идеальный газ какими свойствами он обладает

Анна Кустова
22 декабря 2016 · 15,8 K
Идеальным называют газ размерами молекул которого и взаимодействием между ними можно пренебречь . Большинство газов вплоть до давления приблизительно 10 атм. можно рассматривать как идеальные. Создана данная идеальная абстракция для упрощения расчётов и выделения основных параметров таких как давление , объём , температура .
Так же думаю стоит рассказать о вещи слегка противоположной “идеальному газу ” . Называется она “Реальные газы “. Рассматривая идеальные газы мы пренебрегали размером молекул и их взаимодействиями между собой . Границей отличия установили давление порядка 10 атмосфер . При более высоких давлениях молекулы сближаются , между ними возникает взаимодействие . Если упростить то объём всех молекул становится таким же как и объём сосуда в котором они находятся под давлением и в этом случае пренебрегать им уже нельзя .
Добавлю только что первое описывается уравнением Клапейрона-Менделеева
а второе тем же уравнением , но с поправками Ван дер Ваальса
Если очень просто, то это упрощенное видение любого газа, используемое для расчета. Все объекты, что находятся в материальном мире, испытывают воздействия многочисленных сил и являются участниками многочисленных процессов. Однако большая часть этих сил и процессов оказывают слишком малое влияние на состояние объекта и если перед физиком не стоит… Читать далее
Физик-теоретик, PhD студент в Университете Уппсалы, Швеция
На этом примере мы можем детально рассмотреть, как математические модели трансформируются в физические модели.
Прежде всего, идеальный газ — это математическая модель газа. И с математической точки зрения, идея очень проста: атомы (или молекулы) этого самого газа “не видят” друг друга. То есть каждая частица воспринимает сосуд как совершенно пустой… Читать далее
Вы всё очень хорошо описываете и мне нравятся ваши ответы , но мне кажется можно было бы привести в пример… Читать дальше
Объясните простыми словами, что такое квантовая суперпозиция?
Психолог, сертифицированный гештальт-терапевт. Telegram: @introvert172
А ещё я…
Суперпозиция – это наложение состояние одно на другое, т.е. существование одновременно в нескольких состояниях. Если фотон или электрон в суперпозиции – он делает сразу все одновременно. Он и частица и волна, находится одновременно в нескольких местах, сам об себя ударяется и интерферирует – в-общем, творит черт знает что. Но все меняется как только приходит наблюдатель. С ним не забалуешь! Фотон в курсе, и ему приходится подчиниться – при появлении измеряющей аппаратуры и строгого наблюдателя, фотон тут же дисциплинируется и начинает вести себя по какому-то одному сценарию. Это называется “схлопывание суперпозиции”, или “коллапс волновой функции”. Именно присутствие наблюдателя заставляет хаос исчезнуть и превратиться в один из возможных вариантов.
На микроуровне это работает. А работает ли на макро? Эрвин Шредингер предложил мысленный эксперимент с котом – если кот лежит в закрытой коробке и мы его не наблюдаем, то он как бы в суперпозиции, то есть одновременно и жив и мертв. Этот эксперимент принято считать демонстрацией того, что суперпозиция не работает на макроуровне (ведь не может же кот одновременно быть живым и мертвым). Хотя, непонятно, почему это не работает и не может. Да, он одновременно и жив и мертв до тех пор пока не произойдет что-либо, что схлопнет суперпозицию – кот мяукнет, мы откроем ящик и т.п. То, чего мы не наблюдаем, либо не существует, либо существует сразу в множестве вариантов. Так считают солипсисты, и опровергнуть их суждение невозможно. Так и живем.
Прочитать ещё 4 ответа
Каковы законы идеального газа?
к.п.н., широкий круг интересов
Идеальный газ – это газ, для которого можно пренебречь размерами молекул и их взаимодействием. Кислород, азот, водород при обычных условиях приблизительно являются идеальными газами.
Идеальный газ характеризуется следующими макроскопическими величинами: давление – p, температура – Т, объем – V. С точки зрения молекулярно-кинетической теории давление и температура идеального газа связаны со средней кинетической энергией молекул газа. Основные законы идеального газа связывают эти величины между собой.
Связь давления идеального газа со средней кинетической энергией: p = 2/3*n*E, где n – концентрация молекул.
Связь температуры со средней кинетической энергией: E = 3/2*k*T, где k – постоянная Больцмана.
Связь давления, температуры и объема: p*V = (m/M)* R*T (уравнение Менделеева – Клапейрона), где m – масса газа, М – молярная масса, R – молярная газовая постоянная.
Законы для изопроцессов, являющимися следствиями из уравнения Менделеева – Клапейрона
4.1. изобарный процесс (p, m, M = const.) – V/T = const.
4.2. изотермический процесс (Т, m, M = const.) – pV = const.
4.3. изохорный процесс (V, m, M = const.) – p/T = const.
Прочитать ещё 1 ответ
Угарный газ легче или тяжелее воздуха?
Что есть воздух? Смесь кислорода, азота и водяного пара. Угарный газ такой же как азот, легче кислорода, но тяжелее водяного пара.
Если CO появляется в результате неполного сгорания, то с тёплым воздухом он уходит к потолку не успев ещё полностью размешаться. При установке под потолком несколько выше вероятность ложных срабатываний на локальные неоднородности концентрации.
Для совмещённых датчиков метан/CO или пропан/CO разумно ставить также, как и простые датчики: метана под потолок, а пропана около пола. Датчик только CO – на уровне головы.
Прочитать ещё 3 ответа
Объясните принцип неопределённости Гейзенберга простыми словами?
магистр математики; преподаватель математики в школе и на младших курсах
Что-то мне не понравились ответы, а еще и в комментах наезжают. Так что давайте попробую.
Основная проблема квантовой механики следующая: рассматриваемые частички настолько малы, что попытка измерить их характеристики ведет к изменению этих или других характеристик. (Пусть многие спорят, но это одна из первых фундаментальных идей)
Поясню на примере. Вот мы смотрим на мяч. Это значит, что откуда-то там на него летит много фотонов, они от него отскакивают и попадают к нам в глаз. Таким образом мы видим мяч в таком-то месте.
Теперь представьте, что мы странные роботы, которые бросают и ловят бильярдные шары. Мы пытаемся “увидеть” при помощи бильярдных шаров исходный мяч: то есть просто кидаемся шарами в мяч и смотрим, какие отскочили и куда. Но тут возникает маленькая проблема. Бильярдные шары довольно тяжелые, и каждый раз, когда мы попадаем в мяч, они его чуть-чуть разгоняют. Чем точнее мы хотим измерить расположение мяча, тем больше нам надо попавших в него шаров, тем сильнее мяч разгоняется.
Теперь попробуем посмотреть на электрон. Тут возникает та же проблема. Мы, конечно, пускаем в него фотоны, но фотоны по сравнению с электроном уже довольно крупные и начинают его двигать. Таким образом, чем точнее мы пытаемся определить положение электрона, тем сильнее меняем его скорость (но если по честному, то импульс).
Принцип неопределенности Гейзенберга говорит, что 1) это не наши методы плохи, а так устроена природа: какой бы опыт для определения положения электрона мы бы ни придумали, мы будем изменять импульс; 2) есть колличественная оценка, как сильно будет меняться импульс, и она не утешает. Если интересно, то количественная оценка: (точность измерения координаты)*(точность измерения импульса)≥ (постоянная Планка):(4*пи)
Надеюсь, хуже не стало.
Прочитать ещё 4 ответа
Источник
Как известно, многие вещества в природе могут находиться в трех агрегатных состояниях: твердом, жидком и газообразном.
Учение о свойствах вещества в различных агрегатных состояниях основывается на представлениях об атомно-молекулярном строении материального мира. В основе молекулярно-кинетической теории строения вещества (МКТ) лежат три основных положения:
- все вещества состоят из мельчайших частиц (молекул, атомов, элементарных частиц), между которыми есть промежутки;
- частицы находятся в непрерывном тепловом движении;
- между частицами вещества существуют силы взаимодействия (притяжения и отталкивания); природа этих сил электромагнитная.
Значит, агрегатное состояние вещества зависит от взаимного расположения молекул, расстояния между ними, сил взаимодействия между ними и характера их движения.
Сильнее всего проявляется взаимодействие частиц вещества в твердом состоянии. Расстояние между молекулами примерно равно их собственным размерам. Это приводит к достаточно сильному взаимодействию, что практически лишает частицы возможности двигаться: они колеблются около некоторого положения равновесия. Они сохраняют форму и объем.
Свойства жидкостей также объясняются их строением. Частицы вещества в жидкостях взаимодействуют менее интенсивно, чем в твердых телах, и поэтому могут скачками менять свое местоположение – жидкости не сохраняют свою форму – они текучи. Жидкости сохраняют объем.
Газ представляет собой собрание молекул, беспорядочно движущихся по всем направлениям независимо друг от друга. Газы не имеют собственной формы, занимают весь предоставляемый им объем и легко сжимаются.
Существует еще одно состояние вещества – плазма. Плазма – частично или полностью ионизованный газ, в котором плотности положительных и отрицательных зарядов практически одинаковы. При достаточно сильном нагревании любое вещество испаряется, превращаясь в газ. Если увеличивать температуру и дальше, резко усилится процесс термической ионизации, т. е. молекулы газа начнут распадаться на составляющие их атомы, которые затем превращаются в ионы.
Модель идеального газа. Связь между давлением и средней кинетической энергией.
Для выяснения закономерностей, которым подчиняется поведение вещества в газообразном состоянии, рассматривается идеализированная модель реальных газов – идеальный газ. Это такой газ, молекулы которого рассматриваются как материальные точки, не взаимодействующие друг с другом на расстоянии, но взаимодействующие друг с другом и со стенками сосуда при столкновениях.
Идеальный газ – это газ, взаимодействие между молекулами которого пренебрежимо мало. (Ек>>Ер)
Идеальный газ – это модель, придуманная учеными для познания газов, которые мы наблюдаем в природе реально. Она может описывать не любой газ. Не применима, когда газ сильно сжат, когда газ переходит в жидкое состояние. Реальные газы ведут себя как идеальный, когда среднее расстояние между молекулами во много раз больше их размеров, т.е. при достаточно больших разрежениях.
Свойства идеального газа:
- расстояние между молекулами много больше размеров молекул;
- молекулы газа очень малы и представляют собой упругие шары;
- силы притяжения стремятся к нулю;
- взаимодействия между молекулами газа происходят только при соударениях, а соударения считаются абсолютно упругими;
- молекулы этого газа двигаются беспорядочно;
- движение молекул по законам Ньютона.
Состояние некоторой массы газообразного вещества характеризуют зависимыми друг от друга физическими величинами, называемыми параметрами состояния. К ним относятся объем V, давление p и температура T.
Объем газа обозначается V. Объем газа всегда совпадает с объемом того сосуда, который он занимает. Единица объема в СИ м3.
Давление – физическая величина, равная отношению силы F, действующей на элемент поверхности перпендикулярно к ней, к площади S этого элемента.
p = F/S Единица давления в СИ паскаль [Па]
До настоящего времени употребляются внесистемные единицы давления:
техническая атмосфера 1 ат = 9,81-104 Па;
физическая атмосфера 1 атм = 1,013-105 Па;
миллиметры ртутного столба 1 мм рт. ст.= 133 Па;
1 атм = = 760 мм рт. ст. = 1013 гПа.
Как возникает давление газа? Каждая молекула газа, ударяясь о стенку сосуда, в котором она находится, в течение малого промежутка времени действует на стенку с определенной силой. В результате беспорядочных ударов о стенку сила со стороны всех молекул на единицу площади стенки быстро меняется со временем относительно некоторой (средней) величины.
Давление газа возникает в результате беспорядочных ударов молекул о стенки сосуда, в котором находится газ.
Используя модель идеального газа, можно вычислить давление газа на стенку сосуда.
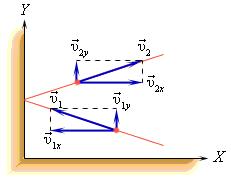
В процессе взаимодействия молекулы со стенкой сосуда между ними возникают силы, подчиняющиеся третьему закону Ньютона. В результате проекция υx скорости молекулы, перпендикулярная стенке, изменяет свой знак на противоположный, а проекция υy скорости, параллельная стенке, остается неизменной.
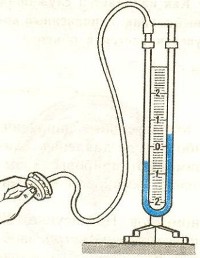
Приборы, измеряющие давление, называют манометрами. Манометры фиксируют среднюю по времени силу давления, приходящуюся на единицу площади его чувствительного элемента (мембраны) или другого приемника давления.
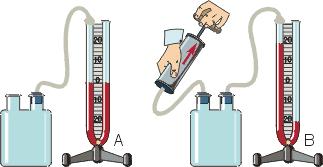
Жидкостные манометры:
- открытый – для измерения небольших давлений выше атмосферного
- закрытый – для измерения небольших давлений ниже атмосферного, т.е. небольшого вакуума

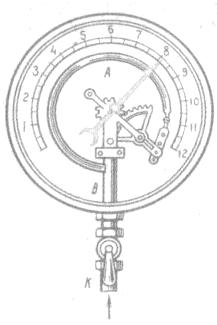
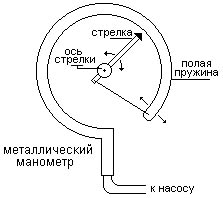
Металлический манометр – для измерения больших давлений.
Основной его частью является изогнутая трубка А, открытый конец которой припаян к трубке В, через которую поступает газ, а закрытый – соединен со стрелкой. Газ поступает через кран и трубку В в трубку А и разгибает её. Свободный конец трубки, перемещаясь, приводит в движение передающий механизм и стрелку. Шкала градуирована в единицах давления.
Основное уравнение молекулярно-кинетической теории идеального газа.
Основное уравнение МКТ: давление идеального газа пропорционально произведению массы молекулы, концентрации молекул и среднему квадрату скорости движения молекул
p = 1/3·m0·n·v2
m0 – масса одной молекулы газа;
n = N/V – число молекул в единице объема, или концентрация молекул;
v2 – средняя квадратичная скорость движения молекул.
Так как средняя кинетическая энергия поступательного движения молекул E = m0*v2/2, то домножив основное уравнение МКТ на 2, получим p = 2/3· n·(m0· v2)/2 = 2/3·E·n
p = 2/3·E·n
Давление газа равно 2/3 от средней кинетической энергии поступательного движения молекул, которые содержатся в единичном объеме газа.
Так как m0·n = m0·N/V = m/V = ρ, где ρ – плотность газа, то имеем p = 1/3· ρ· v2
Объединенный газовый закон.
Макроскопические величины, однозначно характеризующие состояние газа, называют термодинамическими параметрами газа.
Важнейшими термодинамическими параметрами газа являются его объем V, давление р и температура Т.
Всякое изменение состояния газа называется термодинамическим процессом.
В любом термодинамическом процессе изменяются параметры газа, определяющие его состояние.
Соотношение между значениями тех или иных параметров в начале и конце процесса называется газовым законом.
Газовый закон, выражающий связь между всеми тремя параметрами газа называется объединенным газовым законом.
p = nkT
Соотношение p = nkT связывающее давление газа с его температурой и концентрацией молекул, получено для модели идеального газа, молекулы которого взаимодействуют между собой и со стенками сосуда только во время упругих столкновений. Это соотношение может быть записано в другой форме, устанавливающей связь между макроскопическими параметрами газа – объемом V, давлением p, температурой T и количеством вещества ν. Для этого нужно использовать равенства
где n – концентрация молекул, N – общее число молекул, V – объем газа
Тогда получим или
Так как при постоянной массе газа N остается неизменным, то Nk – постоянное число, значит
При постоянной массе газа произведение объема на давление, деленное на абсолютную температуру газа, есть величина одинаковая для всех состояний этой массы газа.
Уравнение, устанавливающее связь между давлением, объемом и температурой газа было получено в середине XIX века французским физиком Б. Клапейроном и часто его называют уравнением Клайперона.
Уравнение Клайперона можно записать в другой форме.
p = nkT,
учитывая, что
Здесь N – число молекул в сосуде, ν – количество вещества, NА – постоянная Авогадро, m – масса газа в сосуде, M – молярная масса газа. В итоге получим:
Произведение постоянной Авогадро NА на постоянную Больцмана k называется универсальной (молярной) газовой постоянной и обозначается буквой R.
Ее численное значение в СИ R = 8,31 Дж/моль·К
Соотношение
называется уравнением состояния идеального газа.
В полученной нами форме оно было впервые записано Д. И. Менделеевым. Поэтому уравнение состояния газа называется уравнением Клапейрона–Менделеева.`
Для одного моля любого газа это соотношение принимает вид: pV=RT
Установим физический смысл молярной газовой постоянной. Предположим, что в некотором цилиндре под поршнем при температуре Е находится 1 моль газа, объем которого V. Если нагреть газ изобарно (при постоянном давлении) на 1 К, то поршень поднимется на высоту Δh, а обьем газа увеличится на ΔV.
Запишем уравнение pV=RT для нагретого газа: p ( V + ΔV ) = R (T + 1)
и вычтем из этого равенства уравнение pV=RT , соответствующее состоянию газа до нагревания. Получим pΔV = R
ΔV = SΔh, где S – площадь основания цилиндра. Подставим в полученное уравнение:
pSΔh = R
pS = F – сила давления.
Получим FΔh = R, а произведение силы на перемещение поршня FΔh = А – работа по перемещению поршня, совершаемая этой силой против внешних сил при расширении газа.
Таким образом, R = A.
Универсальная (молярная) газовая постоянная численно равна работе, которую совершает 1 моль газа при изобарном нагревании его на 1 К.
Источник
История
Клапейрон первым сформулировал уравнение идеального газа
Существование атмосферного давления было показано рядом экспериментов в XVII веке. Одним из первых доказательств гипотезы стали магдебургские полушария, сконструированные немецким инженером Герике. Из сферы, образованной полушариями, выкачивался воздух, после чего их было трудно разъединить в силу внешнего давления воздуха. Другой эксперимент в рамках исследования природы атмосферного давления поставил Роберт Бойль. Он состоял в том, что если запаять изогнутую стеклянную трубку с короткого конца, а в длинное колено постоянно подливать ртуть, она не поднимется до верха короткого колена, поскольку воздух в трубке, сжимаясь, будет уравновешивать давление ртути на него. К 1662 году данные опыты позволили прийти к формулировке закона Бойля — Мариотта[1].
В 1802 году Гей-Люссаком был впервые опубликован в открытой печати закон объёмов (называемый в русскоязычной литературе законом Гей-Люссака) [2], однако сам Гей-Люссак считал, что открытие было сделано Жаком Шарлем в неопубликованной работе, относящейся к 1787 году. Независимо от них закон был открыт в 1801 году английским физиком Джоном Дальтоном. Кроме того, качественно закон был описан французом Гийомом Амонтоном в конце XVII века. Впоследствии он уточнил свои эксперименты и установил, что при изменении температуры от 0 до 100 °C объём воздуха линейно увеличивается на 0,375. Проведя аналогичные опыты с другими газами, Гей-Люссак установил, что это число одинаково для всех газов, несмотря на общепринятое мнение, что разные газы расширяются при нагревании различным образом.
В 1834 году из комбинации этих законов Клапейрон смог составить уравнение идеального газа[3]. Тот же закон, уже с использованием молекулярно-кинетической теории был сформулирован Августом Крёнигом в 1856 году[4] и Рудольфом Клаузиусом в 1857 году[5].
Классический идеальный газ
Объём идеального газа линейно зависит от температуры при постоянном давлении
Свойства идеального газа на основе молекулярно-кинетических представлений определяются исходя из физической модели идеального газа, в которой приняты следующие допущения:
В этом случае частицы газа движутся независимо друг от друга, давление газа на стенку равно сумме импульсов в единицу времени, переданной при столкновении частиц со стенкой, энергия — сумме энергий частиц газа.
По эквивалентной формулировке идеальный газ – такой газ, который одновременно подчиняется закону Бойля — Мариотта и Гей-Люссака[7], то есть:
где — давление, — абсолютная температура. Свойства идеального газа описываются уравнением Менделеева — Клапейрона
,
где – универсальная газовая постоянная, — масса, — молярная масса.
или
где — концентрация частиц, — постоянная Больцмана.
Для любого идеального газа справедливо соотношение Майера:
где — универсальная газовая постоянная, — молярная теплоемкость при постоянном давлении, — молярная теплоемкость при постоянном объёме.
Применение теории идеального газа
Физический смысл температуры газа
Так как давление молекул газа на стенку определяется по формуле , где – средняя кинетическая энергия поступательного движения молекул газа. Подставив это в уравнение Менделеева — Клапейрона получаем, что температура пропорциональна .
Распределение Больцмана

Распределение скоростей для 106 молекул кислорода при -100, 20, 600 градусах Цельсия
Равновесное распределение частиц классического идеального газа по состояниям следует из уравнения Менделеева — Клапейрона, из которого можно вывести распределение газа в поле потенциальной энергии. Это распределение приводит к распределению Больцмана:
где — среднее число частиц, находящихся в -ом состоянии с энергией , а константа определяется условием нормировки:
где — полное число частиц.
Распределение Больцмана является предельным случаем (квантовые эффекты пренебрежимо малы) распределений Ферми — Дирака и Бозе — Эйнштейна, и, соответственно, классический идеальный газ является предельным случаем Ферми-газа и Бозе-газа.
Адиабатический процесс
График адиабаты (жирная линия) на диаграмме для газа.
— давление газа;
— объём.
C помощью модели идеального газа можно предсказать изменение параметров состояния газа при адиабатическом процессе. Перепишем уравнение в виде:
Продифференцировав обе части, получаем:
Затем, если подставить в это уравнение значение работы и внутренней энергии газа, получим Уравнение Пуассона.
Квантовый идеальный газ
Понижение температуры и увеличение плотности газа может привести к ситуации, когда среднее расстояние между частицами становится соизмеримым с длиной волны де Бройля для этих частиц, что приводит к переходу от классического к квантовому идеальному газу (см. Вырожденный газ). В таком случае поведение газа зависит от спина частиц: в случае полуцелого спина (фермионы) действует статистика Ферми — Дирака (Ферми-газ), в случае целого спина (бозоны) — статистика Бозе — Эйнштейна (Бозе-газ).
Ферми-газ
Для фермионов действует принцип Паули, запрещающий двум тождественным фермионам находиться в одном квантовом состоянии. Вследствие этого при абсолютном нуле температуры импульсы частиц и, соответственно, давление и плотность энергии Ферми-газа отличны от нуля и пропорциональны числу частиц в единице объёма. Существует верхний предел энергии, который могут иметь частицы Ферми-газа при абсолютном нуле (Энергия Ферми ). Если энергия теплового движения частиц Ферми-газа значительно меньше энергии Ферми, то это состояние называют вырожденным газом.
Особенностью Ферми-газов является крайне слабая зависимость давления от температуры: в нерелятивистском случае давление , в релятивистском — .
Примерами Ферми-газов являются электронный газ в металлах, сильнолегированных и вырожденных полупроводниках, вырожденный газ электронов в белых карликах и вырожденный газ нейтронов в нейтронных звёздах.
Бозе-газ

Распределение скоростей атомов рубидия вблизи абсолютного нуля.Слева – распределение до образования конденсата, в центре – после образования, справа – после испарения газообразной составляющей и появления чистого конденсата
Так как на бозоны могут быть строго тождественны друг другу[8][9] и, соответственно, принцип Паули на них не распространяется, то при снижении температуры Бозе-газа ниже некоторой температуры возможен переход бозонов на наинизший энергетический уровень с нулевым импульсом, то есть образование конденсата Бозе — Эйнштейна. Поскольку давление газа равно сумме импульсов частиц, переданной стенке в единицу времени, при давление Бозе-газа зависит только от температуры.Этот эффект в 1995 году наблюдался экспериментально, а в 2001 году авторам эксперимента была присуждена Нобелевская премия[10].
Примерами Бозе-газов являются различного рода газы квазичастиц (слабых возбуждений) в твёрдых телах и жидкостях, сверхтекучая компонента гелия II, конденсата Бозе — Эйнштейна куперовских электронных пар при сверхпроводимости. Примером ультрарелятивистского Бозе-газа является фотонный газ[8][9].
См. также
- Реальный газ
Примечания
- ↑ Кудрявцев, 1956, с. 185—186
- ↑ Gay-Lussac, J. L. Recherches sur la dilatation des gaz et des vapeurs // Annales de chimie. — 1802. — Vol. XLIII. — P. 137.
- ↑ Clapeyron, E. (1834). «Mémoire sur la puissance motrice de la chaleur». Journal de l’École Polytechnique XIV: 153–90. (фр.) Facsimile at the Bibliothèque nationale de France (pp. 153–90).
- ↑ Krönig, A. (1856). «Grundzüge einer Theorie der Gase». Annalen der Physik 99 (10): 315–22. DOI:10.1002/andp.18561751008. Bibcode: 1856AnP…175..315K. (нем.) Facsimile at the Bibliothèque nationale de France (pp. 315–22).
- ↑ Clausius, R. (1857). «Ueber die Art der Bewegung, welche wir Wärme nennen». Annalen der Physik und Chemie 176 (3): 353–79. DOI:10.1002/andp.18571760302. Bibcode: 1857AnP…176..353C. (нем.) Facsimile at the Bibliothèque nationale de France (pp. 353–79).
- ↑ Коган М. Н. Динамика разреженного газа (кинетическая теория. М., 1967)
- ↑ 1 2 Савельев, 2001, с. 24
- ↑ 1 2 Einstein A. (1924). «Quantentheorie des einatomigen idealen Gases». Sitzungsberichte der Preussischen Akademie der Wissenschaften (Berlin), Physikalisch-mathematische Klasse 1924: 261—267. (нем.)
- ↑ 1 2 Einstein A. (1925). «Quantentheorie des einatomigen idealen Gases, Zweite Abhandlung». Sitzungsberichte der Preussischen Akademie der Wissenschaften (Berlin), Physikalisch-mathematische Klasse 1925: 3—14. (нем.)
- ↑ Anderson, M. H.; Ensher, J. R.; Matthews, M. R.; Wieman, C. E.; Cornell, E. A. (1995). «Observation of Bose–Einstein Condensation in a Dilute Atomic Vapor». Science 269: 198—201. DOI:10.1126/science.269.5221.198. PMID 17789847. (англ.)
Литература
- Савельев И. В. Курс общей физики:Молекулярная физика и термодинамика. — М.: Астрель, 2001. — Т. 3. — 208 с. — 7000 экз. — ISBN 5-17-004585-9
- П. С. Кудрявцев История физики. — М.: Гос. учебно-педагог. изд-во, 1956. — Т. 1. От античной физики до Менделеева. — 564 с. — 25 000 экз.
- V.P.Maslov, Mathematical conception of the gas theory
Категории:
- Термодинамика
- Статистическая физика
- Математические модели
- Идеализации в физике
- Газ
Wikimedia Foundation.
2010.
Смотреть что такое “Идеальный газ” в других словарях:
ИДЕАЛЬНЫЙ ГАЗ — теор. модель газа, в к рой не учитывается вз ствие ч ц газа (ср. кинетич. энергия ч ц много больше энергий их вз ствия). Различают классич. и квант. И. г. Св ва классического И. г. описываются законами классич. физики Клапейрона уравнением и его… … Физическая энциклопедия
идеальный газ — Невязкий нетеплопроводный газ, при движении которого возникают только нормальные напряжения. Примечание В идеальном газе вектор силы, действующей на любую выбранную в нем площадку, ортогонален к этой площадке. [ГОСТ 23281 78] Тематики… … Справочник технического переводчика
ИДЕАЛЬНЫЙ ГАЗ — идеализированная модель газа; в идеальном газе силы взаимодействия между частицами (атомами, молекулами) пренебрежимо малы. К идеальному газу близки разреженные реальные газы при температурах, далеких от температуры их конденсации. Зависимость… … Большой Энциклопедический словарь
идеальный газ — идеализированная модель газа; в идеальном газе силы взаимодействия между частицами (атомами, молекулами) пренебрежимо малы. К идеальному газу близки разреженные реальные газы при температурах, далёких от температуры их конденсации. Зависимость… … Энциклопедический словарь
идеальный газ — idealiosios dujos statusas T sritis fizika atitikmenys: angl. ideal gas; perfect gas vok. ideales Gas, n; vollkommenes Gas, n rus. идеальный газ, m; совершенный газ, m pranc. gaz idéal, m; gaz parfait, m … Fizikos terminų žodynas
Идеальный газ — понятие физики, в узком смысле, теоретическая модель газа, в которой пренебрегают размерами и взаимодействиями частиц газа и учитывают лишь их упругие столкновения. В широкой трактовке, идеальный газ состоит из частиц, представляющих собой… … Концепции современного естествознания. Словарь основных терминов
идеальный газ — idealiosios dujos statusas T sritis Standartizacija ir metrologija apibrėžtis Dujos, kurių dalelės nesąveikauja tarpusavyje. atitikmenys: angl. ideal gas; perfect gas vok. ideales Gas, n rus. идеальный газ, m pranc. gaz parfait, m … Penkiakalbis aiškinamasis metrologijos terminų žodynas
идеальный газ — idealiosios dujos statusas T sritis chemija apibrėžtis Dujos, kurių molekulės tarpusavyje nesąveikauja. atitikmenys: angl. ideal gas; perfect gas rus. идеальный газ … Chemijos terminų aiškinamasis žodynas
идеальный газ — idealiosios dujos statusas T sritis Energetika apibrėžtis Dujos, kurių dalelės nesąveikauja. Joms galioja idealiųjų dujų lygtis (Klapeirono lygtis). atitikmenys: angl. ideal gas vok. ideales Gas, n rus. идеальный газ, m pranc. gaz idéal, m … Aiškinamasis šiluminės ir branduolinės technikos terminų žodynas
Идеальный газ — газ, в котором взаимодействием молекул можно пренебречь, а обмен энергией совершается только при упругих столкновениях молекул. К идеальному газу близки разреженные газы, вдали от температуры их конденсации … Начала современного естествознания
Источник
