Азот какое свойство имеет

Азот – неметаллический элемент Va группы периодической таблицы Д.И. Менделеева. Составляет 78% воздуха. Входит в состав
белков, являющихся важной частью живых организмов.
Температура кипения азота составляет -195,8 °C. Однако быстрого замораживания объектов, которое часто демонстрируют в
кинофильмах, не происходит. Даже для заморозки растения нужно продолжительное время, это связано с низкой теплоемкостью
азота.

Общая характеристика элементов Va группы
От N к Bi (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств.
Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Азот, фосфор и мышьяк являются неметаллами, сурьма – полуметалл, висмут – металл.

Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np3:
- N – 2s22p3
- P – 3s23p3
- As – 4s24p3
- Sb – 5s25p3
- Bi – 6s26p3
Основное и возбужденное состояние азота
При возбуждении атома азота электроны на s-подуровне распариваются и переходят на p-подуровень. Поскольку азот находится во втором периоде, то
3ий уровень у него отсутствует, что проявляется в особенностях электронной конфигурации возбужденного состояния.
Сравнивая возможности перемещения электронов у азота и фосфора, разница становится очевидна.

Природные соединения
В природе азот встречается в виде следующих соединений:
- Воздух – во вдыхаемом нами воздухе содержится 78% азота
- Азот входит в состав нуклеиновых кислот, белков
- KNO3 – индийская селитра, калиевая селитра
- NaNO3 – чилийская селитра, натриевая селитра
- NH4NO3 – аммиачная селитра (искусственный продукт, в природе не встречается)
Селитры являются распространенными азотными удобрениями, которые обеспечивают быстрый рост и развитие растений, повышают урожайность. Однако,
следует строго соблюдать правила их применения, чтобы не превысить допустимые концентрации.

Получение
В промышленности азот получают путем сжижения воздуха. В дальнейшем путем испарения их сжиженного воздуха получают азот.
Применяют и метод мембранного разделения, при котором через специальный фильтр из сжатого воздуха удаляют кислород.

В лаборатории методы не столь экзотичны. Чаще всего получают азот разложением нитрита аммония
NH4NO2 → (t) N2 + H2O
Также азот можно получить путем восстановления азотной кислоты активными металлами.
HNO3(разб.) + Zn → Zn(NO3)2 + N2 + H2O

Химические свойства
Азот восхищает – он принимает все возможные для себя степени окисления от -3 до +5.

Молекула азота отличается большой прочностью из-за наличия тройной связи. Вследствие этого многие реакции эндотермичны: даже горение
азота в кислороде сопровождается поглощением тепла, а не выделением, как обычно бывает при горении.

- Реакция с металлами
- Реакция с неметаллами
Без нагревания азот взаимодействует только с литием. При нагревании реагирует и с другими металлами.
N2 + Li → Li3N (нитрид лития)
N2 + Mg → (t) Mg3N2
N2 + Al → (t) AlN
Важное практическое значение имеет синтез аммиака, который применяется в дальнейшим при изготовлении удобрений, красителей, лекарств.
N2 + H2 ⇄ (t, p) NH3
Аммиак
Бесцветный газ с резким едким запахом, раздражающим слизистые оболочки. Раствор концентрацией 10% аммиака применяется в медицинских целях,
называется нашатырным спиртом.

Получение
В промышленности аммиак получают прямым взаимодействием азота и водорода.
N2 + H2 ⇄ (t, p) NH3
В лабораторных условиях сильными щелочами действуют на соли аммония.
NH4Cl + NaOH → NH3 + NaCl + H2O
Химические свойства
Аммиак проявляет основные свойства, окрашивает лакмусовую бумажку в синий цвет.
- Реакция с водой
- Основные свойства
- Восстановительные свойства
Образует нестойкое соединение – гидроксид аммония, слабое основание. Оно сразу же распадается на воду и аммиак.
NH3 + H2O ⇄ NH4OH
Как основание аммиак способен реагировать с кислотами с образованием солей.
NH3 + HCl → NH4Cl (хлорид аммония)
NH3 + HNO3 → NH4NO3 (нитрат аммония)

Поскольку азот в аммиаке находится в минимальной степени окисления -3 и способен только ее повышать, то аммиак проявляет выраженные
восстановительные свойства. Его используют для восстановления металлов из их оксидов.
NH3 + FeO → N2↑ + Fe + H2O
NH3 + CuO → N2↑ + Cu + H2O
Горение аммиака без катализатора приводит к образованию азота в молекулярном виде. Окисление в присутствии катализатора сопровождается
выделением NO.
NH3 + O2 → (t) N2 + H2O
NH3 + O2 → (t, кат) NO + H2O

Соли аммония
Получение
NH3 + H2SO4 → NH4HSO4 (гидросульфат аммония, избыток кислоты)
3NH3 + H3PO4 → (NH4)3PO4
Химические свойства
Помните, что по правилам общей химии, если по итогам реакции выпадает осадок, выделяется газ или образуется вода – реакция идет.
- Реакции с кислотами
- Реакции с щелочами
- Реакции с солями
- Реакция гидролиза
- Реакции разложения
NH4Cl + H2SO4 → (NH4)2SO4 + HCl↑
В реакциях с щелочами образуется гидроксид аммония – NH4OH. Нестойкое основание, которое легко распадается на воду и аммиак.
NH4Cl + KOH → KCl + NH3 + H2O
(NH4)2SO4 + BaCl2 = BaSO4↓ + NH4Cl
В воде ион аммония подвергается гидролизу с образованием нестойкого гидроксида аммония.
NH4+ + H2O ⇄ NH4OH + H+
NH4OH ⇄ NH3 + H2O
NH4Cl → (t) NH3↑ + HCl↑
(NH4)2CO3 → (t) NH3↑ + H2O + CO2↑
NH4NO2 → (t) N2↑ + H2O
NH4NO3 → (t) N2O↑ + H2O
(NH4)3PO4 → (t) NH3↑ + H3PO4

Оксид азота I – N2O
Закись азота, веселящий газ – N2O – обладает опьяняющим эффектом. Несолеобразующий оксид. При н.у. является бесцветным газом с приятным
сладковатым запахом и привкусом. В медицине применяется в больших концентрациях для ингаляционного наркоза.

Получают N2O разложением нитрата аммония при нагревании:
NH4NO3 → N2O + H2O
Оксид азота I разлагается на азот и кислород:
N2O → (t) N2 + O2
Оксид азота II – NO
Окись азота – NO. Несолеобразующий оксид. При н.у. бесцветный газ, на воздухе быстро окисляется до оксида азота IV.
Получение
В промышленных масштабах оксид азота II получают при каталитическом окислении аммиака.
NH3 + O2 → (t, кат) NO + H2O
В лабораторных условиях – в ходе реакции малоактивных металлов с разбавленной азотной кислотой.
Cu + HNO3(разб.) → Cu(NO3)2 + NO + H2O
Химические свойства
На воздухе быстро окисляется с образованием бурого газа – оксида азота IV – NO2.
NO + O2 → NO2

Оксид азота III – N2O3
При н.у. жидкость синего цвета, в газообразной форме бесцветен. Высокотоксичный, приводит к тяжелым ожогам кожи.

Получение
Получают N2O3 в две стадии: сначала реакцией оксида мышьяка III с азотной кислотой, затем
охлаждением полученной смеси газов до температуры – 36 °C.
As2O3 + HNO3 → H3AsO4 + NO↑ + NO2↑
При охлаждении газов образуется оксид азота III.
NO + NO2 → N2O3
Химические свойства
Является кислотным оксидом. соответствует азотистой кислота – HNO2, соли которой называются нитриты (NO2-).
Реагирует с водой, основаниями.
H2O + N2O3 → HNO2
NaOH + N2O3 → NaNO2 + H2O
Оксид азота IV – NO2
Бурый газ, имеет острый запах. Ядовит.

Получение
В лабораторных условиях данный оксид получают в ходе реакции меди с концентрированной азотной кислотой. Также NO2 выделяется при
разложении нитратов.
Cu + HNO3(конц) → Cu(NO3)2 + NO2 + H2O

Cu(NO3)2 → (t) CuO + NO2 + O2
Pb(NO3)2 → (t) PbO + NO2 + O2
Химические свойства
Проявляет высокую химическую активность, кислотный оксид.
- Окислительные свойства
- Реакции с водой и щелочами
Как окислитель NO2 ведет себя в реакциях с фосфором, углеродом и серой, которые сгорают в нем.
NO2 + C → CO2 + N2
NO2 + P → P2O5 + N2
Окисляет SO2 в SO3 – на этой реакции основана одна из стадий получения серной кислоты.
SO2 + NO2 → SO3 + NO
Оксид азота IV соответствует сразу двум кислотам – азотистой HNO2 и азотной HNO3. Реакции с
водой и щелочами протекают по одной схеме.
NO2 + H2O → HNO3 + HNO2
NO2 + LiOH → LiNO3 + LiNO2 + H2O
Если растворение в воде оксида проводить в избытке кислорода, образуется азотная кислота.
NO2 + H2O + O2 → HNO3

© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
химический элемент, атомный номер 7, атомная масса 14,0067. В воздухе свободный азот (в виде молекул N2) составляет 78,09%. Немного легче воздуха, плотность 1,2506 кг/м3 при нулевой температуре и нормальном давлении. Температура кипения -195,8°C. Критическая температура -147°C и критическое давление 3,39 МПа. Бесцветный, без запаха и вкуса, нетоксичен, невоспламеняемый, невзрывоопасен и не поддерживающий горение газ в газообразном состоянии при обычной температуре обладает высокой инертностью. Химическая формула – N. В обычных условиях молекула азота двухатомная – N2.

История открытия азота
До сих пор ведутся споры о том, кто был первооткрывателем. В 1772 г. шотландский врач Даниель Резерфорд (Daniel Rutherford) пропуская воздух через раскаленный уголь, а потом через водный раствор щелочи – получил газ, который он назвал «ядовитый газ». Оказалось, что горящая лучинка, внесенная в сосуд, наполненный газом, гаснет, а живое существо в атмосфере этого газа быстро гибнет. Кстати, увидеть опыт с горячей лучинкой можно в видео.
В тоже время британский физик Генри Кавендшин (Henry Cavendish) проводя подобный опыт получил N2назвав его «удушливый воздух», британский естествоиспытатель Джозеф Пристли (Joseph Priestley) дал ему имя «дефлогистированный воздух», шведский химик Карл Вильгельм Шееле (Carl Wilhelm Scheele) – «испорченный воздух».
Окончательное имя «азот» дал французский ученый Антуан Лоран Лавуазье (Antoine Laurent de Lavoisier).
Слово «азот» греческого происхождения и означает «безжизненный».
Азот довольно легко поглощается раскаленным карбидом кальция, образуя при этом важный технический продукт – цианамид кальция и об этом уже писали в статье о получении ацетилена из карбида кальция.
Способы получения азота
Получение N2 в промышленных масштабах основано на производстве его из воздуха путем фракционной перегонки (см. получение азота).
Виды азота
Жидкий азот
бесцветная жидкость без запаха с температурой кипения -195,8°C при давлении 101,3 кПа и удельным объемом 1,239 дм3/кг при температуре -195,8°C и давлении 101,3 кПа. Жидкий азот используется как хладагент. Жидкий азот может вызвать обморожение кожи и поражение слизистой оболочки глаз.
Закись азота
бесцветный газ, имеет сладковатый вкус и слабый, приятный запах. Свойства этого газа были изучены английским химиком Гемфри Дэви (Humphry Davy) в 1799 году. Интересуясь действием различных газов на организм человека, Дэви обычно испытывал их на себе. При вдыхании закиси азота, он пришел в возбужденное состояние, сопровождаемое смехом. За эти свойства закись азота была названа им – веселящим газом. В дальнейшем было установлено, что при более длительном вдыхании закиси азота наступает потеря сознания. Закись азота – окисел, не дающий кислот, он относится к несолеобразующим окислам.
Закись азота (N2O) не может быть получена из газообразного кислорода и N2, она образуется из азотнокислой соли аммония, которая при осторожном нагревании разлагается на закись азота и воду по реакции:
NH4NO3 = N2O + 2H2O
Газообразный азот
относительно инертный по своим свойствам газ без цвета и запаха плотностью 1,25046 кг/м3 при 0°C и давлении 101,3 кПа. Удельный объем газообразного азота равен 860,4 дм3/кг при давлении около 105 Па и температуре 20°C.
В отличие от кислорода, который взаимодействует почти со всеми элементами, встречающимися в природе, газообразный азот при комнатной температуре соединяется с единственным элементом – литием, образуя при этом нитрид лития:
N2 + 6Li = 2Li3N
Но при высоких температурах ряд металлов (титан, молибден и др.) с азотом образуют нитриды, снижающие механические свойства и поэтому его концентрацию в зоне плавления стремятся ограничить.
Применение азота
Азот нашел применение во многих отраслях промышленности и ниже приведен небольшой список:
- для создания инертной атмосферы при производстве, хранении и транспортировке легко окисляемых продуктов;
- при высокотемпературных процессах (например – сварка и резка) обработки металлов, не взаимодействующих с азотом;
- для консервации замкнутых металлических сосудов и трубопроводов.
Применение азота в сварке
N2 является инертным по отношению к меди и ее сплавам (не растворяется в меди и не реагирует с ней) даже при высоких температурах. Азот применяют, как в чистом виде, так и в составе защитного газовой смеси с аргоном Ar (70-90%) + N2 (30-10%) для сварки меди и ее сплавов.

Также газ азот используют для сварки аустенитных нержавеющих сталей – исключительно как компонент защитной газовой смеси с аргоном.
Возникает логичный вопрос: «Если он образует карбиды, какой смысл его использовать для сварки нержавеющих сталей, в составе которых есть карбидообразующие элементы?»
Все дело в том, что даже сравнительно небольшое содержание N2увеличивает тепловую мощность дуги. Именно из-за этого свойства, его чаще всего используют не для сварки, а для плазменной резки.
При сварке полуавтоматом нержавейки добавление небольшого количества азота к смеси аргона с кислородом (95-97,5% Ar, 1% O2, 1,5-3% N2) позволяет добиться равномерной аустенитной структуры в сварных швах. При добавлении азота более 10% начинается обильное выделение дыма, но это не оказывает какого-либо негативного влияния на качество сварного шва нержавеющей стали.
При сварке полуавтоматом малоуглеродистых сталей содержание N2 в газовой смеси более 2% вызывает пористость при сварке в один проход. Концентрация N2 менее 0,5% вызывает пористость в сварном шве при многопроходной сварке.
Применение смеси Ar c высоким содержанием N2 для сварки меди и ее сплавов вызывает большое разбрызгивание метала сварочной ванны.
Вредность и опасность азота
Азот относится к нетоксичным газам, но может действовать как простой асфиксант (удушающий газ). Удушье наступает тогда, когда уровень кислорода в воздухе сокращается на 75% или становится ниже нормальной концентрации.
В больших количествах он очень вреден и опасен для организма человека.
Хранение и транспортировка азота
Выпускают азот по ГОСТ 9293 газообразным и жидким. Для сварки и плазменной резки применяют газообразный 1-го (99,6% N2) и 2-го (99,0% N2) сортов.
Хранят и транспортируют его в сжатом состоянии в стальных баллонах по ГОСТ 949.
Баллоны окрашены в черный цвет и надписью желтыми буквами «АЗОТ» на верхней цилиндрической части.

Характеристики азота
Характеристики N2 указаны в таблицах ниже:
Коэффициенты перевода объема и массы N2 при Т=15°C и Р=0,1 МПа
Масса, кг | Объем | |
|---|---|---|
Газ, м3 | Жидкость, л | |
| 1,170 | 1 | 1,447 |
| 0,809 | 0,691 | 1 |
| 1 | 0,855 | 1,237 |
Коэффициенты перевода объема и массы N2 при Т=0°C и Р=0,1 МПа
| Масса, кг | Объем | |
|---|---|---|
| Газ, м3 | Жидкость, л | |
| 1,251 | 1 | 1,548 |
| 0,809 | 0,646 | 1 |
| 1 | 0,799 | 1,237 |
Азот в баллоне
| Наименование | Объем баллона, л | Масса газа в баллоне, кг | Объем газа (м3) при Т=15°C, Р=0,1 МПа |
|---|---|---|---|
| N2 | 40 | 7,37 | 6,3 |
Благодаря информации в таблице можно дать ответы на вопросы, которые часто задают сварщики:
- Сколько литров в баллоне азота?
Ответ: 40 литров - Сколько азота в баллоне 40л?
Ответ: 6,3 м3 или 7,37 кг - Сколько весит баллон с азотом 40 литров
Ответ:
58,5 кг – масса пустого баллона из углеродистой стали согласно ГОСТ 949;
7,37 – кг масса N2 в баллоне;
Итого: 58,5 + 7,37 = 65,87 кг вес баллона с азотом.
Давление азота в баллоне при различной температуре окружающей среды
| Температура окружающей среды | Давление в баллоне, МПа |
|---|---|
-40 | 11,2 |
-30 | 11,9 |
-20 | 12,6 |
-10 | 13,4 |
14,0 | |
+10 | 14,7 |
+20 | 15,3 |
+30 | 15,9 |
Источник
Ключевые слова конспекта: свойства простых веществ, азот, строение и физические свойства, химические свойства, производство и применение азота.
Азот – элемент группы VA. Его важнейшие параметры приведены в таблице.
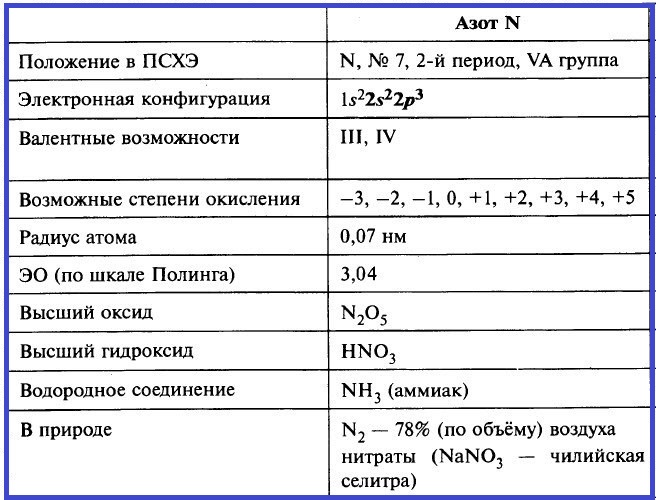
Таблица «Важнейшие параметры элемента азот»
На валентном энергетическом уровне атома азота нет вакантных орбиталей. Следовательно, электронная пара 2s-подуровня не может быть распарена, и поэтому азот в своих соединениях не может быть пятивалентным. Максимальная валентность азота в соединениях – IV.
Азот проявляет степени окисления от –3 (низшей) до +5 (высшей). Примеры соединений с различными степенями окисления азота приведены в таблице.

Примеры веществ с различными степенями окисления азота и фосфора
СТРОЕНИЕ И ФИЗИЧЕСКИЕ СВОЙСТВА АЗОТА
Для азота не характерна аллотропия, элемент азот образует одно простое вещество – N2. Это молекулярное вещество, молекула азота образована двумя атомами азота, связь – ковалентная неполярная, тройная (одна σ- и две π-связи):
Тройная связь в молекуле азота чрезвычайно прочна, её энергия составляет 946 кДж/моль. Именно это обусловливает крайне низкую реакционную способность азота.
Молекулярный азот – газ (при обычных условиях), без цвета, без запаха, чуть легче воздуха (DB = 28/29 ≈ 0,966), плохо растворим в воде.
ХИМИЧЕСКИЕ СВОЙСТВА АЗОТА
Электроотрицательность элемента азота довольно высока, но химическая активность азота – простого вещества крайне низкая. Это обусловлено прочностью тройной связи в молекуле азота.
Химические свойства азота представлены в таблице ниже. В обычных условиях азот взаимодействует только с литием Li, при нагревании азoт реагирует с металлами с образованием нитридов. Если говорить о неметаллах, то азот реагирует с водородом и кислородом. С водородом реакция идёт при нагревании и повышенном давлении, требуется катализатор.
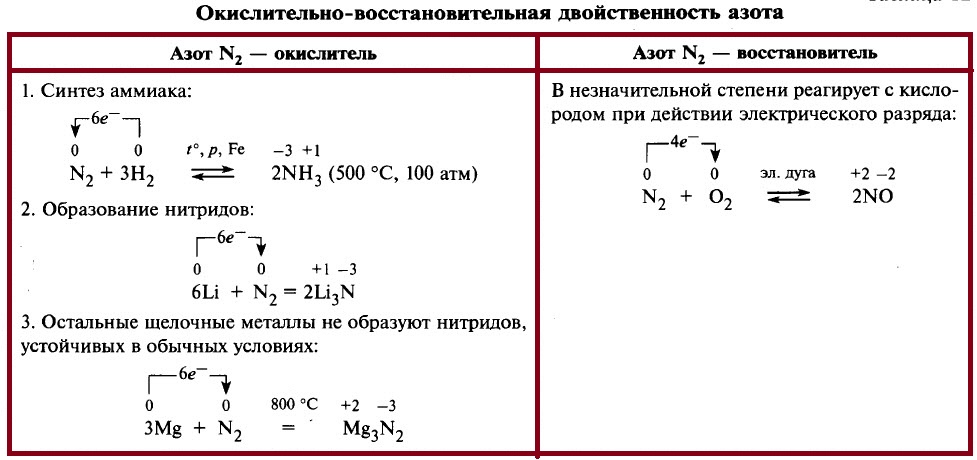
Реакция азота с кислородом начинается при температуре 3000–4000 °С, но даже при температуре 4000 °С содержание NO составляет всего около 10%. В отличие от других реакций кислорода с простыми веществами, эта реакция – эндотермическая, на образование 1 моль NO требуется 90 кДж. Обычно реакцию с кислородом осуществляют в электрической дуге, но всё равно она идёт с незначительным выходом продукта.
ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ АЗОТА
В промышленности азот получают методом разделения жидкого воздуха на компоненты. Лабораторным способом получения азота является термическое разложение нитрита аммония:![]()
Эта реакция относится к типу конпропорционирования: восстановителем является азот в составе иона аммония (N–3), а окислителем – азот в составе нитрит-иона (N+3).
Применение азота. Большая часть азота (примерно 3/4) расходуется для синтеза аммиака, который, в свою очередь, используется для получения удобрений.
Применение газообразного азота обусловлены его инертными свойствами. Газообразный азoт пожаро- и взрывобезопасен, препятствует окислению, гниению.
В лабораториях азот применяется для создания инертной среды при проведении некоторых реакций.
В нефтехимии его применяют для продувки резервуаров и трубопроводов, проверки работы трубопроводов под давлением, увеличения выработки месторождений.
В горнодобывающем деле азот может использоваться для создания в шахтах взрыво–безопасной среды, для распирания пластов породы.
В производстве электроники его применяют для продувки областей, не допускающих наличия окисляющего кислорода.
Aзот используется в коксовом производстве («сухое тушение кокса») при выгрузке кокса из коксовых батарей, а также для «передавливания» топлива в ракетах из баков в насосы или двигатели.
В пищевой промышленности азот используется как газ, наполняющий упаковки, как хладагент.
Газообразным азотом заполняют камеры шин летательных аппаратов.
В жидком азоте, имеющем температуру – 196 °С, хранят в медицинских и исследовательских целях клетки, органы, ткани, другие биологические объекты. Жидкий азот применяют в косметологии для удаления бородавок и родинок.

Конспект урока «Свойства простых веществ: Азот».
Следующая тема: «Свойства простых веществ: Фосфор».
Источник
