5 какие физические свойства имеют циклоалканы

Циклоалканы, также полиметиленовые углеводороды[1], нафтены, цикланы, или циклопарафины — циклические насыщенные углеводороды, по химическим свойствам близки к предельным углеводородам. Входят в состав нефти. Открыты В. В. Марковниковым в 1883 году из бакинской нефти[2]
В нефтехимической промышленности нафтены являются источником получения ароматических углеводородов путём каталитического риформинга. Наибольшее практическое значение приобрёл циклогексан, применяемый для синтеза капролактама, адипиновой кислоты и других соединений, используемых в производстве синтетического волокна.
К циклоалканам относят предельные углеводороды с общей формулой CnH2n, имеющие циклическое строение. Названия циклоалканов строятся из названий соответствующих алканов с добавлением приставки цикло- (циклопропан, 1,3-диметилциклогексан).
Для циклоалканов характерны следующие виды изомерии:
- Изомерия углеродного скелета;
- Пространственная;
- Межклассовая изомерия с алкенами.
Все атомы углерода в молекулах циклоалканов имеют sp³-гибридизацию. Однако величины углов между гибридными орбиталями в циклобутане и особенно в циклопропане не 109°28′, а меньше из-за геометрии, что создаёт в молекулах напряжение, поэтому малые циклы очень реакционноспособны.
Циклопропан применяют для наркоза, но его применение ограничено из-за взрывоопасности.
Физические свойства[править | править код]
При обычных условиях первые два члена ряда (C3 — C4) — газы, (C5 — C11) — жидкости, начиная с C12 — твёрдые вещества. Температуры кипения и плавления циклоалканов выше, чем у соответствующих алканов. Циклоалканы в воде практически не растворяются. При увеличении числа атомов углерода возрастает молярная масса, следовательно, увеличивается температура плавления.
Температуры плавления и кипения некоторых циклоалканов:
| Циклоалкан | Т. пл., °C | Т. кип., °C |
|---|---|---|
| циклопропан C3H6 | −126,9 | −32,7 |
| циклобутан C4H8 | −50 | 12 |
| циклопентан C5H10 | −93,9 | 49,3 |
| циклогексан C6H12 | 6,5 | 80 |
| циклогептан C7H14 | −12 | 118,5 |
| циклооктан C8H16 | 14,3 | 63 при 45 мм рт. ст. |
| циклононан C9H18 | 9,7 | 69 при 14 мм рт. ст. |
| циклодекан C10H20 | 10,8 | 201 |
| циклоундекан C11H22 | −7,2 | 91 при 12 мм рт. ст. |
| циклододекан C12H24 | 61,6 | 243 |
| циклотридекан C13H26 | 23,5 | 128 при 20 мм рт. ст. |
| циклотетрадекан C14H28 | 54 | 131 при 11 мм рт. ст. |
| циклопентадекан C15H30 | 62,1 | 147 при 12 мм рт. ст. |
Получение циклоалканов[править | править код]
- Дегалогенирование дигалогенпроизводных:
Br-CH2-CH2-CH2-Br + Mg или Zn = циклопропан + MgBr2 или ZnBr2
- Гидрирование бензола и его гомологов (образуются циклогексан или его производные):
C6H6 +3H2 = C6H12
Химические свойства[править | править код]
По химическим свойствам малые и обычные циклы существенно различаются между собой. Циклопропан и циклобутан склонны к реакциям присоединения, то есть сходны в этом отношении с алкенами. Циклопентан и циклогексан по своему химическому поведению близки к алканам, так как вступают в реакции замещения.
- Циклопропан и циклобутан способны присоединять бром:
C3H6 + Br2 → BrCH2—CH2—CH2Br
- Также циклопропан и циклобутан могут присоединять галогеноводороды, присоединение происходит с раскрытием цикла, по правилу Марковникова[источник не указан 675 дней].
- Циклопропан, циклобутан и циклопентан могут присоединять водород, давая соответствующие нормальные алканы. Присоединение происходит при нагревании в присутствии никелевого катализатора:
C4H8 + H2 → CH3—CH2—CH2—CH3
Примечания[править | править код]
Литература[править | править код]
- Кузьменко Н. Е., Еремин В. В., Попков В. А. Начала химии. Современный курс для поступающих в вузы.. — М.: Экзамен, 2002.
Источник
Öèêëîàëêàíû – ïðåäåëüíûå öèêëè÷åñêèå óãëåâîäîðîäû. Ïðîñòåéøèå ïðåäñòàâèòåëè:
Îáùàÿ ôîðìóëà – ÑnH2n.
Ñòðîåíèå öèêëîàëêàíîâ.
Àòîìû óãëåðîäà íàõîäÿòñÿ â sp3 – ãèáðèäèçàöèè. Óãîë çàâèñèò îò ðàçìåðà öèêëà.
Èçîìåðèÿ öèêëîàëêàíîâ.
Äëÿ öèêëîàëêàíîâ õàðàêòåðíà èçîìåðèÿ óãëåðîäíîãî ñêåëåòà è ïðîñòðàíñòâåííàÿ èçîìåðèÿ:

Âñå ñîåäèíåíèÿ äåëÿò íà ìàëûå (Ñ3, Ñ4) öèêëû è íà îáû÷íûå (C5 – Ñ7) öèêëû.
Ôèçè÷åñêèå ñâîéñòâà öèêëîàëêàíîâ.
Ïðè îáû÷íûõ óñëîâèÿõ:
Ñ3, Ñ4 – ãàçû;
Ñ5-Ñ16 – æèäêîñòè;
Ñ17 è âûøå – òâåðäûå âåùåñòâà.
Òåìïåðàòóðû ïëàâëåíèÿ è êèïåíèÿ âûøå, ÷åì ó àëêàíîâ.
Ïîëó÷åíèå öèêëîàëêàíîâ.
1. Îòùåïëåíèå 2õ àòîìîâ ãàëîãåíà îò äèãàëîãåíîâ:

2. Ãèäðèðîâàíèå àðîìàòè÷åñêèõ óãëåâîäîðîäîâ:

Õèìè÷åñêèå ñâîéñòâà öèêëîàëêàíîâ.
Ìàëûå è îáû÷íûå öèêëû èìåþò ðàçëè÷íûå ñâîéñòâà. Íàïðèìåð, äëÿ öèêëîáóòàíà è öèêëîïðîïàíà ñâîéñòâåííà ðåàêöèÿ ïðèñîåäèíåíèÿ:
À) áðîìà:

Á) âîäîðîäà (â ïðèñóòñòâèå íèêåëåâîãî êàòàëèçàòîðà):

Â) ãàëîãåíâîäîðîäà (ïî ïðàâèëó Ìàðêîâíèêîâà):

Ðåàêöèÿ çàìåùåíèÿ ñâîéñòâåííà äëÿ îáû÷íûõ öèêëîâ, ò.ê. îíè áîëåå óñòîé÷èâû:

Äåãèäðèðîâàíèå:

Ïîä âîçäåéñòâèåì îêèñëèòåëåé îáðàçóåòñÿ êèñëîòà:

Ïðèìåíåíèå öèêëîàëêàíîâ.
Öèêëîàëêàíû èñïîëüçóþò äëÿ ïîëó÷åíèÿ öèêëîãåêñàíîëà, öèêëîãåêñàíîíà, àäèïèíîâîé êèñëîòû, êàïðîëàêòàìà, à òàêæå â êà÷åñòâå ðàñòâîðèòåëÿ. Öèêëîïðîïàí âûñòóïàåò â êà÷åñòâå èíãàëÿöèîííîãî ñðåäñòâà.
Êàëüêóëÿòîðû ïî õèìèè | |
| Õèìèÿ îíëàéí íà íàøåì ñàéòå äëÿ ðåøåíèÿ çàäà÷ è óðàâíåíèé. | |
| Êàëüêóëÿòîðû ïî õèìèè | |
Õèìèÿ 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
| Îñíîâíàÿ èíôîðìàöèÿ ïî êóðñó õèìèè äëÿ îáó÷åíèÿ è ïîäãîòîâêè â ýêçàìåíàì, ÃÂÝ, ÅÃÝ, ÎÃÝ, ÃÈÀ | |
| Õèìèÿ 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
Àëêèíû. Ñâîéñòâà àëêèíîâ. | |
| Àëêèíû ýòî íåïðåäåëüíûå óãëåâîäîðîäû, ìîëåêóëû êîòîðûõ ñîäåðæàò òðîéíóþ ñâÿçü. | |
| Àëêèíû. Ñâîéñòâà àëêèíîâ. | |
Àëêåíû. Ñâîéñòâà àëêåíîâ. | |
| Àëêåíû íåïðåäåëüíûå óãëåâîäîðîäû, â ñîñòàâå êîòîðûõ åñòü îäíà äâîéíàÿ ñâÿçü. | |
| Àëêåíû. Ñâîéñòâà àëêåíîâ. | |
Источник
Циклоалканы
Нелюбин Владислав, Бочков Иван 10А
Циклоалканы, также нафтены,
циклоны или циклопарафины – ациклические насыщенные углеводороды, по химическим
свойствам близки к предельным углеводородам. Входят в состав нефти. Циклоалканы
открыты В.В. Марковниковым в 1883 году. (Циклопарафины главным образом находятся в составе некоторых нефтей. Отсюда и другое название циклопарафинов — нафтены)
Номенклатура:
Циклоалканы – это циклические
углеводороды, не содержащие в молекуле кратных связей и соответствующие общей
формуле: CnH2n.
Циклопропан:
Циклогексан:


Прочность связей в циклических соединениях
зависит от числа атомов, участвующих в образовании цикла. Она определяется
степенью его напряженности, обусловленной изменением валентных углов атомов
цикла и отклонением этих атомов от нормального направления.
Для циклопропана межъядерные углы составляют
60º, как в равностороннем треугольнике, для циклобутана – 90º, как в квадрате,
а в циклопентане – 108º, как в правильном пятиугольнике. Нормальный валентный
угол для атома углерода – 109,5º. Поэтому при расположении в названных
соединениях всех атомов углерода в одной плоскости уменьшение валентных углов
составляет в циклопропане – 49,5º, в циклобутане – 19,5º, в циклопентане –
1,5º.
Чем больше отклонение валентного угла от
нормального, тем более напряжены и, следовательно, непрочны циклы. Однако в
отличие от циклопропана циклобутан и циклопентан имеют неплоские циклы. Один из
атомов углерода непрерывно выходит из плоскости. Циклобутан существует в виде
неплоских “сложенных” конформаций. Циклопентан характеризуется
конформацией “конверт”.
Для циклогексана, как правильного
шестиугольника, межъядерные углы составляют 120º. Если бы молекула циклогексана
имела плоское строение, то отклонение от нормального валентного угла атома
углерода составляло:109,5º–120º = 10,5º.
Однако циклогексан и большие циклы имеют неплоское строение. В рассматриваемой
молекуле циклогексана сохраняются обычные валентные углы при условии его
существования в двух конформациях “кресла” и “ванны”.
Конформация “кресла” менее напряжена, поэтому циклогексан существует
преимущественно в виде конформеров I и III,
причем цикл претерпевает непрерывную инверсию
с промежуточным образованием конформера II:
ось симметрии II III
I
Двенадцать связей С-Н,
которые имеются у циклогексана в конформации “кресла”, делятся на два
типа. Шесть связей направлены радиально
от кольца к периферии молекулы и называются экваториальными связями (e- связи),
остальные шесть связей направлены параллельно друг другу и оси симметрии и
называются аксиальными (a- связи). Три аксиальные связи направлены в одну
сторону от плоскости цикла, а три – в другую (имеется чередование: вверх-вниз)
Физические свойства:
При обычных условиях первые два члена ряда (С3 — С4) —
газы, (С5 — С16) — жидкости, начиная с С17 —
твёрдые вещества. Температуры
кипения и плавления циклоалканов выше, чем у соответствующих алканов Циклоалканы в воде практически
не растворяются, зато растворяются в химических растворителях. При увеличении числа атомов углерода возрастает молярная
масса, следовательно, увеличивается температура
плавления.
Таблица физических свойств:
Циклоалкан | Т. пл., °С | Т. кип., °С |
циклопропан С3H6 | −127,5 | −32,7 |
циклобутан С4H8 | −50 | 12 |
циклопентан С5H10 | −93,9 | 49,3 |
циклогексан С6H12 | 6,5 | 80 |
циклогептан С7H14 | −12 | 118,5 |
циклооктан С8H16 | 14,3 | 63 при 45 мм рт.ст. |
циклононан С9H18 | 9,7 | 69 при 14 мм рт.ст. |
циклодекан С10H20 | 10,8 | 201 |
циклоундекан С11H22 | −7,2 | 91 при 12 мм рт.ст. |
циклододекан С12H24 | 61,6 | 243 |
циклотридеканС13H26 | 23,5 | 128 при 20 мм рт.ст. |
циклотетрадекан С14H28 | 54 | 131 при 11 мм рт.ст. |
циклопентадекан С15H30 | 62,1 | 147 при 12 мм рт.ст. |
Для циклоалканов характерна пространственная изомерия и изомерия углеродного скелета. Также, поскольку формулы циклоалканов и алкенов совпадают, то изомерами циклоалканов являются и алкены.


При наличии двух заместителей в циклических соединениях также возможна цис-транс-изомерия. Метильные группы в приведенных примерах могут располагаться по одну сторону плоскости кольца (такой изомер называется цис-изомером) и по разные стороны (такой изомер называется транс-изомером).
Естественно, что при наложении друг на друга моделей цис- и транс- изомеров они не совмещаются. Взаимные изомеризации требуют разрыва цикла с последующим его замыканием или разрыва связи заместителя с углеродным атомом цикла и образованием новой связи с другой стороны цикла.
Следует отметить, что в циклических соединениях возможно возникновение не только цис-транс-, но и зеркальной изомерии. При наложении модели молекулы цис-изомера с одинаковыми заместителями и ее зеркального отражения они совмещаются, в то время как таковое невозможно для цис-изомера с различными заместителями. Для транс-изомеров совмещение модели молекулы и ее зеркального отражения невозможно как при одинаковых, так и различающихся заместителях.

Химические свойства:
Химические
свойства циклоалканов сильно зависят от размера цикла, определяющего его
устойчивость. Трех- и четырехчленные циклы (малые циклы), являясь насыщенными,
тем не менее, резко отличаются от всех остальных предельных углеводородов.
Валентные углы в циклопропане и циклобутане значительно меньше нормального
тетраэдрического угла 109°28’, свойственного sp3-гибридизованному атому углерода.
Это приводит
к большой напряженности таких циклов и их стремлению к раскрытию под действием
реагентов. Поэтому циклопропан, циклобутан и их производные вступают в реакции
присоединения, проявляя характер ненасыщенных соединений. Легкость реакций
присоединения уменьшается с уменьшением напряженности цикла в ряду: циклопропан
> циклобутан >> циклопентан.
Наиболее
устойчивыми являются 6-членные циклы, в которых отсутствуют угловое и другие
виды напряжения.
Реакции:
Малые циклы (C3, C4, C5) вступают в реакцию гидрирования:

Циклопропан
вступает в реакции галогенирования и гидрогалогенирования:


В других циклах (начиная с
С5) угловое напряжение снимается благодаря неплоскому строению молекул. Поэтому
для циклоалканов (С5 и выше) вследствие их устойчивости характерны реакции, в
которых сохраняется циклическая структура, т.е. реакции замещения:

Галогенирование Нитрование
Им также характерны реакции
дегидрирования, и окисления в присутствии катализатора:

Получение
циклоалканов:
1) При переработке нефти:

2) Дегалогенирование
дегалогенпроизводных:

3) Гидрирование бензола
и его гомологов:

4)Получение пиролизом
солей дикарбоновых кислот. Циклопентан и циклогексан образуются при пиролизе
(нагревании без доступа воздуха) кальциевых солей соответственно
гександикарбоновой и гептандикарбоновой кислот и воставлении образующихся
кетонов:

Значение для человека.
Циклоалканы находят
применение в разных областях хозяйства.
Так, циклопентан используется в разных синтезах и как добавка к моторному
топливу для повышения качества. Циклогексан используется для синтеза
полупродуктов при производстве синтетических волокон нейлона и капрона.
Циклопропан используют в
медицине как наркотический препарат (в соединении с кислородом), он
оказывает сильнейшее обезболивающее действие. Также циклоалканы содержатся в
сильнейших растительных ядах, зафиксировано примерно 100 тыс. смертей после
отравление ими. Циклоалканы присутствуют в незаменимых гормонах, без которых
человеку не выжить, в желчных кислотах, и в половых гормонах – тестостерон, —
основной мужской половой гормон, без которого невозможно размножение.
ЗАДАНИЯ:
Номенклатура
1.1) Выберите из данных названий корректные:
2,3-диметилциклопропан, 1-метил-4-бутилциклопентан, 1,5-диметилциклогексан,
изопропил-циклобутан, 1-метил-3-этилциклобутан, циклоэтан, циклопентан, 1,2-диизобутанциклобутан,
1,2-дибутадиенциклопентан, бутил-циклобутан.
1.2) Из предыдущего пункта выберите вещества, которые
существуют, но имеют другое название. Дайте им правильное название.
Изомерия углеродного скелета
2.1) Напишите всех изомеров циклопентана (и дайте название). К
каким классам веществ они принадлежат?
2.2) Чего больше – изомеров декана или циклодекана? Чего
больше – алканов вида C100H202 или циклоалканов вида C100H200?
Химические свойства:
3.1)Почему в реакции с малым циклом он распадается, в отличие
от большого цикла? Какой цикл является самым устойчивым?
3.2) Получите за несколько реакций из циклогексана фенолят
натрия. Какое наименьшее число реакций вам понадобилось?
Напоминание: По правилам международной номенклатуры главной считается
цепь углеродных атомов, образующая цикл. Название строится по названию этой
замкнутой цепи с добавление приставки “цикло” (циклобутан, циклопентан). При
наличии заместителей нумерацию углеродных атомов в кольце проводят так, чтобы
номера заместителей были как можно меньше. Если заместитель один, его номер в
цикле не пишется.
ОТВЕТЫ:
1.1)
1-метил-3-этилциклобутан, циклопентан,
1,2-диизобутанциклобутан, бутил-циклобутан.
1.2) 2,3-диметилциклопропан –
1,2-диметилциклопропан, 1-метил-4-бутилциклопентан –
1-бутил-3-метилциклопентан.
2.1) Это
циклоалканы и алкены. Циклоалканы: метил – циклобутан,
1,2-диметилциклопропан,этил-циклопропан. Алкены: пентен-1, пентен-2, 2-метилбутен-1,
3-метилбутен-1, 2-метилбутен-2, 2,2-диметилпропен.
2.2) Изомеров циклодекана, циклоалканов вида C100H200.
3.1) В малых циклах большое напряжение, они
стремятся раскрыться под действием реагентов. Самым устойчивым является шестичленный цикл.
3.2) К примеру: циклогексан –
бензол – хлорбензол – фенол – фенолят натрия. Возможно, можно получить быстрее,
чем за 4 реакции
Источник
Общая формула циклоалканов – CnH2n
Атомы углерода в молекулах циклоалканов связаны между собой только σ – связями. Циклоалканы широко распространены в природе. Они входят в состав нефти, смоляных кислот, стероидных гормонов, простограндинов, терпенов, витаминов и т.д.
Существует несколько классификаций циклоалканов: по числу атомов углерода в цикле, по количеству циклов в молекуле, по способу соединения циклических составляющих и т.д.
Устойчивость циклоалканов связана с степенью напряжения энергетического состояния молекулы. Устойчивость циклоалканов тем ниже, чем меньше атомов углерода входит в состав цикла.
Для циклоалканов характерна изомерия углеродного скетлета, стерео- или цис-транс-изомерия, пространственная изомерия а также межклассовая изомерия с алкенами.
Химические свойства циклоалканов
Для малых циклоалканов (С3-С4) характерны реакции присоединения, протекающие по радикальному механизму, в результате чего может происходить даже разрыв цикла. К таким реакциям относят галогенирование, которое проводят под действием УФ-излучения и при нагревании. Температура нагрева влияет на характер продуктов реакции присоединения хлора, присоединение брома, вне зависимости от внешних факторов протекает с разрывом цикла:
C3H6 + Cl2 → C2H5-Cl + HCl (t < 100![]() C);
C);
C3H6 + Cl2 → Cl-CH2-CH2-CH2-Cl + H2↑ (t > 100![]() C).
C).
Для малых циклов характерны реакции гидрирования, в результате которых образуются алканы. Условием протекания реакции служит нагрев и присутствие катализатора – никеля или платины:
C4H8 + H2 → CH3-(CH2)2-CH3.
Для циклоалканов среднего размера (С5-С6) характерны реакции замещения, протекающие по радикальному механизму, например, галогенирование. В этом случае получают моногалогенпроизводные циклоалканов. Однако, можно получить и полигалогенпроизводные циклоалканов:
C5H10 + Br2 → C5H9-Br + HBr;
C6H12 + Br2 → C6H11-Br + HBr;
C6H12 + 6Cl2 → C6H6Cl6 + 6HCl.
Окисление циклоалканов приводит к образованию двухосновных карбоновых кислот, циклических спиртов или циклических кетонов:
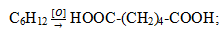
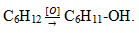
Для циклоалканов характерны реакции изомеризации:
С3Н5-СН3 ↔ С4Н8;
С3Н5-СН2 – OH ↔ C4H6 + H2O (kat = H2SO4).
Реакция дегидрирования циклогексана и его производных – один из способов получения бензола и его гомологов (реакция протекает при нагревании и в присутствии катализатора – платины):
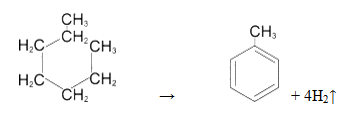
Физические свойства циклоалканов
Низшие циклоалканы (С3-С4) – газообразные вещества, средние (С5-С11) – жидкости, а высшие (> C12)
– твердые вещества. Циклоалканы практически нерастворимы в воде. С ростом молекулярной массы, температура плавления циклоалканов увеличивается.
Получение циклоалканов
Низшие циклоалканы получают путем их синтеза из дигалогенпроизводных алканов:
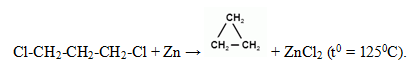
Средние циклоалканы получают следующим способом:
Br-(CH2)4-Br + 2LiHg = C4H8 + 2LiBr + Hg;
Br-(CH2)5-Br + 2LiHg = C5H10 + 2LiBr + Hg;
Циклоалканы с 5-ю и более атомами углерода можно получить пиролизом кальциевых или натриевых солей двухосновных карбоновых кислот (метод Ружичка). Циклогексан и его производные получают из нефти или по реакции гидрирования бензола и его гомологов.
Примеры решения задач
Источник
